不同pH条件下米谷蛋白的理化及结构特性研究
2019-03-30刘永乐王发祥王建辉李向红
李 双 刘永乐 俞 健 王发祥 王建辉 李向红
(长沙理工大学化学与食品工程学院,湖南 长沙 410114)
中国是世界上稻谷产量最大的国家,年产量2×108t以上[1]。大米生产中产生稻谷总重10%~15%的碎米,目前其主要用作低附加值产品加工或大米淀粉的提取原料,对其中8%左右大米蛋白的高值化利用较少。大米蛋白具有低过敏性,体内实际消化率大于88%的特点[2],在婴儿配方食品中可部分替代牛奶或大豆[3],并具有降胆固醇、降血脂、抗氧化及抗癌[4]等生物功能。因此,碎米中大米蛋白的高值化利用对提升稻谷精深加工与资源化利用水平具有重要意义。
大米蛋白中米谷蛋白含量高达80%[5],米谷蛋白是一种刚性的球状结构蛋白,亚基间通过分子内、分子间二硫键及疏水相互作用形成分子量64~500 kDa的致密分子聚集体[6],导致其在中性溶液中溶解度极低[7],限制了其应用领域。前人[7-9]对改善大米蛋白溶解性的研究主要集中于通过脱酰胺、酶法、糖基化等方法对大米蛋白进行改性来提高其溶解性,但仍存在最终蛋白质得率较低的问题,仍然有可能导致巨大的蛋白资源浪费。本课题组[7]前期研究发现,虽然pH 5.0和pH 7.0时其溶解度仅1.71%和6.18%,但酸性条件下,天然大米蛋白庞大的分子聚集体可充分分散,溶解度可显著增加,酸性条件下大米蛋白的可操控性增强。因此,本试验旨在探讨中性和酸性pH条件下大米蛋白的主要成分——米谷蛋白的理化和结构性质,为进一步拓宽大米蛋白的应用范围提供理论和技术支持。
1 材料与方法
1.1 材料与试剂
籼米:市售;
标准蛋白、丙烯酰胺:AR级,美国Sigma公司;
总巯基试剂盒:南京建成生物工程研究所;
牛血清蛋白:合肥博美生物科技有限责任公司;
SDS:国药集团化学试剂有限公司;
氢氧化钠、氯化钠、盐酸等化学试剂:分析纯。
1.2 仪器与设备
集热式恒温加热磁力搅拌器:DF-101S型,巩义市予华仪器有限责任公司;
高速万能粉碎机:FW100型,天津泰斯特仪器有限公司;
高速离心机:LG10-24.A 型,北京京立离心机有限公司;
真空冷冻干燥机:FD-1型,北京博医康实验仪器有限公司;
pH计:DELTA 320型,梅特勒-托利多(上海)有限公司;
鼓风干燥箱:DHG-9140A型,上海精宏实验设备有限公司;
紫外—可见分光光度计:UV2600型,上海舜宇恒平科学仪器有限公司;
透射电镜:Tecnai G2 Spirit TWIN型,美国FET公司;
差示扫描量热分析仪:Q2000型,美国TA公司;
高效液相色谱仪:Agilent 1100型,美国安捷伦公司;
迷你型垂直电泳槽: DYCZ-24D型,北京市六一仪器厂;
稳压稳流电泳仪:YY-5型,北京市六一仪器厂。
1.3 方法
1.3.1 米谷蛋白的制备 参照文献[10]。具体如下:
(1) 脱脂:籼米粉碎,以1∶ 5 (g/mL)的料液比加入正己烷,室温下搅拌1 h后真空抽滤,滤液回收,滤饼留用,滤饼室温干燥24 h。
(2) 碱提:按料液比1∶10 (g/mL)加入0.05 mol/L的NaOH,恒速恒温搅拌2 h,3 500 r/min 离心20 min,取上清液。
(3) 酸沉:上清液恒速搅拌,用0.1 mol/L的盐酸溶液调pH到蛋白质等电点(pH 4.8),将前一步的悬浊液如上述参数离心,取沉淀中加入少量去离子水,调节pH到7.0,留用。
(4) 盐提:按料液比1∶10 (g/mL)加入5%氯化钠溶液,搅拌1 h,离心取沉淀。
(5) 醇提:按料液比1∶5 (g/mL)加入75%乙醇搅拌1 h,离心取沉淀。
(6) 沉淀水洗3次,料液比均为1∶15 (g/mL),搅拌20 min,离心(3 500 r/min, 20 min)取沉淀,冷冻干燥,干粉保存备用。
1.3.2 米谷蛋白的常规成分检测
(1) 水分含量测定:按GB 5009.3—2010《食品中水分的测定》的直接干燥法执行。
(2) 蛋白含量测定:按GB 5009.5—2010《食品中蛋白质的测定》的凯氏定氮法执行。
1.3.3 不同pH值蛋白溶液的配制 取0.1 g米谷蛋白样品,溶于20 mL的蒸馏水中,采用 0.1 mol/L的盐酸分别调节溶液pH至3.0,4.0,7.0,搅拌8~10 h,4 500 r/min离心30 min,取上清液备用。
1.3.4 米谷蛋白溶解度的测定 取不同pH值蛋白上清液0.5 mL于试管中,加入Folin-酚试剂,500 nm波长处测定其吸光度值,对照标准曲线得出样品中的蛋白质浓度并计算溶解度[11]。
1.3.5 米谷蛋白的高效液相色谱检测 用1 g/100 mL SDS水溶液分别配制pH 3.0,4.0,7.0,浓度为5 mg/mL的米谷蛋白溶液,经0.45 μm微孔滤膜过滤后使用高效液相系统与色谱柱(7.8 mm × 300 mm)进行测定。流动相为相应pH值的1 g/100 mL SDS水溶液,洗脱速率1 mL/min,检测波长220 nm,柱温为25 ℃。
1.3.6 米谷蛋白十二烷基硫酸钠—聚丙烯酰胺凝胶(SDS-PAGE)电泳 不同pH值蛋白溶液采用SDS-PAGE电泳[12]观察其亚基分布,其中:分离胶浓度12%,浓缩胶浓度5%,上样量为10 μL,考马斯亮蓝R-250 染色。
1.3.7 米谷蛋白游离巯基的测定 不同pH值蛋白溶液于常温搅拌8~10 h,4 500 r/min 离心20 min,取上清液测定蛋白质溶解度。取空白管、对照管、测定管分别加入0.1 mL样品于对照管和测定管中,再加入0.1 mL总巯基试剂一于3管中,加入1.1 mL试剂二于空白管,1.0 mL分别于对照管和测定管中,将0.5 mL试剂三分别加入空白管和测定管中,同时加0.5 mL蒸馏水于对照管中,混合均匀于37 ℃水浴15 min。加入0.05 mL试剂四于3管中,室温静置30 min直至显色,412 nm,0.5 cm光径,双蒸水调零,测定各管OD值[13]。
(1)
式中:
SH——游离硫基含量,mmol/g;
A1——测定管吸光度;
A0——空白管吸光度;
A2——对照管吸光度;
V1——反应总体积,mL;
V2——取样量,mL;
cd——蛋白质含量,g/mL。
1.3.8 米谷蛋白的透射电镜检测 取0.2 g米谷蛋白样品,溶于20 mL的蒸馏水中,滴加盐酸分别调节pH值至3.0,4.0,7.0,搅拌过夜,离心取上清液。取 20~30 μL上清液滴加于载样铜网上,静置1 min用滤纸从侧面吸干液体,滴加0.5% 30 μL 醋酸铅溶液于铜网上,室温负染10 min,吸干液体,烤干后在透射电镜下观察照相[14]。
1.3.9 米谷蛋白热力学性质的测定 米谷蛋白溶于水,经调整pH值后冷冻干燥,测定不同pH条件下后米谷蛋白的热力学性质。空坩埚作为空白,称取待测样品(2.5±0.2) mg置于坩埚中进行检测。扫描速度:5 ℃/min,扫描范围:20~160 ℃,平行测定3次。
2 结果与分析
2.1 米谷蛋白常规成分含量
结果显示碱法提取米谷蛋白的蛋白质提取率为(56.40±2.20)%,水分含量(4.29±0.22)%,蛋白质含量(90.81±0.13)%(干基)。
2.2 米谷蛋白的溶解度
由图1可知,pH 7.0时米谷蛋白的溶解度仅(6.24±1.25)%,在pH 5.0(接近米谷蛋白等电点)时溶解度最低,仅有2.01%;而在酸性条件下,溶解度显著增加,pH 3.0 时其溶解度最高,达到(72.47±2.36)%。随着pH值降低,米谷蛋白的溶解度明显提高,主要是由于pH值低于等电点时蛋白质带正电荷相互排斥,增加了其水溶性。但是,pH 2.0时米谷蛋白的溶解度小于pH 3.0的,在pH 2.0这种强酸条件下,大米蛋白分子严重变性以致相互交联,其水溶液变的黏稠,使溶解度降低。后续研究中,选择了pH 3.0,4.0,7.0 3种pH条件对米谷蛋白的性质进行研究。
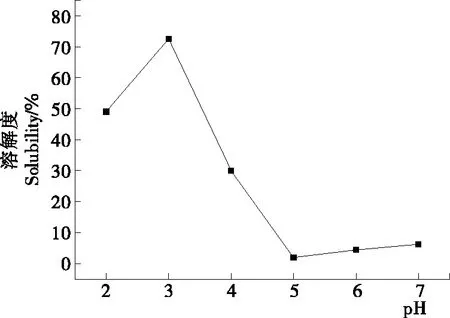
图1 米谷蛋白在不同pH下的溶解度Figure 1 Solubility of rice glutelin at different pH values
2.3 米谷蛋白的高效液相检测
图2表征了pH 3.0,4.0, 7.0时米谷蛋白的分子量变化,三者的洗脱出峰时间有较大不同。由图2可知,3种样品均在约5.6 min出现一个小峰,但pH 3.0条件下主要的出峰时间为10.707,11.123,11.773 min,3个峰的分离效果不明显;pH 4.0条件下主要的出峰时间为10.305,10.889,11.627 min;中性条件下主要的出峰时间为9.476,10.052,10.851 min,前2个峰的分离效果不是很明显。pH 7.0时的响应值低于pH 3.0和pH 4.0,这是由于pH 7.0时的溶解度很低,SDS的溶解度很低,导致其响应值很低。根据凝胶色谱按分子量从大到小出峰的规律,结果表明pH 3.0时米谷蛋白主要峰的洗脱时间大于pH 7.0时的,出峰时间延长了约1~2 min,这是因为酸性环境使蛋白大分子团体解聚分散成小分子,较晚洗脱出来。
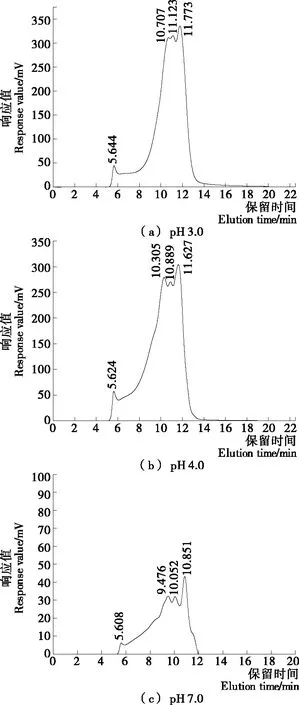
图2 米谷蛋白在不同pH下的高效液相色谱图Figure 2 High-performance liquid chromatograms of rice glutelin at different pH values
2.4 米谷蛋白的SDS-PAGE电泳
如图3与表1所示,pH 3.0与pH 4.0时,米谷蛋白的亚基组成及多肽差异不大,而pH 7.0时米谷蛋白亚基组成与之相比有明显差异。在pH 3.0条件下电泳图谱显示5个条带,亚基相对分子质量分别为62,51,33,19,18 kDa;在pH 4.0 的条件下电泳图谱显示有5个条带,其亚基分子量分别为63,52,33,19,18 kDa;在中性条件下电泳图谱显示有8个条带,其亚基分子量分别为123,93,63,51,33,21,19,18 kDa。对比酸性条件和中性条件下的样品电泳图,123,93 kDa 亚基消失,说明酸性环境会改变米谷蛋白的分子结构从而影响其亚基分布。
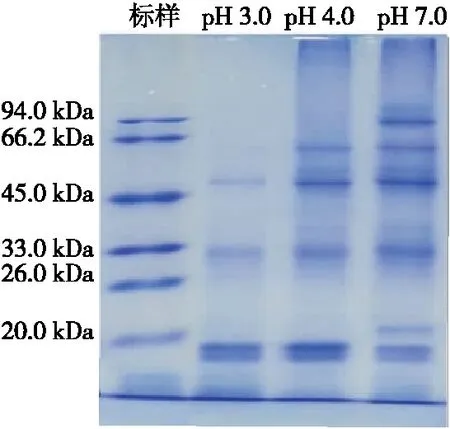
图3 不同pH条件下米谷蛋白的SDS-PAGE电泳图Figure 3 SDS-PAGE electrophoresis of rice glutelin at different pH values
表1不同pH条件下米谷蛋白电泳图的光密度值
Table 1 Optical density values of rice glutelin electrophoresis patterns at different pH values
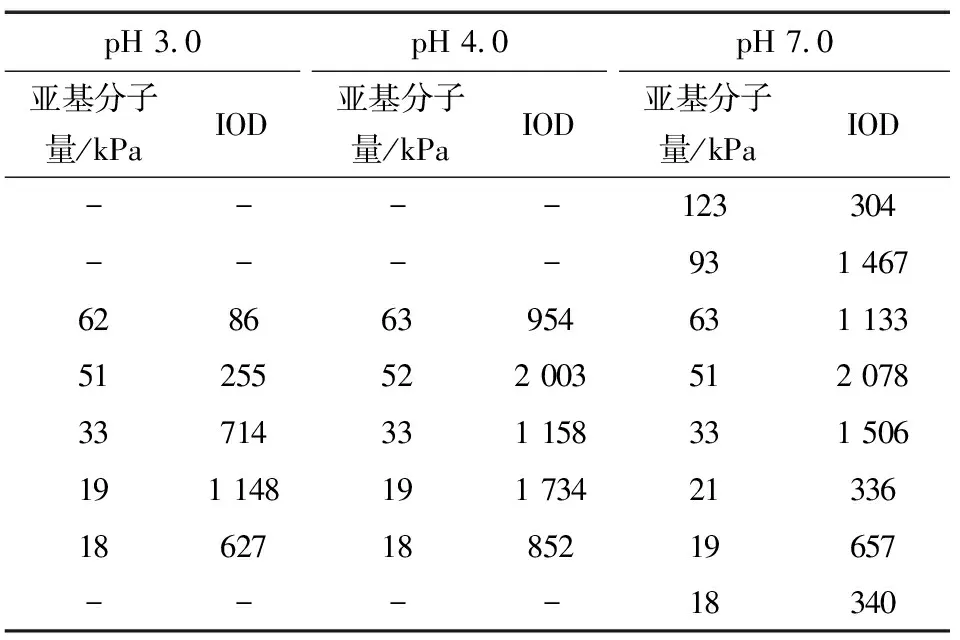
pH 3.0亚基分子量/kPaIODpH 4.0亚基分子量/kPaIODpH 7.0亚基分子量/kPaIOD----123304----931 467628663954631 13351255522 003512 07833714331 158331 506191 148191 73421336186271885219657----18340
pH 3.0与pH 4.0相比,亚基组成虽然大致相同,但每个条带的光密度值有较大差距。从光度值分布可以看出,pH 3.0 时19 kDa的条带比大分子量的条带含量更高,pH 4.0 时52 kDa的条带含量更高,pH 7.0时酸性条件下没有观察到的123,93 kDa的条带含量较高,因此,电泳图光密度值的结果进一步证明酸性条件下米谷蛋白中较大的分子逐渐解离,pH 3.0时体系中存在更多的较小分子量的分子。
2.5 pH值对米谷蛋白游离巯基含量的影响
由表2可知,随着 pH 的增大,米谷蛋白游离巯基含量逐渐减少。原因可能是蛋白质在酸性条件下二硫键断裂内部结构展开[15],使其内部的巯基暴露出来,或是蛋白质的亚基发生解离,使表面疏水性增大[16]。
2.6 pH值对米谷蛋白透射电镜检测结果的影响
如图4(a)所示,中性条件下的米谷蛋白分子较为密集,凝集成团,而在酸性条件下,米谷蛋白分子较为松散。图4(b)、(c)中,米谷蛋白分子之间空隙较大,相比中性条件下较为分散无巨大团聚现象,且pH 3.0下的米谷蛋白分子比pH 4.0下的更为分散。
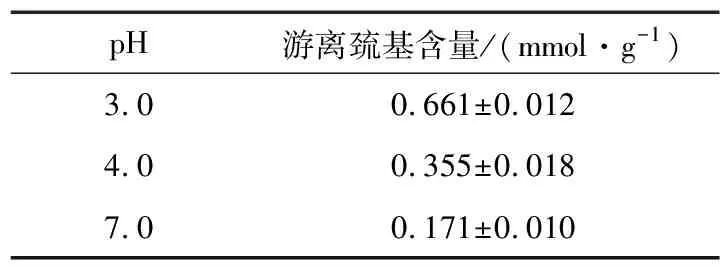
表2 不同pH条件下米谷蛋白游离巯基的含量Table 2 Free thiol content of in rice glutelin under different pH values
2.7 pH值对米谷蛋白热力学性质的影响
DSC测量蛋白质体系在程序控温过程中发生的热量变化,可得到与蛋白质热变性有关的一些信息,从而得到蛋白分子的热稳定性特征[17]。由表3可得,3种pH环境下的米谷蛋白的变性峰值温度相差不大,但其变性热焓的差别较为明显。焓值代表键断裂累积在一起的吸热量,同时也反映了蛋白质样品的结构有序程度[18]。样品在pH 3.0时焓值最低,可能与其分子在低酸性环境下较为分散有关,而在pH 4.0 时样品焓值最高,此时pH值较为接近等电点,蛋白质分子有序程度高,因此焓值最高。pH 3.0,4.0,7.0下,米谷蛋白的热变性温度依次升高,表明在酸性环境中,米谷蛋白的分子结构发生变化,中性条件下的米谷蛋白分子稳定。

图4 不同pH条件下米谷蛋白的透射电镜图像Figure 4 Transmission electron microscopy of rice glutelin at different pH values

表3 不同pH条件下米谷蛋白的热力学性质Table 3 Thermodynamic properties of rice glutelin at different pH values
3 结论
试验结果显示,在酸性条件下米谷蛋白的溶解性比中性条件下好,可能是在强酸或碱性条件下,米谷蛋白质与淀粉等物质结合的粒子被分解,其紧密的结构变得疏松,同时破坏了蛋白质分子的次级键,促进了蛋白质与结合物的分离,从而增加了米谷蛋白的溶解性。随着米谷蛋白pH值下降,其分子结构、亚基组成都发生了变化,同时米谷蛋白游离巯基含量增加,热变性温度下降,可能是米谷蛋白质分子在酸性条件下内部结构展开,分子键断裂等,使结构变得松散,从而引起蛋白质溶解度增加。
近年来,带相反电荷的蛋白质和多糖复合凝聚实现组装,形成具有特定结构和功能的复合凝聚产物[19],其通常具有优于蛋白质或多糖本身的功能性质[19-21]。因此利用本研究中酸性条件分散的大米蛋白与带相反电荷的多糖混合,控制两种生物大分子的相互作用从而设计和构建结构可控及功能独特的组装体系,对获得改善功能性质的产物、设计新型大米蛋白食品及拓宽低值原材料中提取的大米蛋白的应用范围均具有重要意义。下一步试验将针对酸性条件下大米蛋白和多糖的复合凝聚进行深入探索。
