藻-菌系统中微藻生长条件的响应面法优化
2019-03-30罗龙皂曾凡健田光明
罗龙皂,曾凡健,田光明*
(1.上饶师范学院化学与环境科学学院,江西 上饶 334001;2.浙江大学环境与资源学院,杭州 310058)
微藻具有不与农作物争地、生长周期短和油脂含量高等特点,可作为生产生物质能的理想原材料[1]。然而,微藻生长需要吸收大量的养分,这使得其培养成本较高。因此,很多学者尝试采用各种废水来培养微藻,既收获了微藻,又使水质得到了净化[2-6]。与其他处理技术相比,基于微藻培养的废水处理技术具有独特的优势,如无需添加化学物质,具有自产氧及二氧化碳减排能力,生产高附加值生物质产品等[7]。
近年来,很多学者发现将微藻和好氧细菌共同培养用于废水处理较微藻单独培养更有优势。这是由于好氧细菌的存在会消耗微藻光合作用产生的氧气,消除因溶解氧过高对微藻生长的抑制,同时将废水中有机物分解成二氧化碳,为微藻光合作用提供碳源[8]。好氧细菌和微藻的协同作用不仅可以提高微藻生物量产率,还能省去曝气操作。而对于一般的生物处理而言,曝气所需的成本占到了整个处理的50%[9]。因此,利用藻-菌系统来处理废水能大大降低运行成本,且在微藻培养方面具有很大的优势。目前,有关藻-菌互作方面的研究主要集中在探明基于微藻的废水处理系统中存在的优势微生物,以及废水中主要成分被吸收或分解的基本机制方面[10-12],而对影响藻-菌系统中微藻生长的相关因素研究较少,尤其是它们对微生物的分解过程和微藻的光合作用,以及对废水中氮磷的迁移转化产生的影响尚不明确。
本文以对养猪废水净化潜力大的近具刺链带藻(Desmodesmussp.CHXl)为研究对象,向其中加入对有机物降解效果好的商业化菌剂,人工构建藻-菌共培养系统,探讨该培养系统的密闭情况及搅拌速率、藻-菌初始接种比例和废水有机负荷对藻-菌系统中微藻生长的影响,并对相关因素进行优化,为实现藻-菌系统对废水的资源化利用提供依据。
1 材料与方法
1.1 藻种及菌种
本文所用的微藻为近具刺链带藻(Desmodesmussp.CHXl),由本课题组从养猪废水中分离获得[13]。将微藻在蓝绿藻培养基(medium for blue green algae,BG11)中培养至对数期,经孔径为1 μm的醋酸纤维滤膜(上海新亚净化材料有限公司)过滤后,用超纯水洗净并再次过滤,备用。
所用的菌剂为对废水中有机物降解效果好的商业化复合菌剂(购自上海普罗生物技术有限公司)。菌剂中优势菌属为蓝细菌(Cyanobacteria)、节杆菌(Arthrobacter)、芽 孢 杆 菌(Bacillus)和 根 瘤 菌(Rhizobium)等。
1.2 废水
所用废水为模拟沼液,在BG11培养基的基础上改进配制而成。其中有机物、氨氮和总磷主要由无水乙酸钠、硫酸铵、磷酸二氢钾配制而成。模拟废水的基本理化性质为:化学需氧量(chemical oxygen demand,COD)1 000.01 mg/L、氨氮200.58 mg/L、总氮370.13 mg/L、总磷50.02 mg/L、pH 7.23。
1.3 试验设计
1.3.1 单因素试验
1)培养系统密闭情况。将藻-菌培养系统设置为闭合和敞开2种形式,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水(COD为1 000mg/L)的1 000 mL锥形瓶中,置于光照培养箱中进行培养。其中藻体质量浓度为0.1 g/L,菌剂质量浓度为10 g/L。敞开系统的锥形瓶口呈敞开状态,闭合系统的锥形瓶口用软胶塞密封。每个锥形瓶底部有磁力搅拌器,用于混匀藻液。培养条件为温度30℃、光照强度100 μmol/(m2·s)、24 h全光照、搅拌速率1 000 r/min。
2)藻-菌接种比例对微藻生长的影响。设置4个不同的藻-菌比例处理,其中藻体质量浓度为0.1g/L(按干质量计),菌剂质量浓度分别为0.1、5、10、20 g/L,对应的细菌-微藻比例分别为1∶1、50∶1、100∶1、200∶1,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水(COD为1 000 mg/L)的1 000 mL锥形瓶中(瓶口敞开),置于光照培养箱中进行培养。培养条件为温度30℃、光照强度100 μmol/(m2·s)、24 h全光照、搅拌速率1 000 r/min。
3)培养系统搅拌速率对微藻生长的影响。磁力搅拌器的搅拌速率分别设置为0、1 000、1 500、2 000、2 500 r/min,共5个处理,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水(COD为1 000 mg/L)的1 000 mL锥形瓶中(瓶口敞开),置于光照培养箱中进行培养。其中藻体质量浓度为0.1 g/L,菌剂质量浓度均为10 g/L。培养条件为温度30℃、光照强度100 μmol/(m2·s)、24 h全光照。
4)废水有机负荷对微藻生长的影响。设置废水COD分别为1 000、2 000、4 000、6 000、8 000 mg/L,共5个梯度,每个处理设3个重复。将微藻和菌剂接种至装有800 mL废水的1 000 mL锥形瓶中(瓶口敞开),置于光照培养箱中进行培养。其中藻体质量浓度为0.1 g/L,菌剂质量浓度均为10 g/L。培养条件为温度30℃、光照强度100 μmol/(m2·s)、24 h全光照、搅拌速率1 000 r/min。
1.3.2 响应面优化试验
在单因素试验的基础上,选取藻-菌接种比例、搅拌速率及有机负荷为主要影响因素,以微藻生物量为响应值,考察各因素间的交互作用对微藻生物量的影响。采用Design-Expert 7.5软件进行分析,选择三因素三水平的Box-Behnken设计,并对结果进行统计分析。试验设计因素与水平如表1所示。将微藻和菌剂接种至装有800 mL废水的1 000 mL锥形瓶中(瓶口敞开),置于光照培养箱中进行培养。培养条件为温度30℃、光照强度100 μmol/(m2·s)、24 h全光照。
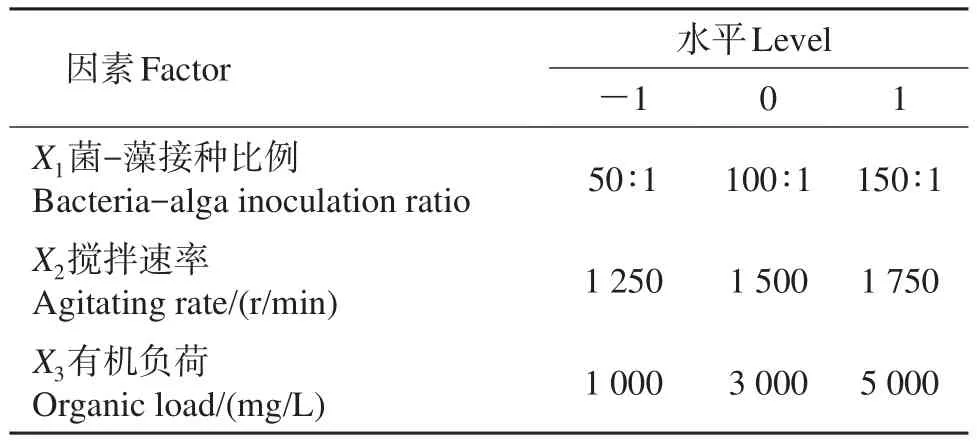
表1 Box-Behnken试验设计因素与水平Table 1 Factors and levels used in Box-Behnken design
1.4 微藻生物量测定
通过测定近具刺链带藻细胞数来确定其生物量。藻细胞数采用血球计数板和显微镜测定[14]。微藻生物量(干质量,g/L)和微藻细胞数之间的拟合关系为:微藻生物量=1.19×10-7×细胞数(R2=0.992 3)。
1.5 数据处理与统计分析
利用Excel 2013对数据进行处理,各组实验数据的显著性差异分析利用SPSS 20.0软件进行,其中开放及封闭系统的差异采用配对样本T检验进行分析,其余因素采用单因素方差分析(analysis of variance,ANOVA),显著水平为0.05。响应面优化试验数据分析采用Design-Expert 7.5软件进行。
2 结果与讨论
2.1 藻-菌系统中微藻生长的影响因素分析
2.1.1 培养系统密闭情况对微藻生长的影响
图1为在开放和闭合2种培养方式下藻-菌系统中微藻的生长情况。结果表明,微藻在开放系统中的生长情况优于闭合系统(P<0.05)。培养7 d后,开放系统中微藻生物量达到4.5 g/L,而闭合系统中为4.3 g/L。造成开放系统中微藻生物量更高的原因可能是:一方面,开放系统中由于培养液和空气有大面积的接触,出现高溶解氧抑制微藻生长的可能性较小[15];另一方面,在开放系统中当氧气或二氧化碳不足时,可从空气中获取,以维持细菌或微藻的生长,而在闭合系统中当氧气或二氧化碳不足时会影响细菌或微藻的生长。开放式反应器的主要代表是跑道式幅板混合藻类塘,现阶段98%的商业化微藻养殖采用此种反应器[16]。而密闭式光生物反应器由于高昂的设备及运营成本未能得到广泛的应用[17]。
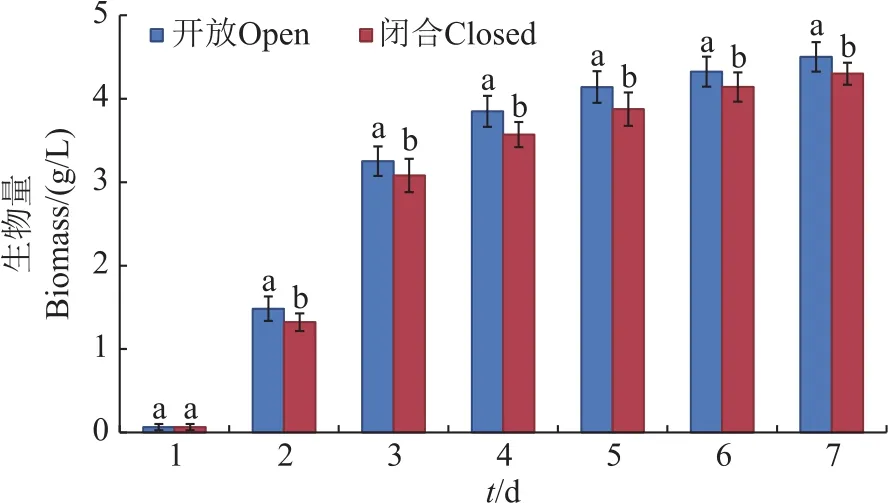
图1 微藻在闭合和开放的藻-菌培养系统中的生长情况Fig.1 Microalgal growth situation in the open and closed algal-bacterial culture systems
2.1.2 藻-菌接种比例对微藻生长的影响
微藻和微生物之间的初始接种比例被认为是影响微藻生长的重要条件之一[15]。本研究设置了1∶1、50∶1、100∶1、200∶1共4种细菌-微藻初始接种比例(细胞数之比)来探讨它们对藻-菌系统中微藻生长的影响。结果表明,微藻生物量随菌-藻接种比例的增大而增加,当菌-藻接种比例为100∶1时系统中微藻生物量最大,随后微藻生物量随菌-藻比例增大而降低(图2)。可见,提高菌-藻初始接种数量有助于微藻生长,但并非越高越好,在本研究中将菌-藻接种比例控制在100∶1更利于微藻生长。当菌-藻接种比例在适合的范围内时,废水中有充足的氧气供好氧细菌分解有机物用,同时,也会产生足够的无机碳源用于微藻光合作用,使微藻生长处于较优水平。以上结果说明菌-藻初始接种比例对微藻生长有着重要影响,而这种影响又因菌-藻种类而异。例如,在小球藻(Chlorellasp.)和酿酒酵母(Saccharomyces cerevisiae)构成的藻-菌体系中,对微藻生长促进效果最好的菌-藻比例为1∶2[18],而在栅藻和敏捷食酸菌(Acidovorax facilis)共生系统中,有利于微藻生长的最佳菌-藻比例为1∶3[15]。
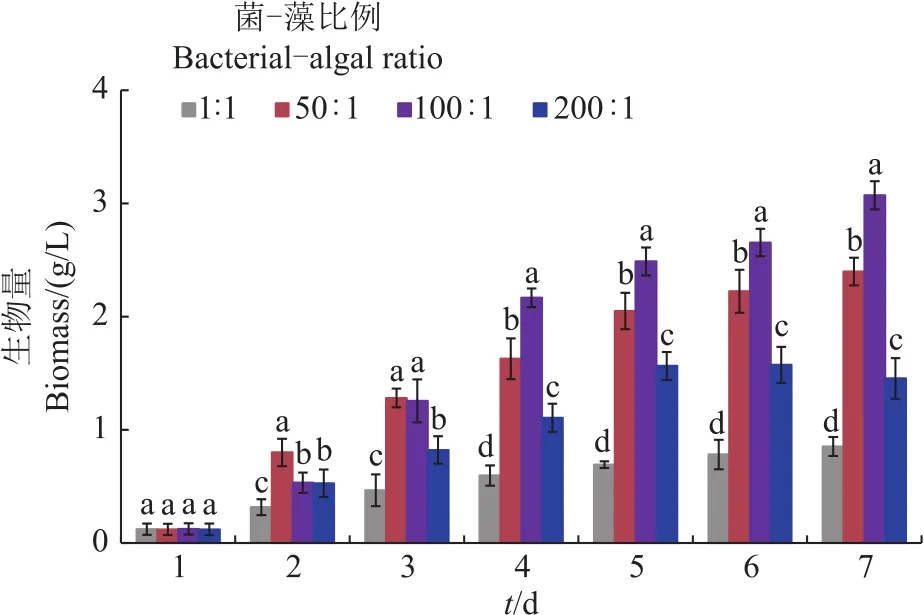
图2 在藻-菌培养系统中微藻在不同细菌-微藻接种比例条件下的生长情况Fig.2 Microalgal growth situation under different bacteriamicroalgae inoculation ratios in the algal-bacterial culture system
2.1.3 培养系统搅拌速率对微藻生长的影响
为了提高光能利用率、促进气体交换和提高营养有效性,需要对藻-菌系统进行搅动混合并使其维持在悬浮状态。但是搅拌会引起湍流和剪切效应,从而影响微藻的生长[19-20]。本研究设置搅拌速率为0、1 000、1 500、2 000、2 500 r/min 5个处理来探讨搅拌速率对微藻生长的影响。结果表明,在0~1 500 r/min搅拌速率下,微藻生物量随搅拌速率的增加而增加,当搅拌速率为1 500 r/min时微藻生物量最大,随后微藻生物量随搅拌速率的增加而下降(图3)。当搅拌速率低于1 500 r/min时,提高搅拌速率会增加细胞的养分供应并促进系统中氧和二氧化碳的交换速率,从而提高微藻的生物量,然而进一步提高搅拌速率会增加剪切力并损伤细胞,从而使产量迅速降低[21-22]。微藻对剪切力的敏感度与其是否生有鞭毛相关,因为剪切力会引起鞭毛损伤,从而导致微藻生长速率降低[23]。

图3 在藻-菌培养系统中搅拌速率对微藻生长的影响Fig.3 Effects of agitating rate on microalgal growth in the algal-bacterial culture system
2.1.4 废水有机负荷对微藻生长的影响
有机物对微藻生长的影响在很大程度上表现为浓度相关性,当有机物浓度较低时能促进微藻生长,而高浓度有机物则会抑制微藻生长[24]。本研究探讨了废水有机物质量浓度(以COD计)在1 000、2 000、4 000、6 000、8 000 mg/L 5个梯度下微藻的生长情况。结果表明,当废水初始COD低于2 000 mg/L时,微藻随COD升高而增加,当废水初始COD高于2 000 mg/L时,微藻生物量则随COD升高而减少(图4)。说明较低浓度的有机物能促进微藻生长。首先,藻类能直接利用有机物作为生长的营养源,如磷胺在较低浓度时可作为碳源和磷源促进颤藻的生长[25];其次,较低浓度有机物能促进藻细胞DNA、RNA和蛋白质的合成[26]和引起藻细胞脂质过氧化程度升高,从而刺激藻细胞生长[27];此外,较低浓度有机物有利于细菌将其降解为二氧化碳,为微藻生长提供碳源。
2.2 藻-菌系统中微藻生长条件优化
以单因素试验结果为基础,设定藻-菌接种比例、搅拌速率和有机负荷为优化参数,以微藻生物量为响应值,建立响应面模型。由表2可知,第11、13、14、15、16号为区域中心试验点,其余12组为析因试验点,取值在每个因素组成的顶点上。零点试验进行5次重复,用以估计试验误差。
利用Design-Expert 7.5软件对所得数据进行整理分析,得到的微藻生物量二次回归方程为:

图4 废水有机负荷对藻-菌培养系统中微藻生长的影响Fig.4 Effects of organic load on microalgal growth in the algal-bacterial culture system
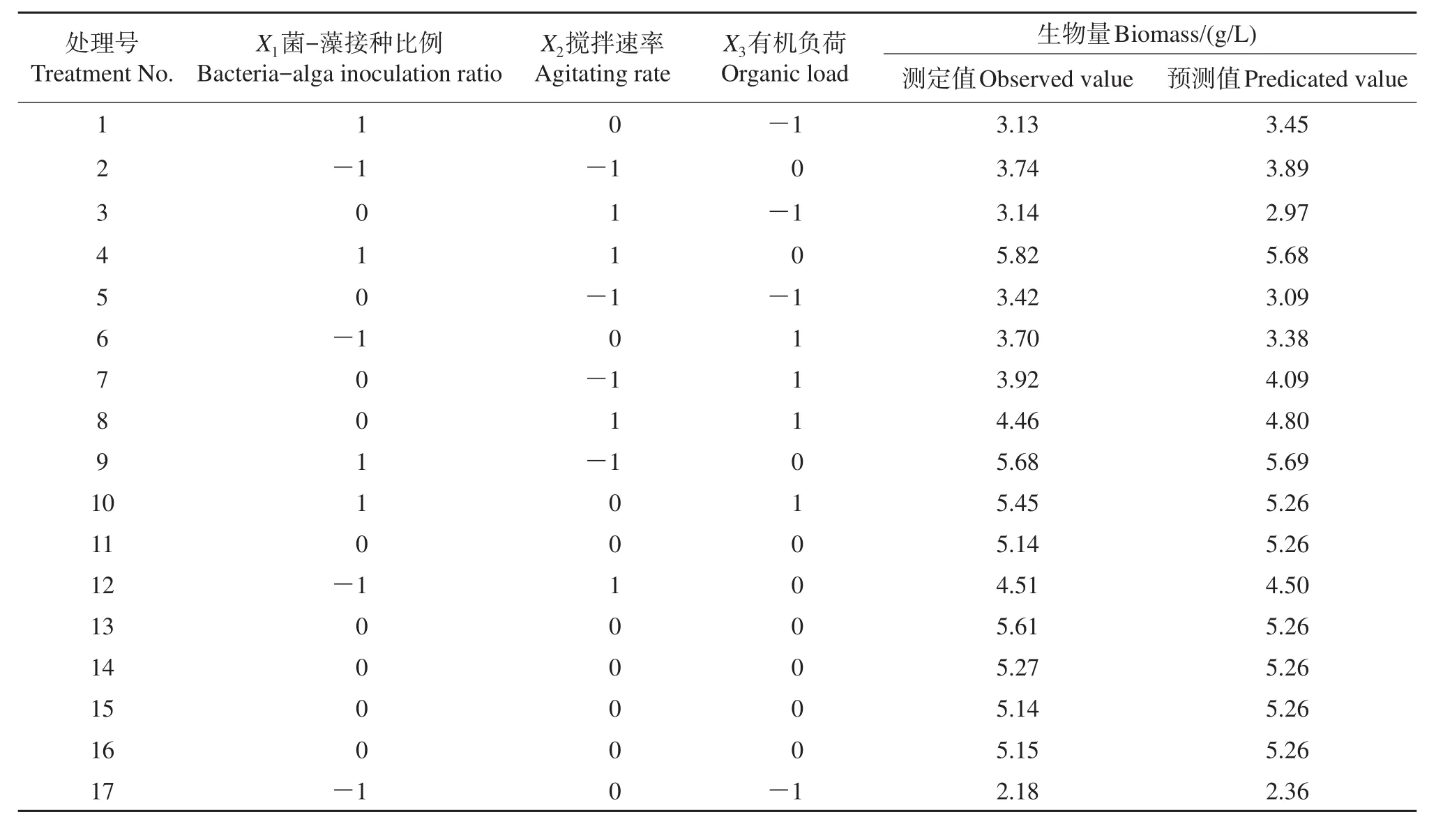
表2 Box-Behnken试验设计与结果Table 2 Experimental design and results for Box-Behnken

根据表2结果,用Design-Expert 7.5软件进行多元回归分析,回归方程的方差分析结果见表3。该二次多项式回归模型F值为18.34,P值小于0.01,表明模型极显著。失拟项F值为4.89,P值为0.079 6,不显著。模型的调整确定系数R2Adj值为0.907 0,说明该模型的拟合度良好,试验误差小,可以用该模型对微藻的生物量进行分析与预测。X1、X3、X32对二次响应面模型效果的影响达到极显著水平,其余项的的影响则不显著,说明藻-菌接种比例和有机负荷对微藻的生长影响显著。
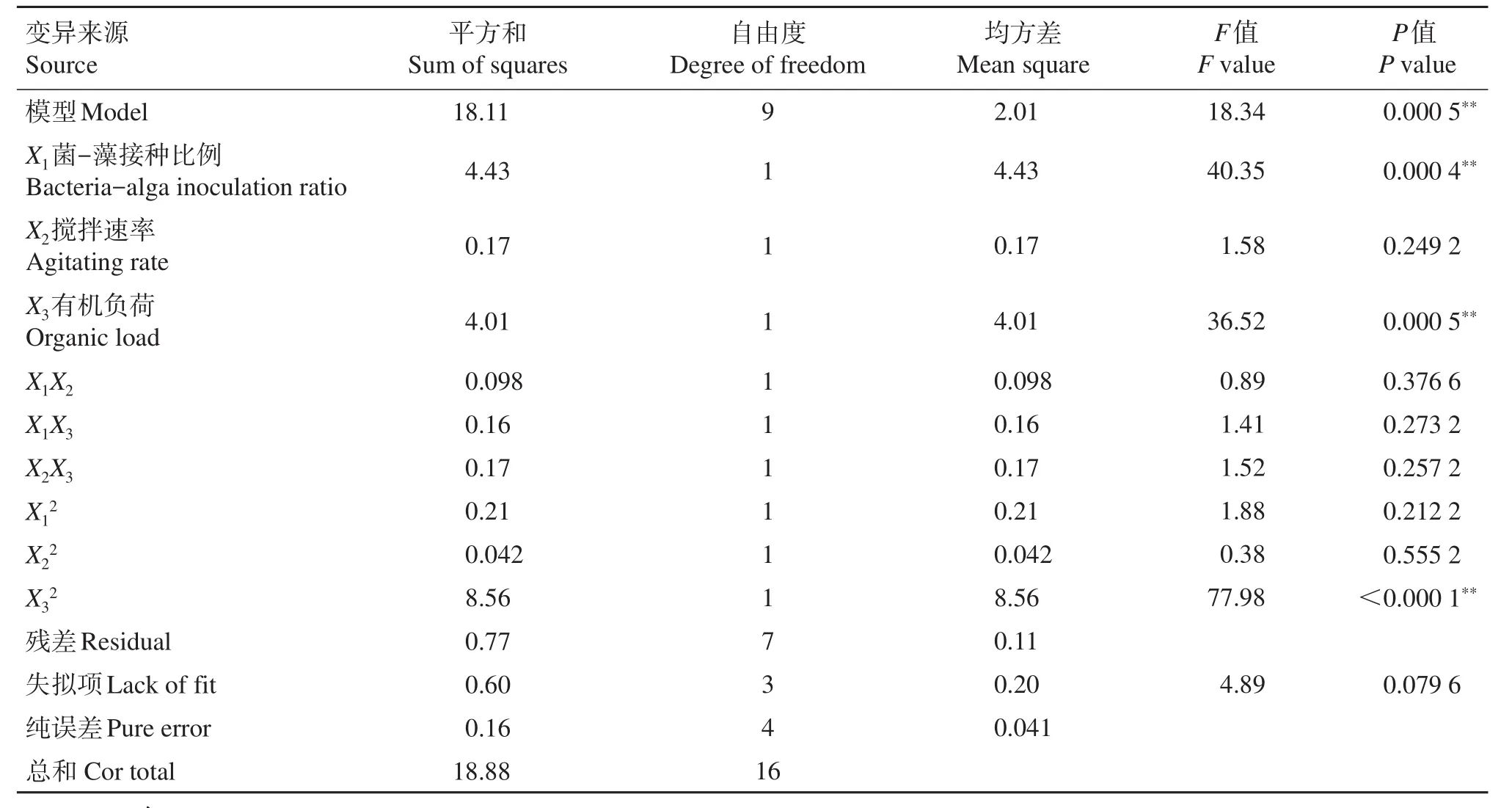
表3 微藻生物量回归模型的方差分析Table 3 Analysis of variance of the regression model for microalgal biomass
为确定响应面最佳培养条件,运用响应面寻优方法对回归方程进行最优解分析,得到最佳培养条件为菌-藻接种比例150∶1、搅拌速率1 574.29 r/min和有机负荷(以COD计)3 676.02 mg/L。为检验结果的可靠性,采用优化后的培养条件进行3次平行验证试验。结果显示,培养7 d后,微藻的生物量为(5.68±0.32)g/L,与响应面模型得到的理论预测值(5.69 g/L)基本吻合。
3 结论
通过单因素试验和响应面试验对藻-菌系统中微藻生长条件进行优化,确定了最佳培养条件为菌-藻接种比例150∶1、搅拌速率1 574.29 r/min和有机负荷(以COD计)3 676.02 mg/L。在该优化条件下对微藻进行培养,7 d后微藻的生物量达到5.68 g/L,与理论预测值基本吻合。本研究结果可为提高藻-菌系统对废水的资源化利用效率提供科学依据。
参考文献(References):
[1]PRAGYA N,PANDEY K K,SAHOO P K.A review on harvesting, oil extraction and biofuels production technologies from microalgae.Renewable&Sustainable Energy Reviews,2013,24(10):159-171.
[2]赵立欣,宋成军,董保成,等.基于微藻养殖的沼液资源化利用与高价值生物质生产耦合技术研究.安全与环境学报,2012,12(3):61-65.ZHAO L X,SONG C J,DONG B C,et al.On the microalgae cultivation based coupling of biogas fermentative liquid-resource utilization and high-quality biomass production.Journal of Safety and Environment,2012,12(3):61-65.(in Chinese with English abstract)
[3]李超,冯玉杰,张大伟,等.以市政污水为底物的微藻油脂积累和碳流分析.可再生能源,2012,30(6):93-96.LI C,FENG Y J,ZHANG D W,et al.Microalgae lipid accumulation and carbon flux analysis based on municipal wastewater used as medium.Renewable Energy Resources,2012,30(6):93-96.(in Chinese with English abstract)
[4]程海翔.一株栅藻的分离培养及其应用于养猪废水处理的潜力研究.杭州:浙江大学,2013.CHENG H X.Research on isolation and cultivation of a new microalgae and the potential of its application for treating piggery wastewater.Hangzhou:Zhejiang University,2013.(in Chinese with English abstract)
[5]PRANDINI J M,DA S M,MEZZARI M P,et al.Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgaeScenedesmusspp.Bioresource Technology,2015,202:67-75.
[6]WANG Y,GUO W Q,YEN H W,et al.Cultivation ofChlorella vulgarisJSC-6 with swine wastewater for simultaneous nutrient/COD removal and carbohydrate production.Bioresource Technology,2015,198:619-625.
[7]WANG J H,ZHANG T Y,DAO G H,et al.Microalgaebased advanced municipal wastewater treatment for reuse in water bodies.Applied Microbiology and Biotechnology,2017,101(7):1-17.
[8]RIEDEL T E,BERELSON W M,NEALSON K H,et al.Oxygen consumption rates of bacteria under nutrient-limited conditions.Applied and Environmental Microbiology,2013,79(16):4921-4931.
[9]GUO Z,TONG W Y.The interactions betweenChlorella vulgarisand algal symbiotic bacteria under photoautotrophic and photoheterotrophic conditions.JournalofApplied Phycology,2014,26(3):1483-1492.
[10]RAMANAN R,KIM B H,CHO D H,et al.Algae-bacteria interactions:evolution,ecology and emerging applications.Biotechnology Advances,2016,34(1):14-29.
[11]SUBASHCHANDRABOSE S R,RAMAKRISHNAN B,MEGHARAJ M,et al.Consortia of cyanobacteria/microalgae and bacteria:biotechnologicalpotential.Biotechnology Advances,2011,29(6):896.
[12]RISGAARDPETERSEN N, NICOLAISEN M H,REVSBECH N P,et al.Competition between ammoniaoxidizing bacteria and benthic microalgae.Applied and Environmental Microbiology,2004,70(9):5528-5537.
[13]CHENG H X,TIAN G M.Identification of a newly isolated microalga from a local pond and evaluation of its growth and nutrients removal potential in swine breeding effluent.Desalination and Water Treatment,2013,51(13/14/15):2768-2775.
[14]WATANABE K,TAKIHANA N,AOYAGI H,et al.Symbiotic association inChlorellaculture.FEMS Microbiology Ecology,2005,51(2):187-196.
[15]王瑞民.栅藻(Scenedesmus obliquus)藻菌共生体系的构建及调控.北京:中国科学院大学,2015.WANG R M.Construction and regulation of artificial consortia ofScenedesmus obliauusand microorganism.Beijing:University of Chinese Academy of Science,2015.(in Chinese with English abstract)
[16]郭艳梅.新型藻菌生物转盘反应器的研制.哈尔滨:哈尔滨工业大学,2010.GUO Y M.Development of novel algal-bacterial symbiotic rotating biological contactor.Harbin:Harbin Institute of Technology,2010.(in Chinese with English abstract)
[17]WATANABE Y.Designandexperimentalpracticeof photobioreactor incorporating microalgae for efficient photosynthetic CO2fixation performance.Studies in Surface Science and Catalysis,2004,153:445-452.
[18]SHU C H,TSAI C C,CHEN K Y,et al.Enhancing high quality oil accumulation and carbon dioxide fixation by a mixed culture ofChlorellasp.andSaccharomyces cerevisiae.Journal of the Taiwan Institute of Chemical Engineers,2013,44(6):936-942.
[19]CAMACHO F G,GÓMEZ A C,SOBCZUK T M,et al.Effects of mechanical and hydrodynamic stress in agitated,sparged cultures ofPorphyridiumcruentum.Process Biochemistry,2000,35(9):1045-1050.
[20]BERDALET E.Effectsofturbulenceonthemarine dinoflagellateGymnodinium nelsonii.Journal of Phycology,2004,28:267-272.
[21]SULLIVAN J M,SWIFT E,DONAGHAY P L,et al.Smallscale turbulence affects the division rate and morphology of two red-tide dinoflagellates.Harmful Algae,2003,2(3):183-199.
[22]HONDZO M,LYN D.Quantified small-scale turbulence inhibits the growth of a green alga.Freshwater Biology,1999,41(1):51-61.
[23]SULLIVAN J M,SWIFT E.Effects of small-scale turbulence on net growth rate and size of ten species of marine dinoflagellates.Journal of Phycology,2003,39(1):83-94.
[24]沈宏,周培疆.环境有机污染物对藻类生长作用的研究进展.水生生物学报,2002,26(5):529-535.SHEN H,ZHOU P J.Advance in the studies on effect of environmental organic pollutants on the algae growth.Acta Hydrobiologica Sinica,2002,26(5):529-535.(in Chinese with English abstract)
[25]PERONA E,MARCO E,ORÚS M I.Alteration of dinitrogen fixation and metabolism in cyanobacteriumAnabaenaPCC 7119 by phosph amidon.Environmental and Experimental Botany,1991,31(4):479-488.
[26]唐学玺,李永祺.对硫磷对三角褐指藻核酸和蛋白质合成动态的影响.生态学报,2000,20(4):598-600.TANG X X,LI Y Q.The effect of parathion on the synthesis of protein and nucleic acid inPhaeodactylum tricornutum.Acta Ecological Sinica,2000,20(4):598-600.(in Chinese with English abstract)
[27]谢荣,唐学玺,李永祺,等.丙溴磷影响海洋微藻生长机制的初步研究.环境科学学报,2000,20(4):473-477.XIE R,TANG X X,LI Y Q,et al.Preliminary study on mechanism of profenofos on marine microalgae proliferation.Acta Scientiae Circumstantiae,2000,20(4):473-477.(in Chinese with English abstract)
