运动通过Parkin抗凋亡通路 抑制AD小鼠海马细胞凋亡
2019-03-29毕超,吕康,何标
毕 超, 吕 康, 何 标
(安徽师范大学 体育学院,安徽 芜湖 241002)
细胞凋亡(Apoptosis)是指机体为维持内环境稳定、受凋亡基因调控的细胞有序死亡的现象,细胞凋亡受一系列凋亡相关基因的精确控制,如Caspase蛋白家族、Bcl-2蛋白家族、TNF蛋白家族、细胞色素C(Cytochrome C,cyt-c)等蛋白家族,调控细胞凋亡的基因相互作用形成细胞凋亡信号传导通路,主要有死亡受体介导的细胞凋亡、线粒体通路介导的细胞凋亡和内质网应激凋亡通路介导的细胞凋亡三条通路。细胞凋亡对维持机体正常发育和自身稳态具有重要意义。而细胞凋亡异常将导致肿瘤、帕金森综合征及阿尔茨海默病(Alzheimer’s disease,AD)在内的多种疾病的发生。
阿尔茨海默病(AD)是一种进行性神经系统疾病,多发于中老年人群,以记忆力减退和认知功能障碍为主要临床特征,以神经纤维缠结、老年斑和突触丢失为主要病理特征[1]。细胞凋亡导致AD海马神经元大量丢失,最终影响海马的学习记忆功能。积极的身体活动作为一种干预手段能够有效缓解AD的发生,有研究证实长期中等强度的跑台运动显著抑制NSE/APP转基因AD小鼠海马Caspase-3、Caspase-9和Bax等促细胞凋亡基因的表达,提高抑制细胞凋亡基因Bcl-2的表达水平,提高NSE/APP转基因小鼠神经细胞抗凋亡能力。但运动是如何调控细胞凋亡相关基因抑制转基因小鼠海马神经细胞的凋亡尚不清楚。而Parkin-NEMO-OPA1通路具有抑制细胞凋亡的能力,运动是否通过调控Parkin-NEMO-OPA1通路抑制海马神经细胞凋亡?受上述启示,本研究探讨运动调控Parkin-NEMO-OPA1信号通路对APP/PS1转基因小鼠海马神经细胞凋亡的影响及机制。
1 实验材料及方法
1.1动物及分组
选购3月龄雄性APP/PS1转基因小鼠12只(南京大学模式动物研究所),许可证号:SCXK(苏2015—0001)。将APP/PS1转基因小鼠随机分为转基因运动组(TE,N=6)和转基因对照组(TC,N=6),选取同系野生型小鼠作为正常对照组(C,N=6)。实验动物置于标准动物房分笼饲养。
1.2 运动干预方案
实验小鼠适应性喂养2周后,TE组小鼠进行1周的适应性跑台训练。适应性训练结束后对TE组小鼠进行运动干预。参照文献[2]中运动强度,以小鼠最大摄氧量45%-55%的强度对TE组小鼠进行10周的跑台运动,每周5次,每次训练持续时间为45min,运动结束后小鼠为7月龄。
1.3 取 材
TE组小鼠末次运动后,对所有实验小鼠禁食12小时,脱颈处死,分离海马,低温保存,待测。
1.4 实时荧光定量(RT-PCR)测试
采用RT-PCR检测方法对Parkin、NEMO、OPA1、Caspase-3、Caspase-6、Caspase-8、cyt-c mRNA的表达水平进行检测,用Trizol法提取小鼠海马内总的RNA,以20μL逆转录反应体系得到稳定的cDNA。实验操作步骤按照文献[3]进行。按要求设计合成引物(由上海生工生物有限公司合成),引物序列见表1。按照RT-PCR扩增循环参数,以20μL体系进行RT-PCR实验,记录Ct值。根据2-△△Ct法计算相对表达量。所用仪器为(Thermo Fisher Scientific,美国,型号A28132)。
1.5 数据统计
2 结 果
2.1 各组小鼠海马细胞凋亡基因表达水平
本文采用RT-PCR技术检测各组小鼠海马Caspase-3、Caspase-6、Caspase-8、cyt-c mRNA的表达情况,如表2所示:与C组相比较,TC组小鼠海马Caspase-3mRNA的表达水平升高,差异具有极显著性(p<0.01),与TC组相比较,TE组小鼠海马Caspase-3mRNA的表达水平下降,差异具有极显著性(p<0.01)。与C组相比较,TC组小鼠海马Caspase-6mRNA表达水平升高,差异具有显著性(p<0.05),与TC组相比较,TE组小鼠海马Caspase-6mRNA的表达水平下降,差异具有显著性(p<0.05)。与C组相比较,TC组小鼠海马Caspase-8mRNA的表达水平升高,差异具有极显著性(p<0.01),与TC组相比较,TE组小鼠海马Caspase-8mRNA的表达水平下降,差异具有显著性(p<0.05)。与C组相比较,TC组小鼠海马cyt-cmRNA表达水平升高,差异具有显著性(p<0.05),与TC组相比较,TE组小鼠海马cyt-cmRNA的表达水平下降,差异具有显著性(p<0.05)(如图1所示)。

表1 引物序列一览表Table 1 Primer sequence of gene

表2 各组小鼠Caspase-3,Caspase-6,Caspase-8,cyt-c相对于GAPDH的mRNA表达水平
与C组相比,*p<0.05,**p<0.01,与TC组相比,△p<0.05,△△p<0.01


2.2 各组小鼠海马Parkin抗凋亡通路基因表达水平
为研究运动对Parkin-NEMO-OPA1抗细胞凋亡通路的影响,运用RT-PCR技术检测了APP/PS1转基因小鼠海马Parkin、NEMO和OPA1mRNA的表达情况,如表3所示,与C组相比较,TC组小鼠海马Parkin mRNA的表达水平下降,差异具有显著性(p<0.05),与TC组相比较,TE组小鼠海马Parkin mRNA的表达水平升高,差异具有显著性(p<0.05)。与C组相比较,TC组小鼠海马OPA1mRNA的表达水平下降,差异具有显著性(p<0.05),与TC组相比较,TE组小鼠海马OPA1mRNA的表达水平升高,差异具有显著性(p<0.05)。与C组相比较,TC组小鼠海马NEMO mRNA表达水平升高,差异具有显著性(p<0.05),与TC组相比较,TE组小鼠海马NEMO mRNA的表达水平升高,差异具有显著性(p<0.05)(如图2所示)。

表3 各组小鼠Parkin,NEMO, OPA1相对于GAPDH的mRNA表达水平
与C组相比,*p<0.05,与TC组相比,△p<0.05
3 讨 论
细胞凋亡是真核细胞为维持内环境稳定而启动的内部死亡机制,凋亡信号传导通路精密调控机体的细胞凋亡,其中线粒体通路介导的细胞凋亡最为经典[4]。Caspase家族对细胞凋亡起着关键性作用,是调控细胞凋亡的关键酶,Caspase有多个亚型,其中Caspase-3、Caspase-6和Caspase-7是细胞凋亡的执行者,而Caspase-8和Caspase-9则是细胞凋亡的启动者。不同的细胞凋亡信号通路相互作用,激活Caspase-3和Caspase-6,诱发细胞凋亡[5]。神经元细胞过度凋亡进一步降低了神经元的存活,影响大脑功能,而AD脑内神经细胞大量丢失则是神经细胞过度凋亡的结果。AD的发病与Aβ诱导的神经细胞凋亡密切相关,淀粉样前体蛋白(Amyloid precursor protein,APP)的过度表达、持续的氧化应激和脑损伤均可导致细胞凋亡的增多。
本研究发现,7月龄APP/PS1转基因小鼠海马Caspase-3、Caspase-6、cyt-c、Caspase-8mRNA表达均显著高于正常对照组,提示APP/PS1转基因小鼠海马细胞凋亡增加。神经细胞凋亡始于AD早期,甚至早于老年斑和神经原纤维缠结形成之前。AD患者海马Aβ含量增加,Aβ通过激活Caspase诱导神经细胞凋亡,而Caspase-3又参与了APP的代谢过程,导致Aβ的生成增多。刘慧莉等人[6]通过TUNEL和NISSL染色方法证实APP/PS1转基因小鼠海马出现大量的神经细胞凋亡和齿状回神经元丢失现象。Aβ导致的细胞凋亡是通过Bcl-2蛋白家族和Caspase蛋白家族基因调控的。Aβ可能通过改变Bcl-2/Bax比值,同时激活Caspase并引发Caspase酶链锁反应,促进神经细胞过度凋亡。Aβ可以降低Bcl-2的表达水平,诱导神经细胞凋亡,而过度表达Bcl-2可降低Aβ的神经毒性,提高神经元的存活率。
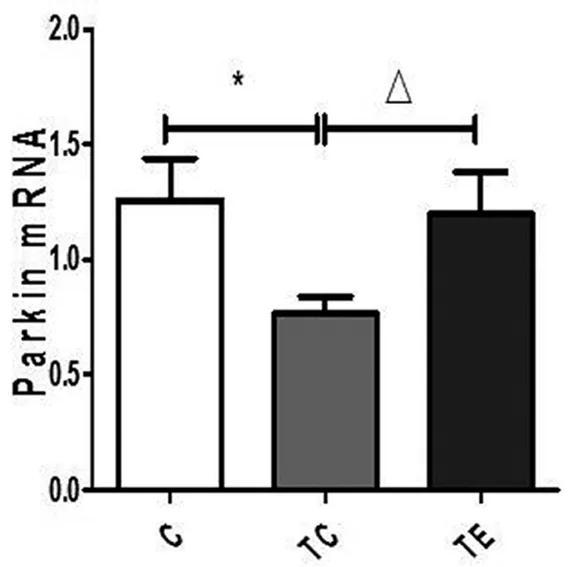
APP/PS1转基因小鼠作为研究较多转基因AD小鼠,7月龄时脑内可见明显的Aβ沉积,海马神经元丢失增多。本研究结果证实,7月龄APP/PS1转基因小鼠抑制海马神经细胞凋亡的能力低于野生对照组,而10周的跑台运动显著降低APP/PS1小鼠海马Caspase-3、Caspase-6、Caspase-8和cyt-c mRNA的表达水平,提示跑台运动通过减少促凋亡因子的表达抑制AD小鼠海马细胞凋亡。研究[7]证实,16周的跑台运动降低NSE/APP转基因小鼠海马cyt-c、Caspase-3、Caspase-9和Bax的表达水平,增加了NSE/APP转基因小鼠海马Bcl-2mRNA的表达水平。研究[8]发现,3个月的跑台运动降低NSE/hPS2m转基因小鼠大脑皮层Caspase-3mRNA的表达水平,提高大脑皮层Bcl-2/Bax比值。上述研究结果提示,运动通过提高海马神经细胞抗凋亡能力,达到预防和缓解AD的目的。
海马神经细胞异常凋亡将导致认知功能障碍疾病的发生,AD患者脑内神经细胞凋亡增多。运动可以增强突触可塑性,抑制神经细胞凋亡,但运动调节APP/PS1转基因小鼠神经细胞凋亡的确切机制尚不明确。目前就运动影响APP/PS1转基因AD小鼠神经细胞凋亡的研究成果相对较少,研究[8]证实,小强度的跑台运动通过抑制海马神经细胞凋亡,减少APP/PS1转基因小鼠海马齿状回神经元的丢失。但该研究仅通过TUNEL和NISSL染色方法观察了跑台运动对AD小鼠海马齿状回细胞凋亡的影响情况,没有对细胞凋亡相关基因表达情况进行检测。本研究对APP/PS1转基因小鼠进行10周的跑台运动干预,结果证实,跑台运动通过下调促神经细胞凋亡基因Caspase-3、Caspase-6、Caspase-8和cyt-c mRNA的表达水平,提高了APP/PS1转基因小鼠海马细胞抗凋亡能力,降低了海马神经元细胞凋亡。
Parkin是位于6q25-27与家族性帕金森综合征密切相关的基因,是最早发现的家族性帕金森综合征致病基因并命名为Parkin[9]。Parkin表达于人体所有组织,Parkin可以通过底物蛋白的泛素化调节线粒体自噬、蛋白降解,参与帕金森综合征的发病过程等。Parkin能够抑制由线粒体应激和内质网应激诱导的细胞凋亡,发挥神经保护功能。Parkin参与线粒体通路介导的细胞凋亡过程,在细胞受到外界刺激情况下,Parkin通过募集线性泛素分子组合成复合体,通过提高NF-κB关键调节分子(NF-κB essential modulator,NEMO)线性泛素化水平,然后进一步激活线粒体视神经萎缩相关蛋白1(optic atrophy type1,OPA1),提高OPA1的转录水平,OPA1上调能够维持线粒体完整性和阻止细胞凋亡,形成Parkin-NEMO-OPA1信号通路。cyt-c是位于线粒体内膜的水溶性蛋白,是最早发现的由线粒体释放的促细胞凋亡蛋白,正常情况下cyt-c不能透过线粒体外膜,而当线粒体外膜蛋白聚合成膜通透转运孔(permeability transition pore,PTP)复合体,外界刺激使PTP通透性增加导致水分进入线粒体,并最终引起cyt-c释放,而胞质内以单体存在的Bax在受到外界刺激时形成聚合物整合到线粒体上,使线粒体外膜通透性增加,导致cyt-c释放增多,从而诱导了细胞凋亡的发生。Parkin能够抑制因凋亡刺激诱导的线粒体cyt-c的释放,证实了Parkin抗细胞凋亡作用与线粒体介导的细胞凋亡相关。而线粒体cyt-c的释放同样受OPA1活性的影响,提示Parkin-NEMO-OPA1抗凋亡通路通过抑制线粒体cyt-c的释放抑制细胞凋亡的发生。本实验结果显示,7月龄APP/PS1转基因小鼠海马Parkin-NEMO-OPA1信号通路关键分子Parkin、NEMO和OPA1mRNA的表达水平显著低于正常对照组,差异具有显著性,而cyt-c、Caspase-3、Caspase-6、Caspase-8mRNA的表达水平均显著高于正常对照组,提示APP/PS1转基因小鼠海马Parkin-NEMO-OPA1抗细胞凋亡能力下降,导致转基因小鼠海马线粒体cyt-c释放增多,上调Caspase-3、Caspase-6、Caspase-8等基因的表达水平,引起海马细胞凋亡增多。
耐力训练增加了2型糖尿病小鼠海马Parkin和OPA1的表达水平[10]。近期的研究也证实,2周的跑台训练显著增加脑缺血大鼠皮层OPA1的表达水平[11],提示跑台运动可能通过提高OPA1mRNA的表达水平,发挥神经保护功能。目前还没有就Parkin-NEMO-OPA1抗凋亡通路对APP/PS1转基因小鼠海马线粒体介导的细胞凋亡方面的研究。本研究发现,10周的跑台运动上调APP/PS1转基因小鼠海马Parkin、NEMO和OPA1mRNA的表达水平,抑制APP/PS1转基因小鼠海马cyt-c、Caspase-3、Caspase-6、Caspase-8mRNA的表达,提示跑台运动通过提高Parkin抗凋亡通路关键分子Parkin、NEMO和OPA1mRNA的表达水平,降低线粒体cyt-c的释放和Caspase-3、Caspase-6、Caspase-8mRNA表达水平,抑制APP/PS1转基因小鼠海马细胞凋亡。
4 结 论
APP/PS1转基因小鼠海马Parkin-NEMO-OPA1抗凋亡通路mRNA的表达水平下降导致海马线粒体cyt-c和Caspase-3、Caspase-6、Caspase-8等促凋亡基因的表达水平提高,导致APP/PS1转基因小鼠海马细胞凋亡增加。而10周的跑台运动通过提高Parkin-NEMO-OPA1抗凋亡通路Parkin、NEMO和OPA1mRNA的表达水平,降低线粒体cyt-c的释放和Caspase-3、Caspase-6、Caspase-8mRNA的表达水平,抑制AD小鼠海马细胞凋亡。
