基于D-SERS法表征两性霉素B对白色念珠菌抑制作用的研究
2019-03-29范加腾许激扬
范加腾,陆 峰,许激扬
(中国药科大学生命科学与技术学院,江苏 南京,210000)
近20年来,全球真菌感染率急速上升,尤其是深部真菌感染的死亡率高达40%[1-2],其中,念珠菌是最主要的条件性致病真菌之一。
目前,能够治疗真菌感染的药物主要有:唑类抗真菌药物,此类药物为抑菌剂,仅能抑制白色念珠菌的生长,而不能起到杀菌效果[3-5]。烯丙胺类抗真菌药物,主要治疗浅部真菌感染。棘白菌素类药物对白色念珠菌具有杀灭作用[6]。而多烯类抗真菌药物,以其杀菌效果强、治疗范围广、耐药菌较少为广大医务人员所青睐,本研究以多烯类抗真菌药物两性霉素B作为研究对象[7],来表征该药物对白色念珠菌的抑制作用。
传统的用于表征药物与菌株相互作用的方法非常费时,需要培养菌株以检测菌株生长或生长行为[8-9]。因此,亟需更加快速、简便的方法。
动态表面增强拉曼光谱法(D-SERS),即在纳米溶胶从湿态到干态的转变过程中进行检测[10-15]。随着D-SERS的调控条件的优化以及其本身强大的优势,其应用范围也越来越广泛,我们研究小组曾将其成功地应用于相关的药品快检[16]和对植物性膳食补充剂中掺杂药物的高灵敏现场检测[17]中。因此,笔者决定采用动态增强拉曼光谱法分析药物与菌株的相互作用,以期建立更加快速、简便的方法来表征两性霉素B对白色念珠菌的抑制作用,为后续对微生物菌株的鉴别和分析药物的作用效果和机制奠定基础。
1 材料与方法
1.1 药品和试剂
硝酸银(AgNO3)、二水合柠檬酸三钠(Na3C6H5O7·2H2O)、丙酮(C2H6O)、乙醇、双氧水(30% H2O2)、浓硫酸(H2SO4)、硝酸(HNO3)、氢氧化钠(NaOH)、碳酸氢钠(NaHCO3)等均为分析纯,购自国药集团化学试剂有限公司。临床敏感白色念珠菌311由上海长海医院皮肤科提供。实验用水为三蒸水和去离子水。酵母浸膏、葡萄糖(C6H12O6)、蛋白胨、琼脂、RPMI 1640(Gibco BRL)、吗啡啉丙磺酸(MOPS)(Sigma)购自于探索平台。对照品两性霉素B(AMB)、米卡芬净(MCF)购自于大连美伦生物科技有限公司。
YPD培养液:酵母浸膏10 g,葡萄糖20 g,蛋白胨20 g,加900 ml三蒸水溶解定容至1 000 ml。高温高压灭菌(121 ℃,15 min),放于干燥处备用。
沙氏培养基:葡萄糖40 g,蛋白胨10 g,琼脂20 g,加入三蒸水溶解并定容至1 000 ml。121 ℃,15 min高压蒸汽灭菌。
RPMI 1640培养液:RPMI 1640(Gibco BRL)10 g、NaHCO32.0 g、吗啡啉丙磺酸(MOPS)(Sigma)34.5 g(0.165 mol/L),加三蒸水900 ml溶解,用1 mol/L NaOH调pH至7.0(25 ℃)。三蒸水定容至1 000 ml,0.22 μm微孔滤膜过滤除菌,分装后于4 ℃保存备用。
Piranha溶液:30% H2O2与浓硫酸按体积比3∶7称量,将30% H2O2溶液缓慢加入浓硫酸中,于75 mm培养皿中静置,冷却后备用。
1.2 仪器
K-sens拉曼光谱系统(上海复享公司);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);TG16-WS型高速离心机(上海卢湘离心机有限公司);KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司);Zeiss EVO MA-10扫描电镜显微镜(德国Carl-Zeiss);Eppendorf 5417R高速冷冻离心机,(德国Eppendorf);Zerasizer Nano ZSE纳米粒度仪(英国马尔文);JEM-2100F 200 kV场发射透射电子显微镜(日本JEOL);Vortex-Genie2多功能旋涡混合器(美国Scientific Industries);不锈钢立式电热压力蒸汽灭菌锅(上海三申);MJX型智能霉菌培养箱(宁波江南仪器厂);Multiskan MK3酶标分析仪(美国Thermo fisher);TS-1型脱色摇床(江苏海门市麒麟医用仪器厂)。
1.3 增强试剂的制备与表征
本实验采用经典的Lee法制备纳米银胶[18]。将36 mg的AgNO3溶于200 ml 去离子水中,加热搅拌至微沸,加入4 ml质量分数1%复溶柠檬酸三钠水溶液,溶液颜色由无色透明逐渐变成淡黄色,再变为淡灰色并略带绿色,保持微沸30 min停止反应,水浴冷却。即得到粒径约为75 nm的纳米银球,避光保存。取用银胶溶液时,由于纳米银的制备过程中有微量表面离子干扰,故将配好的纳米银溶液进行表面离子清洗。具体方法为将银胶溶液以6 500 r/min离心,6 min后除去上清液,以相同体积的去离子水复溶,振荡摇匀后备用。同时,通过紫外以及扫描电镜图对银胶进行表征。
1.4 细胞培养与MIC80的测定
取-80 ℃冰箱中冻存的临床白色念珠菌,接种于1 ml YPD培养液中,于30 °C,200 r/min振荡培养16 h,使白色念珠菌处于指数生长后期,活化2次。划板并培养于沙氏培养基上,2 d后长至正常菌株大小。待光谱测定前,将白色念珠菌接种于1 ml YPD培养液中,于上述条件下传代培养16 h。
白色念珠菌的MIC80测定方法为:将传代好的白色念珠菌用新鲜RPMI 1640培养液稀释至105CFU,分别加入96孔板,加入相应体积AMB药物标准品溶液,按照倍比稀释法,使AMB浓度分别为16、8、4、2、1、0.5、0.25、0.125、0.062 5、0 μg/ml ,置于30°C培养箱,培养24 h后用酶标仪测定每孔光密度值,并计算相应的MIC80值。
1.5 光谱检测
为除去硅片表面有机物,需要对硅片进行清洗。首先将硅片放入新配制并放置冷却的Piranha溶液中浸泡。待取用时,将硅片取出并用大量去离子水进行冲洗,之后分别用丙酮、乙醇、去离子水超声清洗各1 h,干燥后备用。
考虑菌液中YPD溶液对结果的干扰,故用去离子水对传代16 h的菌液清洗。具体方法为将菌液以5 000 r/min进行离心4 min,除去上清液,加入等体积去离子水。重复3次确保YPD培养液去除彻底。
将用二甲基亚砜(DMSO)溶解后的两性霉素B加入到清洗干净的菌液中,配成药物浓度为0、0.125、0.25、0.5、1、2、4、8、16 μg/ml的溶液(且DMSO浓度低于2%),涡旋混匀后放入摇床中,作用时间5、60、120、240 min,将溶液进行离心(5 000 r/min,4 min),去除上清夜,再加入等体积的去离子水,重复清洗3次。
将清洗后的菌液和纳米银胶混合并涡旋振荡混匀。取3 μl的混合溶液滴于硅片表面,无需干燥,直接置于拉曼光谱仪下检测。光谱检测参数:激光功率100 mW,积分时间5 s,显微系统放大倍数100。
1.6 数据的预处理
使用Matlab 13.0软件对光谱数据进行预处理,取光谱波段在550~1 800 cm-1用于光谱分析 (550 cm-1之前有硅片520 cm-1的干扰,而1 800 cm-1后几乎没有光谱特征),后面依次对光谱进行基线校正(airPLS法),平滑(Sgolay法)以及规范化(Min-Max Normalization)。
2 结果
2.1 MIC80的测定
常用的微量稀释法作为一种金标准方法,准确性好,测得AMB对白色念珠菌的最小抑菌浓度为1 μg/ml。
2.2 纳米银球的表征
在SERS基底中,最常见的是采用纳米银来增强拉曼信号,而Lee法也成为了最经典的制备方法。在生命科学领域,有不少将纳米银球用于细胞检测的例子,尤其在微生物的检测方面。因此,本研究制备纳米银来进行微生物的拉曼信号的增强。图1为纳米银球的紫外表征和扫描电镜图。图1中可以观察到纳米银近似球状,因此在紫外图中表现出的是一个单峰。纳米粒子的分散程度通常可用紫外吸收峰的半峰宽来反映。约为50 nm的半峰宽体现出纳米粒子具有良好的分散性,纳米银球排列均匀。
2.3 AMB与白色念珠菌作用的光谱图
将两性霉素B溶液加入到清洗干净的菌液中,配成药物浓度为0、0.125、0.25、0.5、1、2、4、8、16 μg/ml的溶液,涡旋混匀后放入摇床中孵育5、60、120、240 min,之后将混合液清洗3遍后滴于硅片表面进行检测。采集到的光谱图进行基线校正,平滑,归一化后,选取光谱波段550~1800 cm-1,得到结果如图2。从图中可以看出拉曼位移在656 cm-1和729 cm-1处的峰强度最强且变化最为明显。当药物浓度比较低甚至为0 μg/ml的时候,656 cm-1处的峰强要高于729 cm-1处的峰强度,随着药物浓度逐渐升高,656 cm-1处的峰强逐渐降低,729 cm-1处的峰强逐渐升高。
因此,笔者将考察该两处拉曼位移峰的峰强比和药物浓度之间的关系(峰比值法),来观察不同浓度的AMB对白色念珠菌拉曼光谱的影响(图3)。从图中可以清楚的看出随着AMB浓度的升高,峰强比迅速下降,当达到一定浓度后峰强比逐渐趋于平稳,即AMB浓度在0~2 μg/ml范围内,峰强比与AMB浓度呈负相关,而且当药物浓度为0.5 μg/ml时即可接近于高浓度的药物作用时所表现出来的峰强比,低于AMB对白色念珠菌的最小抑菌浓度(MIC80)1 μg/ml,这在药物量的使用上要优于传统的方法。从药物的作用时间上分析,AMB与白色念珠菌作用5 min即可与作用60、120、240 min所测的谱图效果一致,因此,AMB对白色念珠菌的抑制作用可以在其相互作用只有5 min的时间内,用所检测的拉曼位移656 cm-1与729 cm-1处的峰强比来进行表征,与传统的方法相比,大大节省了实验时间。
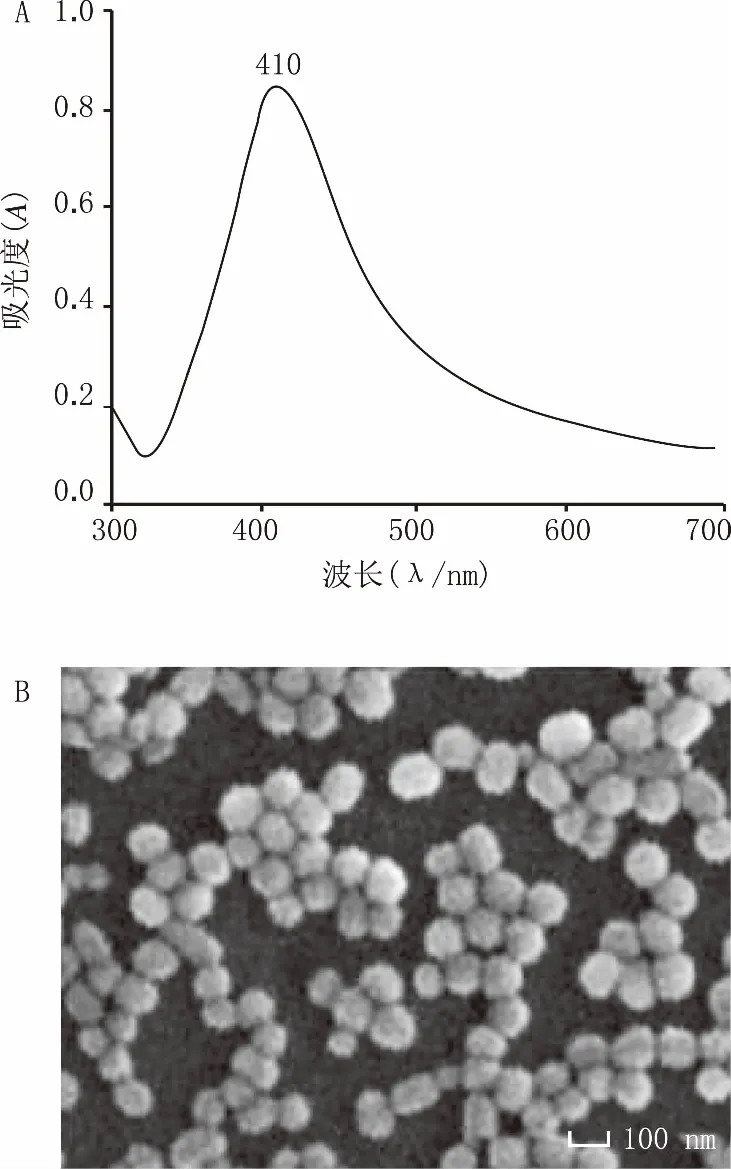
图1 75 nm纳米银球的紫外吸收谱(A)和扫描电镜图(B)
2.4 MCF与白色念珠菌作用的光谱图
同时,笔者考察了同样是杀菌剂的棘白菌素类抗生素米卡芬净钠(MCF)对白色念珠菌的抑制作用,将MCF用去离子水溶解,配成药物浓度为0、0.0312 5、0.062 5、0.125、0.25、0.5、1、2、4 μg/ml的菌液,其他条件和分析方法与上述一致,结果见图4和图5。
结果表明,MCF与白色念珠菌作用的时间为5 min、60 min和120 min时,峰强比与MCF的浓度并没有明显的相关性,作用时间为120 min时,只有高浓度的MCF下才会表现出MCF的浓度与峰强比趋于负相关;当作用时间高达240 min时,MCF的浓度与峰强比趋于负相关,且只在较高浓度2、4 μg/ml时峰值才趋于平稳,远远高于MCF对白色念珠菌的MIC80(0.25 μg/ml)。
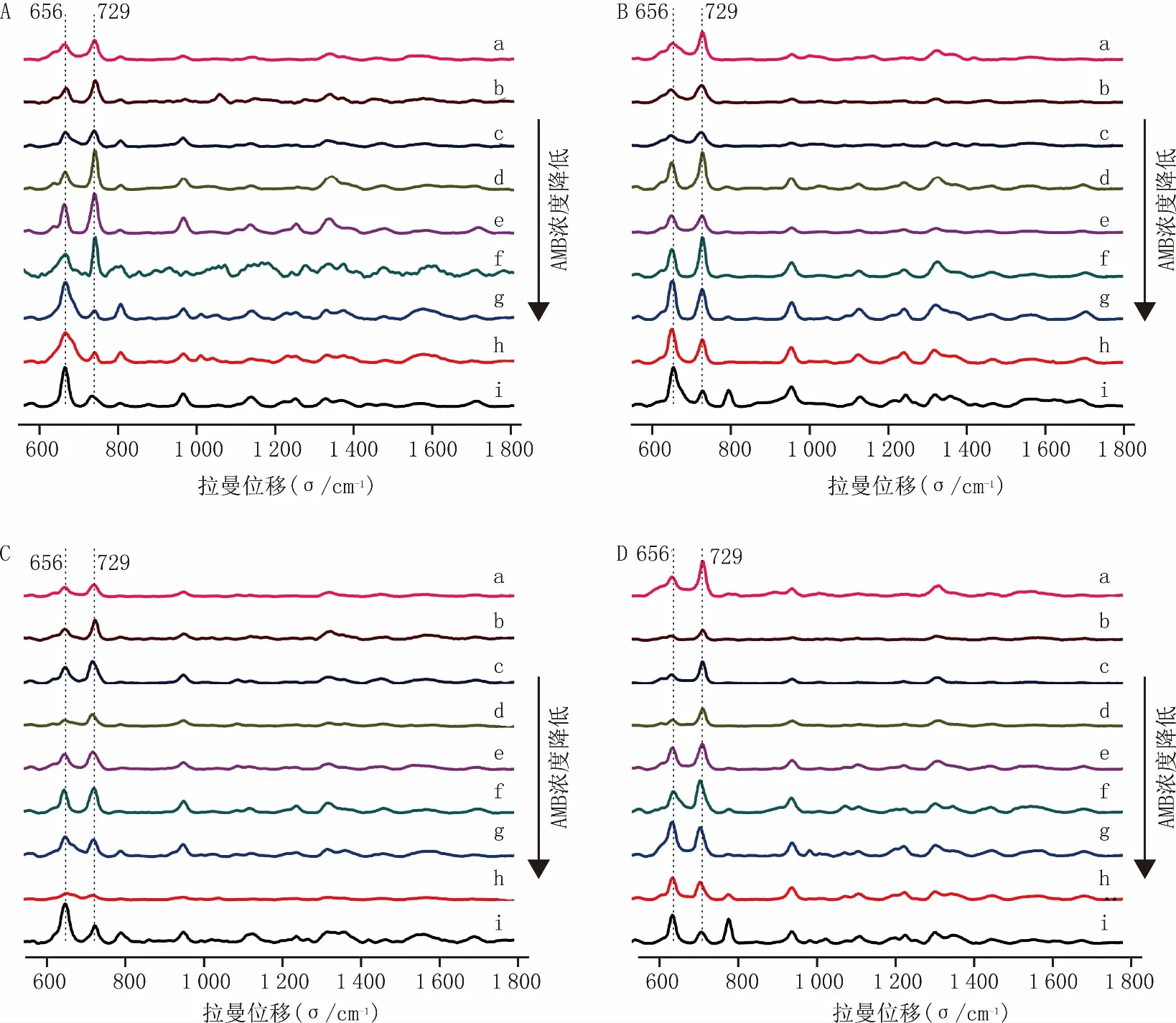
图2 AMB与白色念珠菌不同相互作用时间的拉曼光谱图 A.孵育5 min;B.孵育60 min;C.孵育120 min;D.孵育240 min(AMB的浓度由a至i依次为16、8、4、2、1、0.5、0.25、0.125、0 μg/ml)
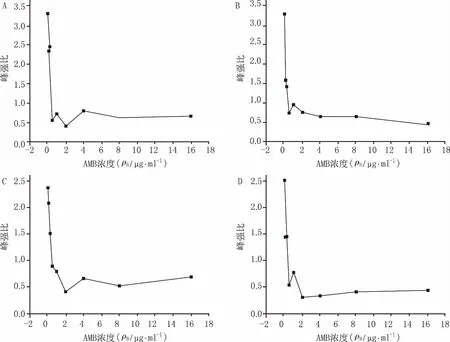
图3 不同作用时间对峰比值与AMB浓度的关系 A.5 min;B.60 min;C.120 min;D.240 min
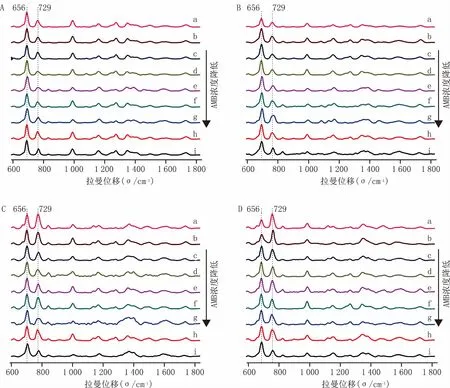
图4 MCF与白色念珠菌不同相互作用时间的拉曼光谱图 A.5 min;B.60 min;C.120 min;D.240 min(MCF的浓度由a至i依次为4、2、1、0.5、0.25、0.125、0.0625、0.03125、0 μg/ml)
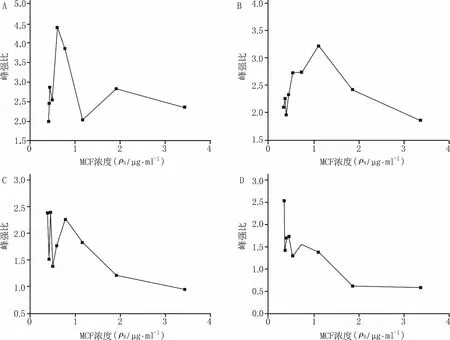
图5 不同作用时间对峰比值与MCF浓度的关系 A.5 min;B.60 min;C.120 min;D.240 min
3 讨论
液体在硅片表面从湿到干变化的过程中,由于毛细现象,粒子的间距逐渐变小,团聚增加的同时“热点”也会相应地增多,因此待测分析物的SERS信号大大增强(主要增强为电磁增强)。白色念珠菌656 cm-1和729 cm-1的特征峰归属于嘌呤代谢物[19-21],因而产生较大拉曼散射截面的嘌呤代谢物能够显示在SERS光谱中。
当不同浓度AMB与白色念珠菌相互作用后,AMB浓度在0~2 μg/ml范围内,拉曼位移656 cm-1与729 cm-1处的峰强比与AMB浓度成负相关,当AMB浓度在低于其最小抑菌浓度0.5 μg/ml时即可接近于高浓度的药物作用时所表现出来的峰强比,且AMB与白色念珠菌作用时间仅为5 min时即可达到上述的规律及优点,因此,AMB对白色念珠菌的抑制作用可以在其相互作用只有5 min的时间内,用所检测的拉曼位移656 cm-1与729 cm-1处的峰强比来进行表征。
关于2种杀菌药物测定结果的差异,我们的解释如下:由于MCF类药物的作用机制是在细胞中非竞争性抑制白色念珠菌细胞壁的重要组成成分β-1,3-葡聚糖合成,破坏细胞壁结构的完整性导致细胞死亡,因此其原因是可能由于此类药物进入细胞后非竞争性抑制β-1,3-葡聚糖合成酶的作用,而不像AMB一样造成膜孔致使细胞内容物外流,其造成的损害过程较为缓慢的,但因此类药物抑制了细胞壁的合成,随着时间增长,药物浓度升高,细胞壁的破坏较为严重,影响细胞膜的通透性,导致细胞内容物外流,具有较大散射截面的嘌呤代谢物才能够被检测到,在光谱图中显示出来。
4 结论
本研究表明D-SERS法可用于描述AMB对白色念珠菌的杀菌作用,为表征AMB对白色念珠菌的抑制作用提供了一种更简单、快速的检测方法。
同时,随着科技的发展,方法的稳定性得以提高后,还可进一步应用于其他药物与菌株,其快速检测能为临床病原菌的早期诊断提供基础。
