齐墩果酸拮抗赭曲霉毒素A诱导的HEK293T细胞自噬性死亡
2019-03-28,,,,,,,,*
,,,, ,,,,*
(1.遵义医科大学公共卫生学院,贵州遵义 563000; 2.贵州省预防医学实验教学示范中心,贵州遵义 563000; 3.遵义医科大学基础医学院,贵州遵义 563000)
赭曲霉毒素A(ochratoxin A,OTA)是由曲霉菌属和青霉属等丝状真菌产生的低分子量次级代谢产物[1]。饲料[2]和食品中都存在广泛的OTA污染。报道的OTA污染的食品或食品原料包括谷物及其制品、肉类、鸡蛋、乳制品、干制品、蔬菜、水果、葡萄酒、豆类、坚果、香料、婴幼儿谷物甚至婴儿配方奶粉[3]。因此,很难完全避免OTA暴露的风险。1993年,OTA被国际癌症研究机构(IARC)归类为2B类致癌物(可能的人类致癌物)。虽然OTA没有像黄曲霉毒素那样被归类为1类致癌物(人类致癌物),但这并不意味着OTA毒性明显低于黄曲霉毒素,只是因为OTA致癌的人类流行病学证据非常稀少,不如黄曲霉毒素对人类致癌的证据充分,所以才归为2B类致癌物[4-5]。事实上,OTA对啮齿动物和家禽是强致癌物[6]。OTA的主要靶器官是肾脏[7-8]。OTA诱导的肾毒性机制主要包括:抑制蛋白质合成,干扰转录调控,代谢酶、细胞信号和组蛋白修饰[9],阻滞细胞周期,诱导氧化应激和细胞凋亡,激活自噬[10],以及上述机制之间的相互作用[3]。
齐墩果酸(oleanolic acid,OA)是一种生物活性的五环三萜类化合物,广泛存在于各种食品原料中,如樱桃、木瓜、葡萄、柿子、蓝莓、山楂、大枣和枇杷等。目前的研究表明OA对糖尿病性肾病、多囊肾病、肾纤维化、高血压性肾损伤、药物及重金属诱导的肾损伤等肾损伤均有一定的保护作用[11]。
许多食物或食物成分如番茄红素、α-生育酚、儿茶素、白藜芦醇等对OTA的肾毒性都有一定的拮抗作用[3]。但明确有护肾作用的OA对OTA的肾毒性是否同样有拮抗作用还未见报道,因此本文拟对OA拮抗OTA诱导的HEK293T细胞毒性的机制进行初步研究。
1 材料与方法
1.1 材料与仪器
齐墩果酸(纯度≥97%) 西格玛奥德里奇(上海)贸易有限公司;赭曲霉毒素A(纯度≥97%) 以色列Fermentek公司;人胚肾上皮细胞(HEK293T) 来源于中国农业大学食品科学与营养工程学院;胎牛血清 美国Hyclone公司;DMEM(高糖)培养基 北京索莱宝科技有限公司;丙烯酰胺和甲叉双丙烯酰胺 美国Amresco公司;Alpha-Tubulin抗体 武汉三鹰生物技术有限公司;Phospho-p70 S6 kinase(Thr389)抗体、Phospho-mTOR(Ser2448)抗体、Phospho-Beclin-1(Ser15)(D4B7R)抗体和LC3B(D11)XP®抗体 美国细胞信号技术中国分公司;增强型CCK8试剂盒、活性氧检测试剂盒(DCFH-DA荧光探针)、辣根过氧化物酶标记山羊抗兔IgG和辣根过氧化物酶标记山羊抗小鼠IgG 上海碧云天生物技术有限公司。
BC-J80S二氧化碳培养箱 上海博迅医疗生物仪器股份有限公司;Centrifuge 5418R高速冷冻离心机 艾本德中国有限公司;Navios流式细胞仪 贝克曼库尔特商贸(中国)有限公司;Mini-PROTEAN®Tetra垂直电泳槽、Chemi DocTMTouch化学发光成像仪 美国伯乐生命医学产品(上海)有限公司;TP-114微量电子天平 丹佛仪器(北京)有限公司。
1.2 实验方法
1.2.1 细胞培养 HEK293T细胞培养选用DMEM完全培养基,内含10%胎牛血清,1%三抗(三种抗生素包括青霉素、链霉素和两性霉素B的混合物),1%非必需氨基酸,2% L-谷氨酰胺和86% DMEM(高糖)培养基。用0.001%多聚L-赖氨酸铺板37 ℃孵育15 min后按2.5×104个HEK293T细胞/cm2接种,在37 ℃、5% CO2的恒温培养箱中培养24 h。
1.2.2 OA处理对细胞存活率的影响检测 将1.2.1得到的细胞按1万个细胞/孔接种于96孔板中,每孔约80%表面长满HEK293T细胞时,给予7个不同浓度的OA(0、1、4、8、12、20和40 μmol/L)处理2 h,处理结束后重新换上100 μL DMEM培养基,然后每孔加入10 μL增强型CCK8溶液,在培养箱内37 ℃继续孵育2 h,450 nm波长下检测吸光度值并计算细胞存活率。细胞存活率(%)=(处理组OD值-空白组OD值)×100/(对照组OD值-空白组OD值)。空白组不接种细胞,但加入等量DMEM培养基和CCK8溶液的对照组。每组处理做5个复孔的重复[1]。通过细胞存活率的检测确定OA进一步实验的处理浓度。
1.2.3 OA和OTA处理对细胞存活率的影响检测 将1.2.1得到的细胞按1万个细胞/孔接种于96孔板中,每孔约80%表面长满HEK293T细胞时,分6组(对照组、OTA组、OA组、P组、M组和L组)进行给药。其中对照组仅加100 μL DMEM培养基;OTA组仅加OTA处理;OA组仅加OA处理;P组为先OA处理,处理结束后用OTA处理;M组为OTA处理22 h后,用OA和OTA同时处理2 h;L组为先OTA处理,处理结束后用OA处理。每组的OTA和OA各自的处理时间和浓度如下:OTA处理HEK293T细胞的时间为24 h,OA处理HEK293T细胞的时间为2 h;OTA处理浓度为实验室之前已经实验确定好的半数抑制浓度8 μmol/L[12],OA处理浓度由1.2.2的细胞存活率实验确定。给药结束后重新换上100 μL DMEM培养基,然后每孔加入10 μL增强型CCK8溶液,在培养箱内37 ℃继续孵育2 h,450 nm波长下检测吸光度值并按1.2.2方法计算细胞存活率。
1.2.4 OA和OTA处理对活性氧簇(ROS)含量的影响检测 将1.2.1得到的细胞接种于6孔板中,每孔约80%表面长满HEK293T细胞时,按1.2.3分组进行处理,处理结束后吸干处理液用PBS缓冲液漂洗1次。用无血清DMEM培养基将DCFH-DA荧光探针稀释1000倍,终浓度为10 μmol/L,按照每孔1 mL加入稀释好的DCFH-DA荧光探针37 ℃孵育20 min,用无血清DMEM培养基洗涤3次,去除未进入细胞内的DCFH-DA荧光探针。以Rosup为活性氧阳性对照试剂,同样处理获得活性氧阳性细胞。将各组细胞制成单细胞混悬液放入流式管中,用流式细胞仪检测活性氧水平水平。每组处理做3个复孔的重复[1]。
1.2.5 OA和OTA处理对自噬相关蛋白表达的影响检测 按照比例(裂解液∶PMSF∶蛋白酶抑制剂∶磷酸酶抑制)(100∶1∶2∶2)配制好裂解液后置于冰上待用。细胞按1.2.3分组处理结束后用预冷PBS缓冲液漂洗3次,吸干后每个培养皿加入200 μL裂解液,用细胞刮刀刮下贴壁细胞,转移到预冷的EP管中,冰上静止30 min,12000 r/min、4 ℃离心30 min,吸取上清液得到蛋白样本。之后按照以下步骤操作:80~120 V进行蛋白电泳,以180 mA恒定电流电转90 min后取出PVDF膜用5%封闭液室温封闭1~2 h,一抗(Alpha-Tubulin、Phospho-p70 S6 kinase、Phospho-mTOR、Phospho-Beclin-1、LC3B)4 ℃孵育过夜,TBST洗膜后室温下二抗(辣根过氧化物酶标记山羊抗兔IgG和辣根过氧化物酶标记山羊抗小鼠IgG)孵育1~2 h,洗膜后显色,用化学发光成像仪获取图像,并在软件中获得蛋白条带的灰度值[1]。
1.3 数据分析
2 结果与分析
2.1 OA处理对细胞存活率的影响
如图1所示,与对照组相比,低浓度的OA(1 μmol/L)能够显著提高细胞存活率(p<0.05),有一定的促增殖作用。随着OA处理浓度的增加细胞存活率稍有降低,但与对照均无显著差异(p>0.05),说明OA确实是一个生物活性成分,即使在较高浓度(40 μmol/L)下也没有明显的毒性。因此,选用具有生物活性的低浓度OA(1 μmol/L)作为进一步实验的浓度。
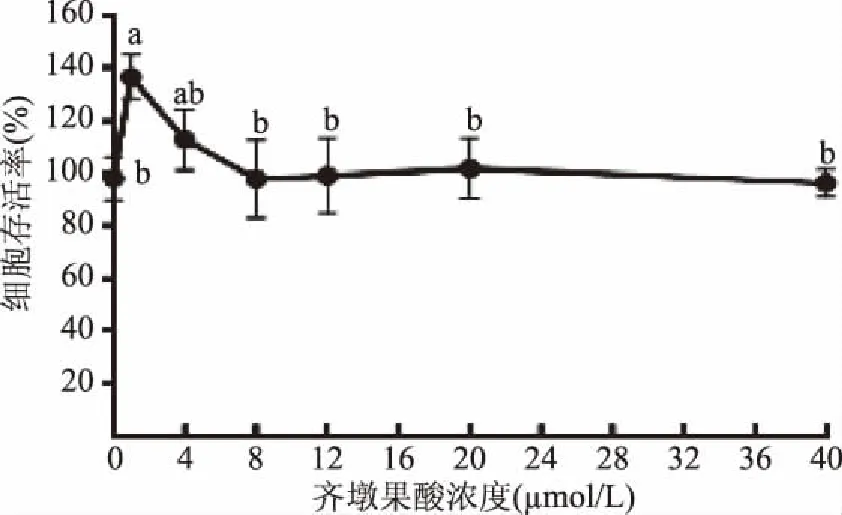
图1 不同浓度OA对细胞存活率的影响Fig.1 Effects of different concentrations of OA on cell viability注:不同小写字母代表差异显著(p<0.05),下图同。
2.2 OA和OTA处理对细胞存活率的影响
如图2所示,与对照组相比,OA处理显著增加细胞存活率(p<0.05),OTA处理显著降低细胞存活率(p<0.05)。与OTA组相比,P组(OA预处理组)、M组(OA与OTA同时处理组)和L组(OA后处理组)细胞存活率均显著提升(p<0.05),提示实际生活中无论哪种方式摄入含OA的食品在一定程度上能够对OTA诱导的肾细胞毒性有一定的拮抗作用。
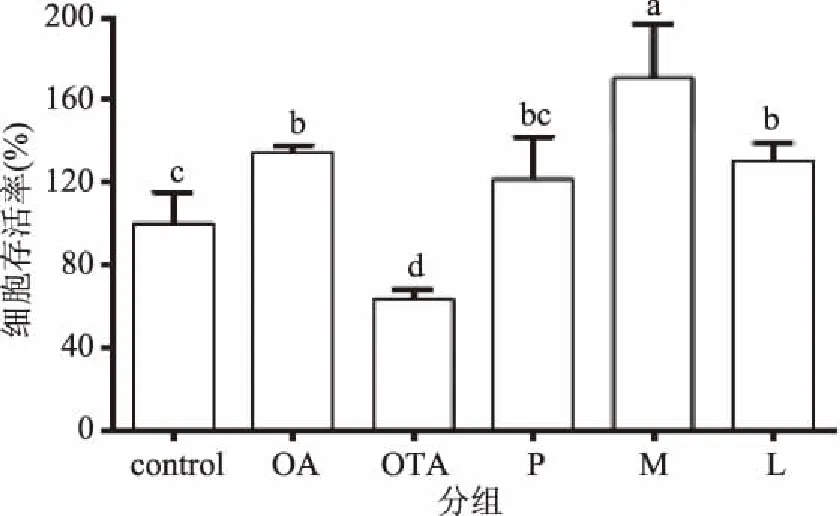
图2 OA和OTA处理对细胞存活率的影响Fig.2 Effect of OA and OTA treatment on cell viability
2.3 OA和OTA处理对ROS含量的影响
如图3所示,与对照组相比,OTA处理组显著增加了细胞内活性氧簇(Reactive oxygen species,ROS)含量(p<0.05),OA处理组ROS含量略有升高,但与对照组无显著差异(p>0.05)。与OTA组相比,P组和L组ROS含量显著降低(p<0.05),M组有降低ROS含量的趋势,但与OTA处理组ROS含量差异不显著(p>0.05),比P组和L组降ROS的效果稍差一点。但P组、M组和L组这3组之间的ROS含量无显著差异(p>0.05),且与对照组无显著差异(p>0.05),这提示实际生活中无论哪种方式摄入含OA的食品在一定程度上能够对OTA诱导的ROS升高有一定的拮抗作用。
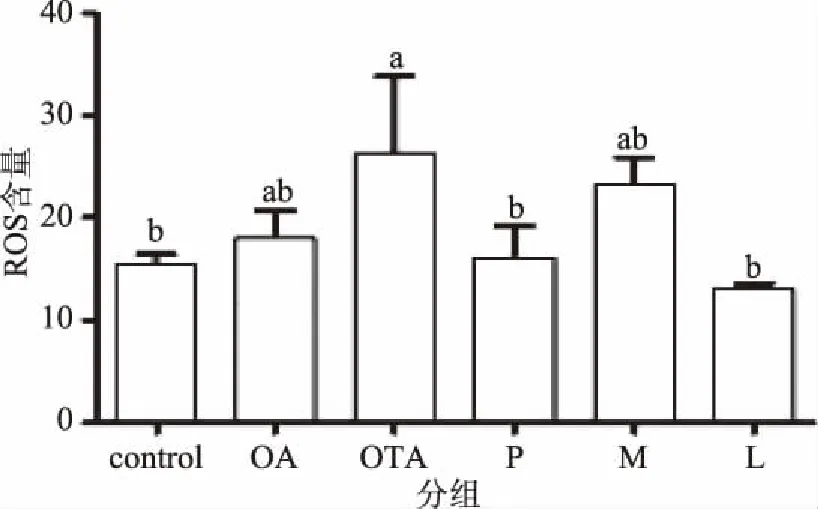
图3 OA和OTA处理对ROS水平的影响Fig.3 Effect of OA and OTA treatment on ROS contents
2.4 OA和OTA处理对自噬相关蛋白表达的影响
如图4所示,与对照组相比,OTA组磷酸化的哺乳动物雷帕霉素靶蛋白(p-mTOR)和磷酸化的p70S6激酶(p-p70s6k)的表达显著降低、磷酸化的Beclin1(p-Beclin1)和LC3-II的表达显著增加(p<0.05),OA组p-mTOR、p-p70s6k、p-Beclin1和LC3-II的表达无明显差异(p>0.05)。与OTA组比较,L组p-mTOR和p-p70s6k表达显著增加、p-Beclin1和LC3-II的表达显著降低(p<0.05),M组p-Beclin1和LC3-II的表达显著降低(p<0.05),P组p-Beclin1的表达显著降低(p<0.05)。mTOR通过磷酸化来抑制ULK1复合物来抑制自噬。p70S6K作为mTOR磷酸化激活的下游蛋白,p70S6K(Thr389)的表达状况也可部分反映mTOR活性。ULK1通过磷酸化Beclin1激活PI3KC3复合物1形成吞噬泡,进而招募LC3-I共价到磷脂酰乙醇胺上转变成LC3-II定位到吞噬泡膜上形成自噬体激活自噬,因此可以用LC3-II/LC3-I的水平来反映自噬激活情况[14]。因此,虽然1 μmol/L OA不会明显激活或者抑制自噬,但是能不同程度缓解OTA诱导的HEK293T细胞自噬,L组最为显著。
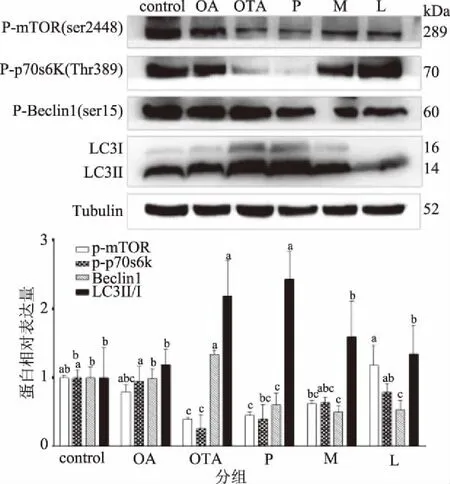
图4 OA和OTA处理对自噬相关蛋白表达的影响Fig.4 Effect of OA and OTA treatment on the expression of autophagy-related proteins
3 讨论
ROS作为一个细胞内信号分子参与了自噬的调节及自噬性细胞死亡,同时也受到自噬的调节[15-16]。有研究表明ROS与mTOR和自噬之间存在一定的联系。例如,Xu等[17]报道的毛酸浆(茄科植物)提取物通过诱导ROS产生来抑制mTOR从而诱导自噬。本实验研究表明不同OA处理方式能够不同程度的缓解OTA诱导的ROS的升高,尤其是L组(图3),而L组对自噬的抑制也最为明显(图4),这与Xu等[17]所证实的结论相一致。
自噬是一个自我吞噬的体系,将包括细胞器在内的一些细胞组分包裹进一个叫做自噬体的双层膜结构,然后与溶酶体融合,被溶酶体内的水解酶降解[18]。胞内外应激、饥饿信号、生长因子剥夺、内质网应激、致病菌感染及损伤的细胞器或蛋白质聚集积累等都会诱导自噬来维持细胞在不利环境中的生存,此时自噬作为一种细胞生存的保护机制,当发生过度自噬时,细胞发生自噬性细胞死亡[19]。自噬不足或者过度都会导致细胞损伤,恰当的调节自噬对细胞健康是必要的。自噬被上游信号级联网络严格控制,其中mTOR已被确定为自噬的关键负调节因子[20]。图4观察到OTA通过下调p-mTOR、p-p70S6K的表达,上调p-Beclin1、LC3-II的表达来诱导自噬。结合图2来看,OTA激活了自噬但是并没有导致细胞存活率增加,反而导致了更多细胞的死亡,这就说明OTA诱导的自噬属于过度自噬,引起的细胞的自噬性死亡。因此,结合图2~图4可以说明,虽然1 μmol/L OA不会明显诱导ROS产生和激活自噬,但是能够通过调节p-mTOR、p-p70S6K、p-Beclin1和LC3的表达来不同程度缓解OTA诱导的HEK293T细胞的自噬性死亡,L组最为显著。所以,人们通过摄入含OA的食品或多或少都能够对OTA诱导的肾细胞毒性有一定的拮抗作用。
4 结论
1 μmol/L OA不会明显诱导ROS产生和激活自噬(p>0.05),但是能够通过调节p-mTOR、p-p70S6K、p-Beclin1和LC3的表达来不同程度缓解OTA诱导的HEK293T细胞的自噬性死亡,OA后处理方式效果最为明显(p<0.05)。所以,人们通过摄入含OA的食品能够对OTA诱导的肾细胞毒性有一定的拮抗作用。
