不同温度液氮速冻对斑点叉尾品质的影响
2019-03-28,,,,,,,,,,*,,
, , ,, , ,, ,, ,*, ,
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068; 2.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064; 3.长江大学生命科学学院,湖北荆州 434025)
斑点叉尾鮰(Channel catfish),又称美洲鲶、河鲶、沟鲶,属于鲶形目,鮰科,叉尾鮰属,是一种原产于美洲的大型淡水鱼类,鮰鱼具有适应能力强、生长快、食性杂、抗病能力强、产量高、易养殖、肉质细嫩、无肉间细刺等特点,是世界公认的最适合加工的淡水鱼之一。上世纪80年代后,我国开始引进鮰鱼,目前已在我国20多个省市进行养殖,产量已经高达16.2吨/公顷[1]。鮰鱼具有较高的营养价值,含有多种人体必需的氨基酸、维生素和大量的不饱和脂肪酸,深受消费者的喜爱[2]。在工业加工过程中,鮰鱼脂肪含量高易发生氧化,进而促进蛋白质的变性、ATP降解等一系列劣变反应的进行,因而常采用冷冻的方式来维持产品品质,提高产品价值[3-4]。
食品加工中的冷冻方式主要有静止空气冻结、鼓风冻结和液氮冻结等。较于其他冻结方式具有以下优点:速冻快、产量高、质量好、干耗小、抗氧化、杂菌少、环境友好。另外,液氮的冻结设备占地面积小、结构简单、操作方便、易于维护[5];随着空气分离技术的发展,液氮冻结成本也在逐渐下降,使得液氮冻结技术在食品行业中成为新的研究热点[6]。液氮速冻能够提高冻结速率,在冻结过程中能够快速通过最大冰晶生成带形成较小冰晶,对鱼肉组织的损伤较小;此外,液氮无色、无味、化学性质稳定,不与其他物质发生化学反应,产品的质量和营养价值能够更好地维持[7]。目前对液氮速冻的研究主要包括鲍鱼、带鱼、银鲳鱼、蟹、鱼丸等产品,其中常见研究采用液氮-20、-40、60 ℃、喷淋式、沉浸式等冷冻方式在维持品质方面的应用,但是关于液氮速冻温度对鮰鱼冻结品质的影响还未见报道。
因此,本研究通过液氮速冻柜来控制-60、-80、-100 ℃液氮速冻温度,研究速冻温度对鮰鱼品质的影响,为液氮速冻技术在鮰鱼流通、运输、贮藏方面的应用及进一步研究提供理论依据和技术指导。
1 材料与方法
1.1 材料与仪器
鲜活的斑点叉尾鮰(Channel catfish) 约2 kg,购于湖北省武汉市白沙洲水产品批发市场;酒石酸钾钠 西陇化工股份有限公司;无水硫酸铜 Shanghai Macklin Biochemical Co.,Ltd;氢氧化钠、氯化钠、二甲苯、盐酸、氨水、中性树胶、无水乙醇、十二烷基硫酸钠 国药集团化学试剂有限公司;苏木素-伊红染液 武汉谷歌生物科技;宽范围彩色预染蛋白质Marker:11~245 kDa 天根生化科技有限公司。
1.2 实验方法
1.2.1 样品处理 在4 ℃的冷库中将鮰鱼敲击致晕,去除内脏,流水清洗干净后,放置4 ℃环境中备用。将准备好鮰鱼随机分成4组,每组3条,然后进行如下处理并贮藏:
留取1组鮰鱼作为新鲜样品组,收集新鲜鮰鱼样品的组织渗出液备用,并进行相关指标的测定。将另外3组鮰鱼样品在温度为-60、-80、-100 ℃的液氮速冻柜中进行液氮速冻,同时将温度记录仪探头分别插入鱼体的前背、中背、后背及腹腔中,待温度达到设定温度之后,液氮速冻30 min;然后将速冻的鮰鱼样品置于-18 ℃贮藏24 h;然后取出各组的鮰鱼样品称重(m0),置于4 ℃进行约8~12 h解冻,待解冻完成后,收集解冻后组织渗出液并用解冻后的鮰鱼背部鱼肉样品测各种指标。
1.2.2 冷冻组织切片制作及微观结构分析 参考赵玉华等[8]方法,取0.1 cm×0.1 cm背部鮰鱼肉,用于制作冷冻组织切片,将新鲜组织固定于4%多聚甲醛24 h以上,然后从固定液取出组织修平整,依次放入10 mL 15%、30%蔗糖溶液4 ℃冰箱脱水沉底,取出脱水组织稍吸干表面水,切面朝上置于包埋台上,组织周围滴上OCT包埋剂,将包埋台放在Thermo冰冻切片机的速冻台上速冻包埋,待OCT变白变硬后,将包埋台固定于切片机上,先粗切织面,待修切平整后即可开始切片,切片厚度8~10 μm,然后将干净的载玻片平放于切片上方,即可将组织贴于载玻片上,-20 ℃保存备用。
冷冻切片HE染色:冷冻切片用4%多聚甲醛固定15 min,PBS漂洗3次,5 min/次,然后用Harris苏木素染3~8 min,自来水洗,1%盐酸酒精分化数秒,自来水冲洗0.6%氨水返蓝,流水冲洗;再将切片置于伊红染液中染色1~3 min;然后将切片依次放入95%酒精I、5 min-95%酒精II、5 min-无水乙醇Ⅰ、5 min-无水乙醇Ⅱ、5 min-二甲苯Ⅰ、5 min-二甲苯Ⅱ、5 min-中脱水透明,从二甲苯拿出稍晾干,中性树胶封片;用Nikon Eclipse CI光学显微镜镜检,最后用NMI20-025V-I成像系统采集图像进行分析。
用image-ProPlus 6.0和Pannoramic Viewer 1.15.3软件计算出细胞面积、细胞间隙、冰晶面积,用软件处理过数据,作图。
1.2.3 解冻损失率 参考刘欢[9]、Mortensen[10]等的方法,用滤纸吸去-60、-80、-100 ℃鮰鱼解冻后鱼肉表面的水分称取质量(m1),按照下列公式计算:
整治手法:修缮和更换结构破损严重的建筑构件,现状瓷砖贴面予以保留,裸露的砖墙墙面以白色防水涂料进行粉刷,勒脚部分用深灰色防水涂料粉刷,进行建筑节能改造。

式(1)
式中,m0-冻结鱼肉的质量;m1-解冻后鱼肉的质量。
1.2.4 加压失水率 参考董开成[11]方法,将新鲜、-60、-80、-100 ℃鮰鱼分别称取2 g左右的白肉,准备大小为4 cm×4 cm的纱布。先称取纱布质量m1,再称取纱布与样品的总质量m2,纱布对折包裹住样品,向其上下各放8层滤纸使样品置于滤纸中心位置,并放在YYW-2型应变控制式无侧限压力仪的加压板中心,转动摇把使试样与加压板刚好接触,停止转动摇把,将测力计的百分表读数调至零点,然后进行手动加压,顺时针转动摇把直至测力计的百分表读数为145,开始计时并维持此数值5 min,测试结束后,逆时针转动摇把,取下试样,剥去上下8层滤纸,称量加压后纱布与样品的总质量m3。计算公式如下:
式(2)
式中:X-样品的加压失水率,%;m1-纱布质量,g;m2-加压前纱布与样品的总质量,g;m3-加压后纱布与样品的总质量,g。
1.2.5 蒸煮损失率 参考王凤玉[12]、Klç[13]等方法,将新鲜、-60、-80、-100 ℃取背部鮰鱼肉样品鱼肉称10 g左右(m1)放入保鲜袋中,置于85 ℃水浴锅中进行蒸煮,25 min后取出,冷却至室温,用滤纸拭去鱼肉表面的水分,再称重(m2),计算蒸煮损失率;计算公式如下:

式(3)
其中,m1-蒸煮前样品的总质量,g;m2-蒸煮后样品的总质量,g。
1.2.6 pH测定 用pH标准校正缓冲液校正便携式pH计,然后用蒸馏水冲洗探头,用滤纸擦拭干净,将便携式pH计探头插入鱼肉中,分别测定新鲜、-60、-80、-100 ℃鮰鱼样品的pH。
1.2.2.6 色泽 参考胡亚芹等[4]方法,将新鲜、-60、-80、-100 ℃背部鮰鱼肉切成1 cm×1 cm大小的块状,去皮,用色度测定仪测定样品的色度,白度按下列公式计算:
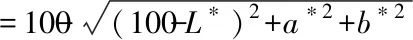
式(4)
式中,L*表示样品的亮度;+a*表示样品偏红,-a*表示表示偏绿;+b*表示样品偏黄,-b*表示样品偏蓝。
1.2.7 质构特性的测定 参考宋敏等[7]方法,将新鲜、-60、-80、-100 ℃鮰鱼切成1 cm×1 cm大小的块状,并将鱼块置于质构仪A/CKB探头下进行韧性(剪切力)的测定,力臂25 kg,测前速率5.0 mm/s,测中速率1.0 mm/s,测后速率5.0 mm/s,压缩形变50%。每组平行测定6次。
1.2.8 解冻渗出液SDS-PAGE电泳 将新鲜渗出液、-60、-80、-100 ℃鱼肉解冻的渗出液收集,并用双缩脲法(按照NY/T1678-2008)测定蛋白质的浓度,用5% SDS调整渗出液的蛋白浓度至1.5 mg/mL,取100 μL 1.5 mg/mL蛋白浓度渗出液加50 μL上样缓冲液,使蛋白浓度调至1 mg/mL,混匀并在沸水中加热3 min,待冷却至室温储存于-20 ℃冰箱冷冻备用。
然后,采用12%的分离胶浓度,5%的浓缩胶浓度,对制备好的新鲜渗出液、-60、-80、-100 ℃鱼肉解冻的渗出液进行电泳,经考马斯亮蓝染色,脱色后观察新鲜的与不同液氮速冻温度处理后渗出液的蛋白条带变化[14]。

CPMG测试后的样品进行MSE序列成像测试,运用MRI成像软件及MSE多层自旋回波序列采集样品冠状面质子密度像,成像系统分析参数为:成像厚度5 mm,MIR成像视野FOVRead=100 mm,FOVPhase=80 mm,Averages=4,TR=500 ms,TE=20 ms,Slices=1,Slice Width=3.0 mm。
1.3 数据处理
采用SPSS 20.0进行差异显著性分析,实验数据用GraphPad Prism5.0作图。
2 结果与分析
2.1 不同液氮速冻温度对鮰鱼微观组织结构的影响
本试验采用冷冻切片观察鮰鱼样品的微观组织结构,如图1所示。新鲜鮰鱼肌纤维排列紧密,随着液氮速冻温度降低,肌纤维间的间隙逐渐增大,-100 ℃速冻使得肌纤维和周围的膜结构之间出现分离,同时肌纤维完整性遭到破坏。采用速冻处理会使样品组织形成的小而多的冰晶,对样品组织的影响较其他冷冻方式较小,但是,样品处理过程(液氮速冻后置于-18 ℃贮藏24 h)可能是较大温差的存在导致冰晶再生长,因此对组织结构造成破坏。
2.2 不同液氮速冻温度对鮰鱼微观组织形态的影响
对冷冻组织切片进行处理及分析,结果如图1、图2所示。新鲜样品与不同液氮速冻温度处理相比较,随着液氮温度降低,冰晶面积、细胞面积、细胞间隙呈现增大趋势。不同液氮速冻温度处理样品间,随着温度降低冰晶面积呈现增大趋势;-100 ℃速冻鮰鱼细胞面积较-60、-80 ℃增大;-60 ℃速冻鮰鱼细胞间隙较-80、-100 ℃小。冰晶面积随着液氮温度降低趋向于增大,造成冰晶面积增大原因是液氮速冻处理过的样品温度与贮藏温度(-18 ℃)的温差很大,导致冰晶再生长,使冰晶面积增大[16];-100 ℃速冻鮰鱼细胞面积较-60、-80 ℃增大,因为冷冻过程中温度降低能够有效的增加细胞面积[17];-60 ℃速冻鮰鱼细胞间隙较-80、-100 ℃小,因为随着液氮速冻温度降低肌原纤维和结缔组织的降解会导致肌原纤维与肌节分离,造成细胞间隙增大[18-19]。

图2 不同液氮速冻温度对鮰鱼组织切片冰晶面积、细胞面积和细胞间隙的影响Fig.2 Effect of different liquid nitrogen quick freezing temperatures on ice crystal area,cell area and cell gap of channel catfish tissue sections注:同一指标的不同小写字母代表样品间存在显著差异(p<0.05)。
结果表明,不同液氮速冻温度处理对于冰晶面积、细胞面积和细胞间隙存在显著影响(p<0.05),进而对鮰鱼的品质产生不同程度影响;考虑不同液氮速冻温度对冷冻速度、冰晶面积、细胞面积和细胞间隙不同程度的影响,-80 ℃液氮速冻对鮰鱼的速冻处理较为理想。
2.3 不同液氮速冻温度对鮰鱼解冻损失率的影响
如图3所示,经过不同液氮速冻温度处理后鮰鱼解冻损失率间差异不显著性(p>0.05)。因为不同液氮速冻温度都已达到快速冻结,快速冷冻可以使样品快速通过最大冰晶生成带,使其形成小且多的冰晶,且分布均匀,对肌肉组织的破坏较小[12],所以-60、-80、-100 ℃速冻鮰鱼的解冻损失率间差异不显著性(p>0.05)。

图3 不同液氮速冻温度对鮰鱼解冻损失率的影响Fig.3 Effects of different liquid nitrogen quick freezing temperatures on the thawing loss rate of channel catfish注:不同小写字母代表样品存在显著差异(p<0.05);图4~图8同。
2.4 不同液氮速冻温度对鮰鱼加压失水率的影响
如图4所示,新鲜鮰鱼肉加压失水率较-60、-80、-100 ℃液氮速冻处理过样品略小,但-60、-80、-100 ℃液氮速冻处理后加压失水率之间差异不显著(p>0.05);造成这种变化的原因可能是经过不同液氮速冻温度之后,冰晶对肌肉组织具有一定机械破坏作用,因此相对于新鲜鮰鱼肉加压失水率要大一些[4];但-60、-80、-100 ℃液氮速冻形成的冰晶对肌肉组织机械破坏作用差别不大,因此其加压失水率之间差异不显著。

图4 不同液氮速冻温度对鮰鱼加压失水率的影响Fig.4 Effect of the different liquid nitrogen quick freezing temperature on the pressurized water loss rate of channel catfish
2.5 不同液氮速冻温度对鮰鱼蒸煮损失率的影响
如图5所示,新鲜鮰鱼肉蒸煮损失率较-60、-80、-100 ℃液氮速冻处理的蒸煮损失率小,即说明新鲜鮰鱼与-60、-80、-100 ℃液氮速冻相比较,新鲜鮰鱼有较好的持水性;但-60、-80、-100 ℃液氮速冻鮰鱼蒸煮损失率之间差异不显著(p>0.05)。这是由于鮰鱼肉在解冻过程中,肌肉蛋白的构象发生改变,破坏了肌肉组织细胞,使其持水力下降,而且在蒸煮过程中,肌肉组织更容易发生聚合,降低了肌肉的持水力;同时经过不同液氮速冻温度后,冰晶对肌肉组织具有一定机械破坏作用,所以相对于新鲜的鮰鱼肉蒸煮损失率大[7]。但这种作用在-60、-80、-100 ℃液氮速冻之间差异不显著,因此其蒸煮损失率之间无明显变化。

图5 不同液氮速冻温度对鮰鱼蒸煮损失率的影响Fig.5 Effect of different liquid nitrogen quick freezing temperature on the cooking loss rate of channel catfish
2.6 不同液氮速冻温度对鮰鱼pH的影响
如图6所示,速冻温度对鮰鱼pH有显著影响(p<0.05),液氮速冻处理样品较新鲜样品pH呈现先下降后略有上升趋势;不同液氮速冻温度处理后,随着温度降低样品pH呈现先下降后上升。因为冷冻初期,宰杀后的鮰鱼,体内缺氧,在无氧条件下发生无氧糖酵解产生乳酸,从而导致pH呈现下降的趋势;而-100 ℃速冻鮰鱼的pH略有回升,可能是冰晶破坏细胞使细胞液渗出较-60、-80 ℃要严重,使得细胞液中蛋白质经酶解后产生氨基酸及碱类物质,使-100 ℃ pH回升[7,20]。

图6 不同液氮速冻温度对鮰鱼pH的影响Fig.6 Effect of different liquid nitrogen quick freezing temperature on the pH of channel catfish
2.7 不同液氮速冻温度对鮰鱼色泽的影响
如图7所示,新鲜、-60、-80、-100 ℃速冻鮰鱼白度存在一定差异,新鲜鮰鱼与-60、-80、-100 ℃处理过鮰鱼相比白度有一定增高,但-60、-80、-100 ℃速冻鮰鱼白度之间差异不显著性(p>0.05)。可能是经过-60、-80、-100 ℃速冻之后,鮰鱼肉脂肪的氧化速度较新鲜样品速度减慢,使得液氮处理鮰鱼肉白度较新鲜鱼样品有所增加;同时经过不同液氮速冻温度之后,冰晶对肌肉组织的机械破坏较小,但与新鲜鮰鱼肉相比冰晶对肌肉组织仍然有一定的机械破坏作用,使得水分渗出在鱼肉表面形成水膜,使光的反射或折射增强,使得不同液氮速冻温度处理过鮰鱼肉白度较新鲜鱼肉有所增加[4]。

图7 不同液氮速冻温度对鮰鱼白度的影响Fig.7 Effects of different liquid nitrogen quick freezing temperatures on whiteness of channel catfish
2.8 不同液氮速冻温度对鮰鱼质构特性的影响
如图8所示,新鲜鮰鱼与-60、-80、-100 ℃速冻鮰鱼的韧性之间存在显著差异,但-60、-80、-100 ℃速冻鮰鱼的韧性之间差异不显著(p>0.05);引起这种变化可能是经过不同液氮速冻温度之后,冰晶对肌肉组织具有一定机械破坏作用,所以相对于新鲜鮰鱼肉韧性要小一些[6];但-60、-80、-100 ℃液氮速冻形成的冰晶对肌肉组织机械破坏作用差别不大,因此其韧性之间差异不显著。
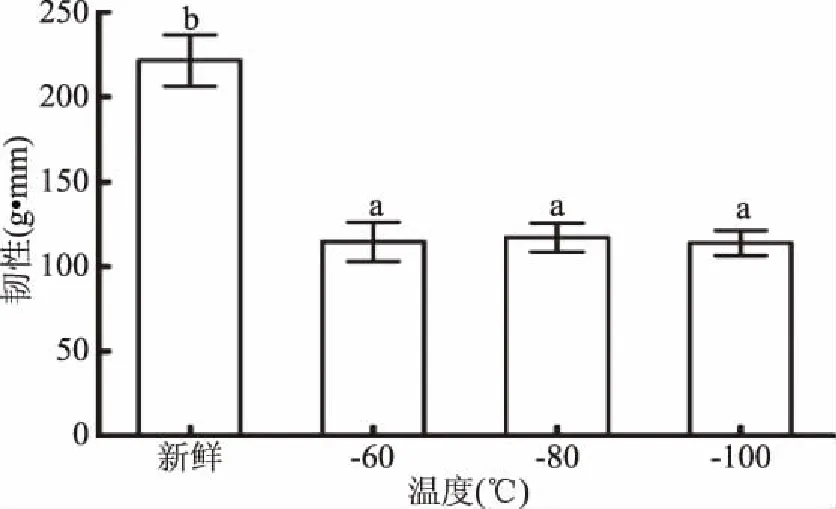
图8 不同液氮速冻温度对鮰鱼韧性的影响Fig.8 Effect of different liquid nitrogen quick freezing temperatures on the toughness of channel catfish
2.9 不同液氮速冻温度对鮰鱼解冻渗出液SDS-PAGE电泳的影响
如图9所示,新鲜、-60、-80、-100 ℃速冻处理鮰鱼渗出液电泳间存在差异,随着液氮温度降低,电泳条带颜色逐渐加深且条带种类逐渐增多,表明随着温度降低渗出液中蛋白含量和种类逐渐增多。63 kDa和17~25 kDa随着液氮速冻温度降低样品渗出液中蛋白含量逐渐增多。原因可能是随着液氮速冻温度降低,冰晶形成对样品组织结构产生破坏加深,使得渗出液中蛋白含量及种类逐渐增多。

图9 不同液氮速冻温度对鮰鱼渗出液SDS-PAGE电泳的影响Fig.9 Effect of different liquid nitrogen quick freezing temperatures on SDS-PAGE electrophoresis of channel catfish exudate注:A:新鲜鮰鱼;B:-60 ℃;C:-80 ℃;D:-100 ℃。
2.10 不同液氮速冻温度对鮰鱼低场核磁共振水分的影响
低场核磁共振技术多以氢核(1H)为研究对象,1H核以非辐射方式从高能态转变为低能态过程称为弛豫;在肉及肉制品中弛豫时间的测量多用H质子横向弛豫时间T2来表示。T2的分布可以表示肉中存在多种性质水分,横向弛豫时间(T2)越短表明水分与底物结合越紧密,反之,水分则自由;其中T21(1~10 ms)代表与大分子结合的水,T22(30~100 ms)代表不可移动的水,T23(>100 ms)代表自由水[21]。
如表1和图10所示,新鲜样品与-60、-80 ℃液氮速冻处理样品T21差异性不显著(p>0.05),但其与-100 ℃液氮速冻处理样品间差异显著(p<0.05);新鲜样品与-60、-80、-100 ℃液氮速冻处理样品T22、T23差异性显著(p<0.05);表明-60、-80、-100 ℃速冻处理主要对不可移动水(T22)、自由水(T23)产生影响;大分子结合水虽然与非水物质结合的很稳定,但-100 ℃速冻处理对大分子结合水产生影响,说明-100 ℃速冻处理使得样品组织结构遭到冰晶的破坏,这与前面的微观组织分析是一致的。

表1 不同液氮速冻温度对鮰鱼低场核磁共振水分的影响Table 1 Effect of different liquid nitrogen quick freezing temperatures on the moisture of low field nuclear magnetic resonance in channel catfish

图10 不同液氮速冻温度对鮰鱼T2图谱的影响Fig.10 Effect of different liquid nitrogen quick freezing temperatures on the T2 map of channel catfish
经过不同温度液氮速冻处理之后,新鲜与-60、-80、-100 ℃鮰鱼样品T22、T23都存在显著差异,但-60、-80、-100 ℃鮰鱼样品T22差异不显著;-60 ℃与-80、-100 ℃鮰鱼样品T23之间存在显著差异;表明经过不同温度液氮处理之后,虽然液氮速冻形成的冰晶较小,但冰晶的形成使非极性基团周围的水凝聚,破坏疏水性残基及三维网状结构,使水的自由度增加;同时,经过解冻之后鮰鱼内部的脱水多孔层增加,使水的流动性增加,也造成水的自由度增加[22];不同液氮速冻温度处理的鮰鱼样品不可移动水(T22)含量下降,而其自由水(T23)含量较新鲜鮰鱼样品有所升高[23],这与前面不同液氮速冻温度处理对鮰鱼样品加压失水率、蒸煮损失率及微观组织结构的影响趋势是一致的[15,24-25]。
2.11 不同液氮速冻温度对鮰鱼核磁共振成像(MRI)的影响
核磁共振成像(MRI)是利用磁场和射频脉冲使样品中氢核振动产生射频信号,经过处理可以获得高分辨率MRI成像,能直观表现水分分布及迁移,水分含量越高,质子密度越高,MRI图像亮度越强[15]。由图11可以观察到,质子密度加权像的亮度由低到高依次为新鲜、-60、-80、-100 ℃,且质子密度加权像的亮度分布比较均匀,其中-100 ℃液氮处理质子密度加权像的亮明显提高,表明经过-100 ℃液氮速冻处理后鮰鱼样品表面水分(自由水)增多,这与前面微观组织结构的细胞面积、细胞间隙和冰晶面积变化趋势是一致的。

图11 不同液氮速冻温度对鮰鱼核磁共振成像伪彩图的影响Fig.11 Effects of different liquid nitrogen quick freezing temperatures on nuclear magnetic resonance imaging pseudo-color map of channel catfish
3 结论
经过不同液氮速冻温度后,鮰鱼样品的解冻损失率、加压失水率、蒸煮损失率、色泽、韧性等指标,其速冻处理的和新鲜鮰鱼样品比较差异性显著,但是不同速冻温度处理间差异不显著;其pH新鲜鮰鱼样品、不同速冻处理差异性显著;SDS-PAGE电泳结果表明,随着液氮速冻温度降低渗出液中蛋白质的种类和含量逐渐增多;微观组织结构方面,经过不同液氮速冻温度后,冰晶面积、细胞面积、细胞间隙也都呈现增大趋势,其中-100 ℃液氮处理后显著增大;低场核磁共振表明不同液氮速冻温度处理之后,新鲜、-60、-80 ℃速冻处理鮰鱼样品的水分分布无显著变化,但-100 ℃液氮处理的鮰鱼样品自由水显著升高。本研究结果表明,一定温度的液氮速冻对鮰鱼品质无影响,但温度降低到-100 ℃时会使得鮰鱼品质降低;从冷冻速率和品质考虑,-80 ℃液氮处理更有利于鮰鱼的速冻处理,这为液氮速冻在鮰鱼流通、运输、贮藏方面的进一步研究提供了一定的参考意义。
