热压结合处理对低温火腿中耐压腐败菌的抑制作用
2019-03-28,,,,,,,,*
,,,,,,,,*
(1.南京农业大学肉品加工与质量控制教育部重点实验室,江苏省肉类生产与加工质量安全控制协同创新中心,江苏南京 210095; 2.江苏省农业科学院农产品加工研究所,江苏南京 210014; 3.江苏雨润肉食品有限公司,肉品加工与质量控制国家重点实验室,江苏南京 211806)
低温肉制品是指在常压下通过蒸、煮、熏、烤等热加工过程使肉制品的中心温度控制在68~72 ℃,并且需要在0~4 ℃的低温环境下贮藏、运输及销售的一类肉制品[1]。其中,低温火腿因其营养丰富、味道鲜嫩等特点,深受消费者的喜爱,但其加工温度较低可能会导致杀菌不彻底,严重影响该类产品的货架期,制约低温火腿产品的发展[2]。
研究表明,使用超高压技术可以使低温火腿产品中大部分初始腐败微生物[3]失去活性,但是也存在一些耐压菌如肠膜明串珠菌(Leuconostocmesenteroides)和绿色魏斯菌(Weissellaviridescens)等[4],这两种菌普遍存在于低温肉制品中[5],且具有抵抗外界很多不利条件的能力,例如耐有机酸、乳酸链球菌素等。热压结合处理灭菌(High pressure thermal sterilization treatment,HPTS)是热处理协同超高压处理技术,既可以降低超高压处理的压力和时间[6],又能有效保护肉品营养价值和其质构特性[7]。研究证明,HPTS技术可以有效灭菌[8]和灭活芽孢[9-10],实际生产中多应用于杀灭牛奶、饮料等中的芽孢菌,在肉制品领域的研究仍有待深入。
本文以低温火腿中最主要的两个耐压腐败菌——绿色魏斯菌和肠膜明串珠菌为研究对象,采用扫描电镜(SEM)和透射电镜(TEM)和流式细胞技术(FCM)研究经热压结合处理(处理条件参照文献[11])的细胞形态、内部结构和细胞生理状态的变化,同时结合核酸、蛋白质流失探究细胞膜的完整性的破坏,从而探讨热压结合处理对绿色魏斯菌和肠膜明串珠菌的细胞膜的影响,旨在为热压结合处理应用于肉品杀菌提供理论依据。
1 材料与方法
1.1 材料与仪器
绿色魏斯菌(GU458345)、肠膜明串珠菌(GU458344) 江苏雨润肉食品有限公司肉品加工与质量控制国家重点实验室保藏;MRS肉汤培养基(MRS Broth):蛋白胨10.0 g/L,牛肉粉 8.0 g/L,酵母粉4.0 g/L,葡萄糖 20.0 g/L,磷酸氢二钾 2.0 g/L,柠檬酸氢二铵 2.0 g/L,乙酸钠 5.0 g/L,硫酸镁 0.2 g/L,硫酸锰 0.04 g/L,吐温80 1.0 g/L;平板计数琼脂(PCA):胰蛋白胨 5.0 g/L,酵母浸粉 2.5 g/L,葡萄糖1.0 g/L,琼脂15.0 g/L;1,2-丙二醇(分析纯) 上海泰坦科技股份有限公司;LIVE/DEAD® BacLight细菌细胞活性测定试剂盒(LIVE/DEAD® BacLight Bacterial Viability Kits) 美国英韦创津公司。
SPF-S-1L-100-850-9-W 型超高压处理装置 英国Stansted Fluid Power公司;AUY120型电子分析天平 日本SHIMADZU公司;MUL-9000系列纯水机 美国密理博公司;M2e多功能酶标仪 德国MD公司;Hitachi SU8010冷场发射扫描电镜 日本日立公司;H-7650透射电子显微镜 日本日立公司;Accuri C6流式细胞仪 美国BD公司;Bioscreen C FP1100-C全自动细菌生长记录仪 芬兰Bioscreen公司;Scan1200自动影像分析菌落计数器 法国Interscience公司;NanoDrop 2000微量紫外分光计 美国Thermo公司。
1.2 实验方法
1.2.1 菌悬液的制备 无菌挑取冻存于-80 ℃的菌种,接种于新鲜的MRS肉汤培养基中,30 ℃培养活化,重复以上步骤进行第2次活化之后,收集培养至稳定期的菌体,6000 r/min、4 ℃条件下离心2 min,弃除上清液,用生理盐水重复离心洗涤菌体沉淀3次,最后制成109CFU/mL菌悬液,一部分封装于无菌的包装袋中热封口,4 ℃条件冷藏以备热压结合处理;另一部分收集至无菌的离心管中,4 ℃冷藏。
1.2.2 热压结合处理 将装有菌悬液的包装袋置于超高压加压釜中,放入超高压仪器中[12],处理压力为350 MPa,保压处理10 min(处理时间不包括升压和卸压所需时间),处理介质为丙二醇,温度为50 ℃,每个样品做3次平行。
1.2.3 微生物计数
1.2.3.1 计数方法 将经过1.2.2热压结合处理后的菌悬液,各处理样(两重复)无菌取样1 mL进行梯度稀释,选择合适的稀释度,采用平板涂布计数法进行菌落总数的测定。未处理样品用MRS培养基,热压结合处理后样品采用薄层平板(TAL)计数。
TAL平板制备:在无菌平板上事先倒入约25 mL MRS琼脂培养基,待培养基冷却后,再向凝固的MRS培养基表面小心倒入约14 mL的PCA培养基,紫外灯下待凝固备用。
1.2.3.2 细菌的存活率计算 存活率=lg(N/N0),其中N0和N分别代表处理前和处理后的菌落数(CFU/mL)[13]。
1.2.4 热压结合处理前后的生长曲线的测量 吸取200 μL经过1.2.2热压结合处理的菌悬液于蜂窝板内,初始浓度为2%,每组设置3个平行孔。置于30 ℃下培养。将蜂窝板置于全自动细菌生长记录仪中,设置从0 h开始,每隔2 h测一次OD600值[14]。对照组为初始浓度为2%的未经过处理的菌悬液,以MRS培养基为空白。
1.2.5 扫描电镜和对细胞形态结构的观察 将经过1.2.2热压结合处理的菌悬液,6000 r/min、4 ℃离心2 min收集菌体,加入1 mL预冷的2.5%的戊二醛溶液,4 ℃条件下固定8 h以上,磷酸缓冲液(PBS,pH=7.4)漂洗3次,每次30 min,再依次经30%、50%、70%和90%的乙醇梯度脱水各15 min后,再用100%的乙醇脱水两次,每次15 min[15]。脱水后样品用叔丁醇置换3次,每次30 min,置换后的样品进行冷冻干燥(温度为-80 ℃,真空度为0.1 mbar),离子溅射仪镀金(厚度约10 nm),扫描电镜观察菌体结构变化,对照组为未处理的菌悬液。
1.2.6 透射电镜对细胞超微结构的观察 将经过1.2.2热压结合处理的菌悬液,6000 r/min、4 ℃离心2 min收集菌体,加入1 mL左右预冷的2.5%戊二醛溶液,4 ℃条件下固定8 h以上。固定后室温下800 r/min离心30 s,弃上清液,加入40 ℃左右的1%琼脂,迅速搅拌后室温下800 r/min离心30 s冷却成团,前部含样品琼脂切成小块再加入戊二醛固定,再以PBS(pH=7.2的0.2 mol/25 L磷酸缓冲液)重悬浮,重复3次,最后以PBS重悬。分别用30%、50%、70%、80%、90%梯度浓度酒精脱水,再用纯酒精脱水3次,然后用纯叔丁醇置换酒精3次,每个步骤各15 min。置换后的样品进行冷冻干燥(温度为-80 ℃,真空度为0.1 mbar),最后将冷冻干燥后的样品离子电流镀金,在透射电镜下观察并拍照[16-17]。设置对照组为未处理的菌悬液。
1.2.7 流式细胞仪分析 本研究利用SYTO9/PI染料(LIVE/DEAD BacLight Bacterial Viability Kit,Invitrogen)对所收集的细菌细胞进行染色,后利用流式细胞仪分析细菌细胞的死亡、受损及活细胞的比例。
将制备好的菌悬液经过1.2.2热压结合处理,6000 r/min、4 ℃条件下,离心2 min收集菌体,生理盐水洗脱3次后,加入SYTO9/PI染液(3 μL,比例为1∶1),室温下,避光孵育15 min[18-19],上机检测,检测激发光为488 nm,SYTO9染料为FL1检测通道,PI为FL3检测通道,计数10000个细胞。将100 ℃处理30 min的样品作为PI阳性对照,未经过处理的样品作为SYTO9阳性对照。
1.2.9 热压结合处理后细菌细胞内核酸、蛋白质泄漏量的测定 将经过1.2.2热压结合处理的菌悬液于4 ℃、4000 r/min离心15 min,收集上清液,使用微量分光光度计测定260 nm(核酸)和280 nm(蛋白质)处的吸光值[20-21],每组设置3个平行,对照组为未处理的菌悬液,空白为生理盐水。
1.3 数据处理与统计分析
本实验数据统计采用SAS 8.0进行成组t检验(p<0.05),数据以均值±标准差表示,采用Excel 2016进行绘图。
2 结果与分析
2.1 热压结合处理对两种耐压菌存活率的影响
通过测量两种菌的存活率来探究热压结合杀菌的效果。由表1可以看出热压处理后绿色魏斯菌和肠膜明串珠菌的存活率为-4.74和-6.61lg(CFU/mL),绿色魏斯菌的存活率略高于肠膜明串珠菌,说明热压结合处理虽不能达到完全杀菌的效果,但能够有效降低这两种菌的存活率,可以起到抑制细菌的作用。由于微生物经受不利条件(超高静压、冻融、热处理、超声波、辐照、微波等)后存在损伤修复现象,这种受伤状态的微生物以传统培养方法无法检测,针对这种情况,采用薄层平板培养方法(thin agar layer,TAL)[22]能较为准确计数,在流式细胞技术结果中显示存在损伤细胞,因此测定经过热压结合处理后的菌落总数使用TAL培养基。
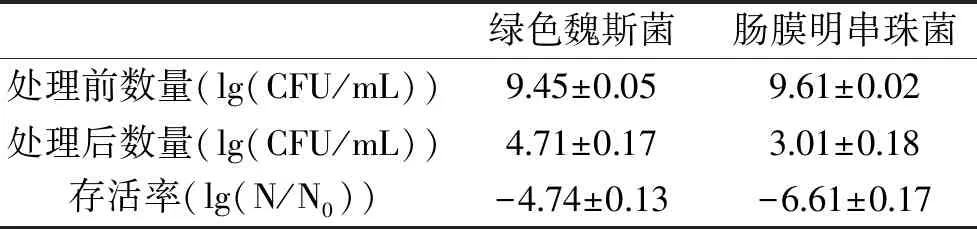
表1 经过热压结合处理后绿色魏斯菌和肠膜明串珠菌的存活率Table 1 Survival rate of Weissella viridescensand Leuconostoc mesenteroides under HPTS treatment
2.2 热压结合处理对两种菌的生长特性的影响
通过测量两种菌热压结合处理前后的生长曲线研究细胞的生长情况。经热压结合处理后,两种菌的生长曲线如图1所示。图1A中,绿色魏斯菌正常菌株在0 h后进入对数期,在18 h后进入稳定期,OD600值为1.246;热压结合处理后细菌在4 h后进入对数期,在第24 h达到稳定期,细菌OD600值达到1.235。图1B中,肠膜明串珠菌正常菌株在0 h后进入对数期,第14 h后进入稳定期,OD600值为1.28;热压结合处理后细菌从16 h后进入对数期,在第38 h达到稳定期,细菌OD600值达到1.289。

图1 热压处理前后绿色魏斯菌和肠膜明串珠菌的生长曲线Fig.1 Growth curve of Weissella viridescensand Leuconostoc mesenteroides untreated and treated by HPTS注:A为绿色魏斯菌,B为肠膜明串珠菌。
两种耐压菌在热压结合处理后都停止了生长繁殖,经历了一段时间的复苏才能正常进行增殖,绿色魏斯菌的迟缓期变为4 h,肠膜明串珠菌的迟缓期变为16 h,且经过复苏后,受损细胞的生长曲线与正常细菌的相近。热压处理后的绿色魏斯菌和肠膜明串珠菌在对数期的生长速率略低于正常细菌,因此达到稳定期的时间变长,绿色魏斯菌整个对数期的时长从18 h变成20 h,肠膜明串珠菌从14 h变成22 h。两种菌增殖后的受损细菌浓度与正常细菌浓度都基本一致,说明热压结合处理对两种菌的生长起到了抑制的效果,但并没有最终完全杀死细菌,只对细菌的生长有延缓作用,在营养充足、条件适宜的情况下,细菌会缓慢恢复正常的生长繁殖过程。
2.3 热压结合处理对细胞形态和超微结构的影响
通过扫描电镜可以直观的观察细菌形态的变化。由图2看出,热压结合处理前的绿色魏斯菌呈短杆状,肠膜明串珠菌呈球状,两者细胞膜结构完整光滑。热压结合处理后,两种菌细胞外形都有轻微变形,有明显凹陷。这表明热压结合处理会导致细胞外形的改变,细胞膜本身因为磷脂双分子结构具有一定的流动性和弹性[23-24],但在细菌接受热压结合处理到用戊二醛固定的一段时间里,细胞膜上的凹陷没有回弹,即热压结合处理会对细胞膜的弹性和流动性造成破坏。但是细胞整体形态完整,说明热压结合处理并没有能够完全破碎这两种耐压菌,它们的细胞膜虽然有些变形,但是依然抵抗住了大部分的高压和热处理,可以推测这两种菌的耐压耐热性来自于细胞膜的防护能力。
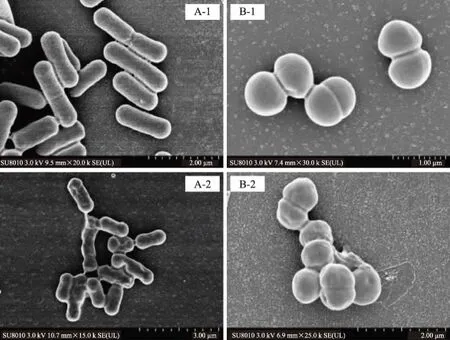
图2 热压结合处理前后绿色魏斯菌和肠膜明串珠菌扫描电镜图Fig.2 Scanning electron microscopy(SEM)examination of Weissella viridescensand Leuconostoc mesenteroides untreated and treated by HPTS注:A为绿色魏斯菌,B为肠膜明串珠菌;A-1和B-1为未处理样,A-2和B-2为处理样。
透射电镜图直观地反映了热压结合处理对绿色魏斯菌细胞和肠膜明串珠菌的超微结构变化。由图3可以看出,未处理的绿色魏斯菌呈短杆状,肠膜明串珠菌呈圆球状,细胞壁结构完整光滑,细胞内物质分布均匀。经热压结合处理后,细菌细胞有一定程度的变形,细胞内细胞质局部皱缩,出现团状聚集和透电子区[25](图中箭头标记区域即为透电子区),细胞内含物结构紊乱,胞浆蛋白凝固、核酸变性,但是细胞形态结构基本完整。从以上细菌细胞受损情况分析,热压结合处理引起的细胞内含物质变性凝固是导致微生物死亡的关键原因。

图3 热压结合处理前后绿色魏斯菌和肠膜明串珠菌的透射电镜图Fig.3 Transmission electron microscopy(TEM)examination of Weissella viridescensand Leuconostoc mesenteroides untreated and treated by HPTS 注:A为绿色魏斯菌,B为肠膜明串珠菌;A-1和B-1为未处理样,A-2和B-2为处理样。
扫描电镜和透射电镜结果表明,热压结合处理会对绿色魏斯菌和肠膜明串珠菌的细胞膜形态和内部微观结构都产生了影响。
2.4 热压结合处理对细胞生理状态的影响
图4中P1区域为SYTO9阳性对照,此区域代表细菌细胞膜完整,为活细胞所在区域;P2区域为PI阳性对照,此区域细菌细胞膜获得全透性,为死亡细胞所在区域;P3区域介于P1和P2区域之间,此区域细菌细胞膜处于完整和全透之间,可以认为是受损细胞所在区域,这部分细菌处于亚致死状态。根据图4流式细胞仪分析死亡、受损及完整细胞时发现,绿色魏斯菌热压结合处理后,94.3%细胞处于P1区域,受损细胞的比例达到5.0%,只有极少部分细胞细胞膜通透性略有提高,处于P3区域内。肠膜明串珠菌热压结合处理后,P3区域受损细胞的比例达到99.3%,P1和P2区域几乎没有,这表明热压结合处理后,肠膜明串珠菌的细胞膜通透性发生明显改变,但没有达到全透性。
近年来,流式细胞技术因其快速准确的单细胞分析能力,在微生物领域受到广泛关注。相对于传统方法的宏观测量,流式细胞术与各种荧光染料结合能更好地从微观角度了解细菌的单细胞状态,如检测细胞周期变化、细胞数量及其群体结构变化,其检测的标准主要是基于对于细胞膜完整性的反应,可区分反应过程中的细胞状态(活细胞、受损细胞和死亡细胞)[26-27]。流式细胞技术在染色步骤使用的染料是实现其各种功能的关键。本实验采用了SYTO9和PI复染来研究细胞生理状态。PI染料不能透过完整细胞膜,因此只会对细胞膜破损的细胞染色,而SYTO9染料可以对所有细胞染色,但当PI染料存在时会被减弱荧光强度,因此通过荧光强度的差别可以较清晰的区别细胞膜损伤程度,完整细胞的SYTO9通道荧光信号最强,而死亡的细胞PI通道荧光信号最强,荧光信号介于两者之间的可以定位为处于亚致死状态的细胞。
结果显示,绿色魏斯菌热压结合处理后,大部分细胞膜通透性与活细胞相同,与韩衍青的结果基本一致[4],这表明绿色魏斯菌的细胞膜通透性未发生明显改变,大部分仍与活细胞细胞膜通透性相同,只有极少部分通透性略有提高。肠膜明串珠菌热压结合处理后,细胞膜通透性发生明显改变,但没有达到全透性,细胞膜通透性处于受损细胞的区域内,即亚致死状态。两种菌在热压结合处理后细胞膜都未获得全透性,这可能是热压结合处理只能抑制细菌生长而不能完全将其杀死的一个重要原因。因流式细胞计数得到的细菌数量普遍高于普通平板计数方式[4],故此实验得到的活细胞比例高于平板计数,可能是有一部分处于亚致死状态的细菌细胞膜受损不严重,PI染料未能进行染色,但其虽暂时具有活性,却不可培养[28]。两种菌的流式细胞数据也能看出热压结合处理对肠膜明串珠菌的效果优于绿色魏斯菌,这种差异与平板计数得到的存活率结果相符,说明细胞膜通透性的改变与热压结合杀菌效果有直接关系。这些都说明这两种菌细胞膜的防护作用是其耐压耐热的主要原因。
2.5 热压结合处理对胞内核酸、蛋白质泄漏量的影响
表2可知,经热压结合处理的两种菌上清液中核酸(260 nm)、蛋白质(280 nm)两种物质的含量极显著增加(p<0.001),绿色魏斯菌热压结合处理后A260和A280分别增加了0.3952和0.1124,肠膜明串珠菌热压结合处理后A260和A280分别增加了0.2094和0.0972。说明热压结合处理会导致细胞膜通透性变大,使得一些蛋白质和核酸物质流出细胞外。

表2 热压结合处理前后绿色魏斯菌和肠膜明串珠菌的紫外吸收物质泄漏量Table 2 UV-absorbing substances leaking of Weissella viridescens and Leuconostoc mesenteroides untreated and treated by HPTS
由于核酸的组成中含有嘌呤、嘧啶碱基,蛋白质中酪氨酸和色氨酸残基的苯环,这些结构都具有共轭双键(—C—C=C—C=C—),所以在紫外光区有强烈的光吸收作用,核酸和蛋白质的最大吸收峰分别在260、280 nm附近。因此可通过测定260、280 nm处的紫外吸收强度来确定细胞内核酸和蛋白质物质的泄漏情况[29]。但是超高压和热处理都会对核酸造成变性,碱基暴露,使其在260 nm处吸光度增加[30],故两种菌在260 nm处的吸光度增加量不能定量比较,即不能比较两种菌核酸流失量的多少,只能定性地说热压结合处理造成两种菌的核酸流失。同时,这两种菌作为原核生物缺少核膜,所以重要的遗传物质和功能性蛋白的流失将极大影响其正常代谢。而有些受损情况较轻的细胞经过复苏恢复成正常细胞,这些细胞可能细胞膜破损情况较轻,只有少数质粒等核酸物质流失[31],并没有影响到细胞最根本的功能,只是失去了某些特性,而细胞膜受损情况较重的细胞因失去了大量与代谢、遗传相关的生物大分子,最终只能死亡。绿色魏斯菌细胞膜受到的损伤较小,细胞膜完整性基本保持,能更好地进行复苏,而肠膜明串珠菌的损伤较为严重,复苏需要更长的时间,甚至有的细胞不能复苏只能死亡。故细胞膜通透性改变导致的核酸蛋白的流失也是热压结合处理能灭菌的重要原因,但细胞膜通透性的改变才是最主要的因素。
3 结论
本文研究了热压结合处理对绿色魏斯菌和肠膜明串珠菌的抑制作用,结果发现,细胞形态结构的变化、细菌细胞膜通透性增大和核酸、蛋白质的流失是热压结合处理抑制耐压微生物的重要原因,其中细胞膜通透性的改变是主要原因。正因为细胞膜的耐热耐压特性,使得热压结合处理不能完全杀灭细菌,只能使其进入一种亚致死状态。热压结合处理可以有效地抑制耐压菌的活性,延缓两种耐压菌株的生长,但不能起到完全灭菌的效果,所以需要探究如何更有效地破坏这两种菌的细胞膜,寻求更优的灭菌条件及灭菌方式。
