樟芝In-situ萃取发酵高产Antrodin C和Antroquinonol
2019-03-28刘晓凤张尧王召初杜超邹灵洁刘豪栋禹朝蔚艾连中夏永军
刘晓凤,张尧,王召初,杜超,邹灵洁,刘豪栋,禹朝蔚,艾连中,夏永军
(上海理工大学 医疗器械与食品学院,上海食品微生物工程技术研究中心,上海,200093)
樟芝(Antrodiacamphorata)又称牛樟芝、牛樟菇、红樟菇等,属于真菌门、担子菌亚门、层菌纲、多孔菌科、台芝属。根据文献报道,樟芝含有泛醌类物质(ubiquinones)、多糖(polysaccharides)、三萜类物质(triterpenoids)、超氧化物歧化酶(superoxide dismutase)、腺苷(adenosine)、马来酸与琥珀酸衍生物(maleic acid and succinic acid derivatives)等70多种生理活性物质[1-5],具有抗肿瘤、抗炎、抗氧化、免疫调节、保肝及抑制血小板凝集等多种生物活性作用[6-10]。樟芝人工培养主要分为深层液态发酵和固态发酵,而子实体栽培由于培养周期太长,培养难度较大而难以推广。通过对樟芝不同人工培养方式的活性成分分析可知,樟芝固态发酵的活性成分种类和含量远高于液态发酵,樟芝固态发酵主要活性产物除了Antrodins类化合物之外,还有抗癌活性很好的泛醌类化合物[3,11-16],但固态发酵存在难以大规模培养的缺点。常规液态发酵可以在短时间内获得大量菌丝体以及Antrodins类化合物,但是其他活性产物的种类偏少,活性产物的量偏低,无法发挥出液态发酵大规模培养等优势。有许多学者对樟芝活性产物进行合成调控实验[17-18],主要是在发酵液中添加一些樟树的提取物或相近树种的提取物,考察对多糖以及三萜类化合物的诱导效果,而对樟芝菌丝体特有活性产物马来酸琥珀酸的衍生物和泛醌类化合物相关研究较少。
原位分离技术基于在发酵过程中,通过从培养介质中及时移走产物,达到减少产物抑制,从而提高原料的利用率和产品产率。对于连续发酵过程的实现具有重要意义。原位分离技术主要分为:溶剂萃取发酵法(油酸、叔胺等为萃取剂)、吸附法(离子交换树脂、活性炭、高分子树脂等)、膜法发酵(渗析、电渗析、中空纤维超滤膜、反渗透膜等)[19-20]。因此,本文拟建立樟芝高效的In-situ萃取发酵体系,用于提高樟芝液态发酵活性产物的产量和种类。
1 材料与方法
1.1 菌种
菌种樟芝S-29(A.camphorataS-29)为实验室分离获得,并保藏于中国普通微生物细菌保藏管理中心,编号为CGMCC 9590。樟芝S-29接种于PDA斜面,于4 ℃保藏。
1.2 培养基以及培养方法
孢子悬浮液制备:取茄子瓶斜面,用含有Tween 80 (0.1%,V/V)的无菌水25 mL洗下茄子瓶斜面的孢子,镜检孢子数达到1×108个/mL。
种子培养基:葡萄糖20 g/L,黄豆浆40 mL/L,柠檬酸0.5 g/L,MgSO4·7H2O 0.5 g/L,K2HPO40.5 g/L,pH 5.0,摇瓶装液量为100 mL/500 mL三角瓶,接种量为10%,150 r/min,28 ℃,培养4 d。
樟芝S-29发酵罐扩大培养:发酵罐装液量为4 L/7 L,接入种子液400 mL(10%),搅拌速率为150 r/min,通气量为1.5 vvm,发酵过程中发酵体积维持在4.4 L。
1.3 植物油添加时间的确定
在摇瓶In-situ萃取发酵条件下,发酵第4天添加质量浓度为0.2 g/L的辅酶Q0,在第3、4、5、6天分别添加体积分数为20%的植物油,第10 天结束发酵,确定富集Ac和Aq效果最佳的原位萃取剂的添加时间,并计算出Ac和Aq的释放率。释放率按公式(1)计算:

(1)
1.4 辅酶Q0添加量的确定
在摇瓶In-situ萃取发酵条件下,发酵第3天添加体积分数为20%的植物油,第4天分别添加质量浓度为0.1、0.2、0.3、0.4、0.5 g/L的辅酶Q0,第10天结束发酵,确定富集Ac和Aq效果最佳的辅酶Q0添加量。
1.5 樟芝S-29 7L发酵罐In-situ萃取发酵
在7 L发酵罐In-situ萃取发酵条件下,对照组:在发酵第4天,添加质量浓度0.3 g/L辅酶Q0;实验组:在发酵第3天添加20%植物油,发酵第4天,添加质量浓度0.3 g/L辅酶Q0。
1.6 植物油作为In-situ萃取剂的重复利用
樟芝In-situ萃取发酵结束后,静置,回收上层植物油;回收的植物油中加入9倍体积的95%乙醇萃取;萃取得到的油相于8 000 r/min,4 ℃离心10 min,将油相中的乙醇全部去除。经以上处理得到的油相在樟芝In-situ萃取发酵中被重复利用多次。
1.7 分析方法
1.7.1 生物量的测定
生物量的测定采用菌体干重法。将发酵液抽滤,并用去离子水洗涤3遍菌体,收集菌体,60 ℃烘干至恒重后称重。生物量按公式(1)计算:
教材的结构性是指教材内容展开要有层次,要符合学科知识的内在逻辑,知识点之间要密切联系.譬如,布鲁纳曾言,教学不是教知识,而是教知识的结构[12],美国数学委员会在其《呼唤变革:关于数学教师的数学修养的建议书》中特别提议未来所有的数学老师都要了解数学的来龙去脉的知识,并获得对数学中许多重要概念的更深入的理解[13].教材的结构体系不仅影响学生学到了什么知识,还对学生是否能够构建具有数学文化内涵的知识结构产生影响,这样的结构靠学习碎片化的知识是不可能完成的,必须建立在学习者对相关知识及其境脉的深刻理解的基础上,因此,编写教材时必须对知识的结构体系慎重把握[14].一般而
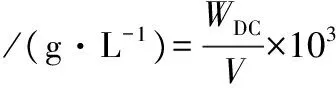
(2)
式中:WDC为菌体干质量,g;V为取样体积,mL。
1.7.2 液态发酵产物中乙醇萃取物的制备
液态发酵培养樟芝S-29 10 d后,量取发酵液30 mL,抽滤,收集菌丝体,加入95%乙醇,研磨,并用95%乙醇定容至30 mL,50 ℃水浴振荡萃取1 h,冷却至室温后,得到乙醇萃取物,再用0.22 μm滤膜微滤,4 ℃放置用于HPLC分析。
In-situ萃取发酵体系中,将发酵液静置,取1 mL油相,加入9倍体积的95%乙醇,50 ℃水浴振荡萃取1 h,冷却至室温后分液得到乙醇相,用0.22 μm滤膜微滤,4 ℃放置用于HPLC分析;菌丝体中活性成分制备方法同上。
1.7.3 樟芝S-29活性成分HPLC分析方法
HPLC分析条件如下:色谱柱为Sepax HP-C18色谱柱(4.6 mm×250 mm,5 μm),流速1 mL/min,紫外检测波长254 nm,进样量为20 μL。流动相A为pH值3.0的三氟乙酸水,流动相B为乙腈,采用梯度洗脱,洗脱梯度如下:0~4 min,流动相B:35%~57%;4~10 min,流动相B:57%~70%;10~15 min,流动相B:70%~90%;15~18 min,流动相B:90%~100%;18~28 min,流动相B:35%~100%。根据Ac和Aq的标准曲线分别计算其含量。In-situ萃取发酵体系中Ac或Aq总含量(mg/L)按公式(3)计算。
总含量/(mg·L-1)=菌体中的含量(mg/L)+
(3)
1.8 数据处理
采用统计软件IBM SPSS Statistics 24进行方差分析,实验所测数据以x±s表示。试验重复3次,取平均值。
2 结果与分析
2.1 植物油添加时间对樟芝S-29活性成分的影响
植物油添加时间对樟芝In-situ萃取发酵具有显著影响。植物油的主要成分为直链高级脂肪酸及其甘油酯,黏度较大,对樟芝活性成分合成有一定影响。如图1所示,添加质量浓度为0.2 g/L的辅酶Q0,发酵第3天添加植物油,樟芝S-29活性成分Ac和Aq总产量达到最大,分别为206.77 mg/L、86.36 mg/L,较辅酶Q0诱导发酵组分别提高了170.7%和539.1%。随着添加时间的延后,2种活性产物的产量逐渐下降;当第6天添加时,Ac和Aq总产量仅有120.23 mg/L、37.05 mg/L。然而,植物油添加时间对活性成分的释放率没有显著影响,2种成分的释放率均在80%以上。根据文献报道[17],萃取剂的添加时间会对樟芝的菌丝体产生一定影响,添加过早或过晚都不利于活性产物的合成。KEVIN等[21]发现,辅酶Q衍生物易受与辅酶Q合成相关的前体物质(4-羟基苯甲酸和油酸)的诱导,油酸可以作为樟芝泛醌类组分的前体物,从而提高其活性成分含量,因此,在发酵早期添加植物油,其中的油酸能够提高Aq的产量。

KB-常规液态发酵;FM-辅酶Q0诱导发酵图1 植物油添加时间对樟芝S-29活性成分的影响Fig.1 Effect of adding time of vegetable oil on the active components of A. camphorataS-29
2.2 辅酶Q0添加量对樟芝S-29活性成分的影响
辅酶Q0的添加量对Aq的合成具有显著的影响,它可作为樟芝泛醌类组分的前体物,通过聚酮体等途径,促进樟芝活性物质Aq的合成[17]。如图2所示,当添加0.1~0.3 g/L辅酶Q0,随着辅酶Q0添加量的进一步增加,Aq的产量不断增加,当辅酶Q0的添加量为0.3 g/L时Aq产量最大,为111.31 mg/L。但樟芝S-29的菌体量随着辅酶Q0添加量的增加而逐渐减小,说明辅酶Q0会抑制菌丝体的生长。因此高浓度的辅酶Q0不利于Aq合成,图3为不同发酵体系下,樟芝发酵第10天菌丝球照片。由图3可知,辅酶Q0的添加量对樟芝S-29菌丝球形态、颜色等具有显著性影响。如图3-a所示,在常规液态发酵体系中,樟芝S-29菌丝球圆润、形状规则,菌丝球颜色呈现均一的淡黄色。如图3-b所示,辅酶Q0诱导发酵体系中,樟芝S-29菌丝球形状不规则,体积明显小于常规液态发酵组,主要表现为单个菌丝球的平均直径减小,菌丝球颜色呈现非均一的黄褐色,表明辅酶Q0可以影响樟芝S-29菌体形态。如图3-c所示,以植物油为萃取剂的In-situ萃取发酵体系中,樟芝S-29菌丝球体积恢复到常规液态发酵状态,樟芝S-29菌丝球圆润、形状规则,菌丝球颜色呈现均一的乳白色,说明植物油作为原位萃取剂,对辅酶Q0的生长抑制作用起到了一定缓解作用。研究表明[22-25],辅酶Q0对樟芝代谢合成Aq的调控是一个复杂的过程,菌体量与活性物质的产量呈正相关性。植物油缓解了辅酶Q0生长抑制作用,菌丝体恢复正常生长状态,增加了Aq的产量。但植物油对辅酶Q0生长抑制的缓解作用有一定限度,因此较高浓度的辅酶Q0对Aq的合成起到抑制作用。
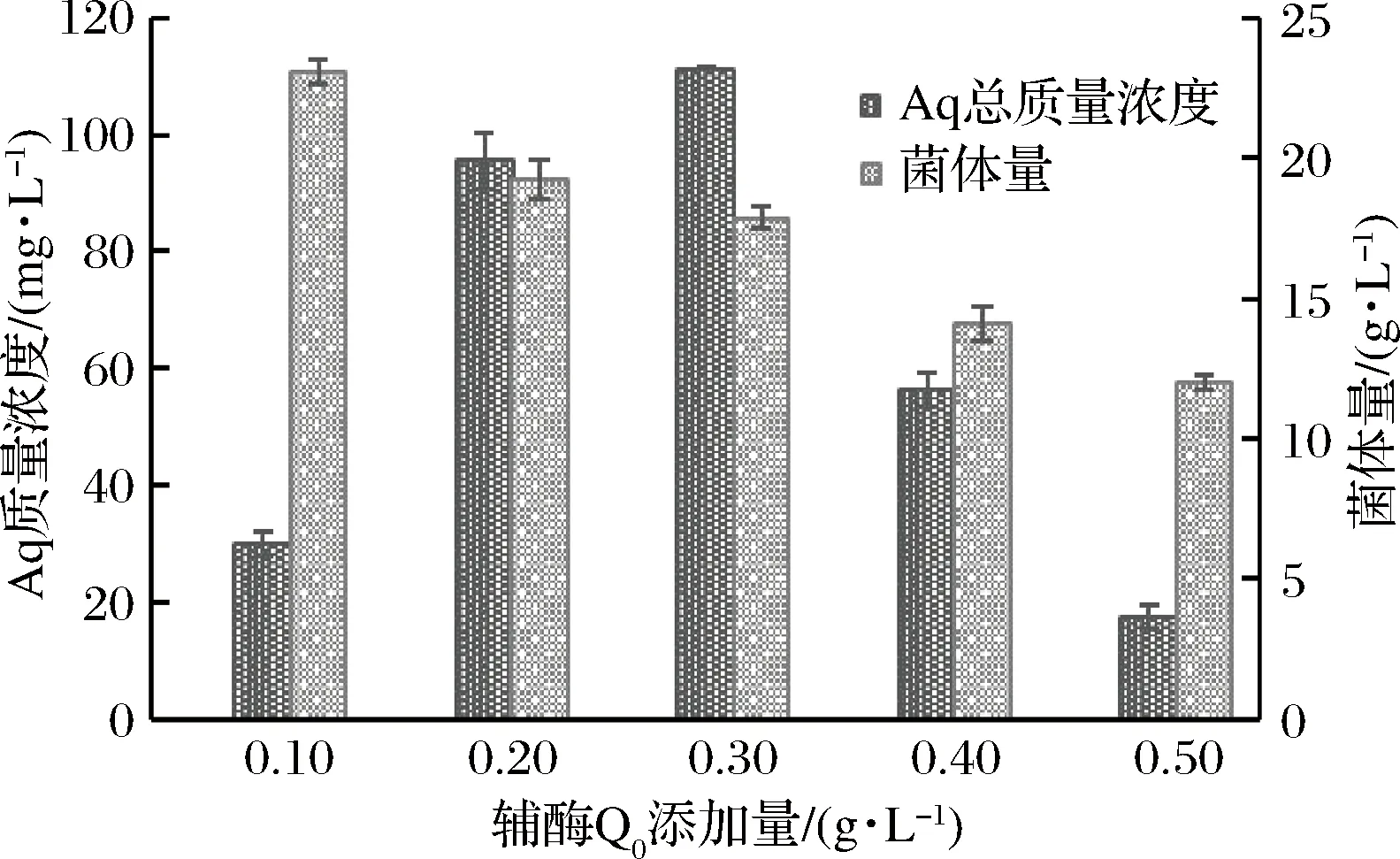
图2 辅酶Q0添加量对樟芝S-29 Aq的影响Fig.2 Effect of the concentration of CoQ0 on Aq ofA. camphorata S-29

a-常规液态发酵;b-辅酶Q0诱导发酵;c-In-situ萃取发酵图3 不同体系中樟芝S-29菌丝体生长情况Fig.3 Growth of mycelium in different systems
2.3 植物油萃取发酵过程曲线分析
将摇瓶实验条件下建立的辅酶Q0诱导In-situ萃取发酵实验,于7 L发酵罐上进行扩大培养。7 L发酵罐In-situ萃取发酵产Ac和Aq的过程曲线图,如图4所示。发酵前4 d菌体处于生长的对数期,菌体量迅速增加,耗氧增加,溶氧值(dissolved oxygen, DO)迅速降为16%,第4天添加辅酶Q0后,对照组(辅酶Q0组)和实验组(In-situ萃取发酵组)的DO都有一定回升。植物油在In-situ萃取发酵体系中可以作为良好的氧载体,因此实验组的DO值远高于对照组。樟芝为好氧菌,菌丝体的生长与氧含量呈正相关性,植物油的添加使整个发酵系统中氧含量大大增加,此外植物油缓解了辅酶Q0的生长抑制作用,菌丝体恢复正常生长状态,因此实验组第5~10天菌丝体快速生长,菌体量大幅增加,而对照组从第6天开始,樟芝S-29处于30%左右的溶氧环境,菌丝体生长缓慢,菌体量增加速率远低于实验组。第 13 天以后由于樟芝S-29进入衰亡期,使得菌体量大幅度降低。

A-DO和菌体量;B-Ac和Aq质量浓度图4 樟芝S-29 In-situ萃取发酵过程曲线Fig.4 In-situ removal fermentation’s process curve ofA. camphorata S-29
樟芝发酵产Ac和Aq是一个耗氧的过程,Ac和Aq的产量与DO值呈一定的相关性。如图4所示,实验组随着DO值增加,Ac和Aq的合成速率迅速增加。Ac在发酵第17 天达到最大值486.01 mg/L,比对照组提高272.1%,此外,植物油对Ac起到一定保护作用,与实验组相比,对照组发酵21 d Ac量呈现下降趋势,大量Ac被降解。在第96小时添加0.3 g/L辅酶Q0和20%植物油对菌体合成Aq具有显著效果,添加辅酶Q024 h后样品中有3.69 mg/L Aq检出,随着菌体量大幅度增加,Aq的累积速度也随之加快;当菌体不再增加时,Aq仍保持较快的积累速度,发酵第14天Aq产量达到最高110.06 mg/L。与实验组相比,对照组在添加辅酶Q0后第2天菌体已经处于稳定期状态,菌体量几乎不再增加,在添加辅酶Q0后第4天,Aq的产量接近最大值37.5 mg/L,远低于In-situ萃取发酵体系Aq的量。
2.4 植物油In-situ萃取发酵产物HPLC分析
在In-situ萃取发酵体系中,植物油以乳浊液的形式均匀地分散于水相中,使得氧穿过水边界层的渗透力增强,从而有利于氧传递的进行[26-28],以此提高活性产物的浓度。图5为不同发酵体系下,樟芝发酵第10天样品的HPLC图。如图5-A所示,在常规液态发酵体系过程中,樟芝S-29菌丝体主要含有Antrodins类化合物,以Ac为主,但不能合成Aq等化合物。如图5-B、5-C和5-E所示,在辅酶Q0诱导发酵基础上,添加植物油进行In-situ萃取发酵,能够显著提高樟芝S-29菌丝体活性成分种类和产量,除了诱导Aq大量合成之外,还增加了Ac的产量。由图5-D可知,樟芝S-29产生的大多数活性物质不溶于水,添加植物油进行In-situ萃取发酵,樟芝S-29产生的活性物质不断被富集、萃取转移到油相。

a-常规液态发酵菌体HPLC图谱;b-辅酶Q0诱导单相体系发酵菌体HPLC图谱;c-樟芝In-situ萃取发酵体系中菌体HPLC图谱;d-樟芝In-situ萃取发酵体系中发酵液HPLC图谱;e-樟芝In-situ萃取发酵体系中油相HPLC图谱(稀释10倍);1-Ac;2-Aq图5 樟芝S-29液态发酵代表性样品的HPLC图谱Fig.5 HPLC chromatogram of representative samples ofA. camphorata S-29 by submerged fermentation
在In-situ萃取发酵体系中,樟芝S-29活性产物不断地被植物油从细胞内萃取出来,从而减小胞内代谢产物的积累压力,因此大幅度提高活性产物产量。此外,丝状真菌在发酵过程中,菌丝体缠绕成小球或椭球状,表现黏度大,好氧速率高,溶氧水平快速降低到微生物的临界溶氧浓度下,对微生物的正常生长和发酵产生影响[29]。植物油作为良好的氧载体,可以增加氧气的溶解度,强化氧传递,促进菌体本身生长,从而促进菌体合成活性代谢产物。
2.5 植物油作为In-situ萃取剂重复利用的研究
樟芝In-situ萃取发酵结束后回收的植物油,经95%乙醇萃取,高速离心等处理后得到的油相,在樟芝In-situ萃取发酵中被重复利用多次,结果如图6所示。新鲜植物油作为原位萃取剂,Ac和Aq的产量分别为209.2 mg/L和109.6 mg/L;重复利用4次的植物油作为原位萃取剂,Ac和Aq的产量分别为188.5 mg/L和91.8 mg/L,因此重复利用4次的植物油对目标物Ac和Aq产物的富集能力与新鲜植物油相比没有显著性差异,说明植物油作为原位萃取剂可以被重复利用。经简单的回收工艺的植物油,在其有限次重复使用的实验中发现重复利用的植物油在发酵过程中对Ac和Aq的萃取富集能力相对比较稳定,并未因其重复使用次数的增加而显著下降,这些结果也能表明植物油作为原位萃取剂,可以进行重复利用。

图6 植物油作为In-situ萃取剂重复利用Fig.6 Recycling of vegetable oil as In-situ extractant
3 结论
针对樟芝液态发酵生产Ac和Aq产量低的问题,且基于Ac和Aq难溶于发酵液,建立1种In-situ萃取的发酵体系。发酵优化后最佳结果是于发酵第4天与第3天,分别添加 3% 辅酶Q0(V/V) 与 20% (V/V) 植物油,待发酵结束后,Ac总含量为486.01 mg/L较对照组提高272.1%。Aq产量为 110.06 mg/L较对照组提高了293.5%。大大缓解了樟芝液态发酵过程存在的Ac和Aq等产物抑制的不利影响,且该体系稳定性良好。实验过程中发现,作为原位萃取剂使用的植物油,其回收工艺简单,且回收率达到 90%以上,回收的植物油作为原位萃取剂重复使用,对Ac和Aq的萃取富集能力相对比较稳定,能够进行有限次的重复使用。
