雷公藤甲素减轻弥漫性轴索损伤的作用及机制
2019-03-28王松林李从进李东波宋锦宁
王松林,李从进,2,金 涛,李东波,杨 涛,宋锦宁
(1陕西省安康市中心医院神经外科,安康 725000;2西安交通大学第一附属医院神经外科;*通讯作者,E-mail:jinningsong@126.com)
弥漫性轴索损伤(diffuse axonal injury,DAI)是颅脑外伤进程中一个重要的病理改变,DAI是导致脑外伤患者高死亡率的主要原因,也是导致脑外伤患者伤后植物生存或严重神经功能障碍的重要原因之一,目前尚无有效的治疗手段。脑组织在受伤的瞬间所遭受的剪切应力可拉伸颅内长束状的结构,这种类型损伤称为原发性损伤。目前的研究证明,原发性损伤只能导致极少数量的轴索结构发生改变,更多的轴索损伤是在氧化应激、兴奋毒性、炎症等多种因素的作用下出现的,称为继发性轴索损伤。炎症反应是导致轴索继发性损伤的重要机制之一,在轴索损伤灶的周围有炎性因子聚集,并且在实验动物脑损伤后给予抗炎或免疫抑制治疗,能有效缓解轴索损伤[1]。因此,以炎症反应为靶点治疗DAI后的继发性轴索损伤受到广泛关注。
雷公藤甲素(triptolide,TP)是雷公藤的根、叶、花及果实中提取的一种环氧二萜内酯化合物,经临床和药理实验证明,其具有免疫抑制、抗炎、抗生育及抗肿瘤等生物活性。既往研究表明,雷公藤甲素可以通过免疫抑制、抗炎等机制对多种中枢神经系统疾病有保护作用,例如:脑缺血损伤[2,3]、脑外伤(皮层撞击模型)[4]、慢性疼痛[5]、神经退行性病变[6,7]、胶质瘤[8]等。而雷公藤甲素能否对DAI发挥抗炎作用,进而减轻继发性轴索损伤仍需进一步研究。
因此,本研究通过建立大鼠DAI模型,并给予雷公藤甲素,观察大鼠皮层轴索损伤标志物神经微丝蛋白(neurofilament triplet L,NF-L)及微管相关蛋白tau、胶质细胞活化标志物(GFAP、Iba-1)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、细胞凋亡、MAPK磷酸化水平及NF-κB的表达变化,探讨雷公藤甲素对轴索损伤的保护作用及其潜在机制。
1 材料与方法
1.1 主要试剂
小鼠SP免疫组化试剂盒(北京中杉金桥生物技术公司)、兔SP免疫组化试剂盒(北京中杉金桥生物技术公司),TUNEL检测试剂盒(美国Promega公司),雷公藤甲素(美国sigma公司),p38 MAPK抗体(美国Cell Signaling Technology公司),Phospho-p38 MAPK抗体(P-p38 MAPK,Thr180/Tyr182,美国Cell Signaling Technology公司),NF-κB抗体(美国Cell Signaling Technology公司),TNF-α抗体(美国GeneTex公司),Iba-1抗体(日本Sako公司),GFAP抗体(美国Cell Signaling Technology公司)。
1.2 实验动物与分组
36只遗传背景相同的SPF级雄性10周龄SD大鼠,体质量250-280 g,购自西安交通大学医学部动物中心,许可证号SCXK(陕)08-018。造模前后均饲养于22 ℃的环境,自由采食与饮水。所有大鼠随机分为对照组,DAI 3 d组,DAI 3 d+TP组,每组12只。本实验动物伦理经西安交通大学医学部生物伦理委员会批准(2017-0122)。
1.3 DAI模型制作
所有大鼠术前常规禁食水6 h,用100 g/L的水合氯醛(4 ml/kg)腹腔注射麻醉。将DAI 3 d组及DAI 3 d+TP组大鼠头颅固定于瞬间旋转损伤装置上,待大鼠将要清醒时,启动装置,致大鼠头颅瞬间旋转90°并立即停止[9]。对照组只需麻醉、固定完毕后即从装置上卸下。DAI 3 d组大鼠造模后不做处理,DAI 3 d+TP组大鼠在造模后5 min内腹腔注射TP(0.2 mg/kg)[10],间隔24 h,连续3 d给药。
1.4 脑组织病理学观察
DAI后第3天,麻醉大鼠,用生理盐水及40 g/L的多聚甲醛经心脏灌注后开颅取脑,并继续固定脑组织48 h。石蜡包埋组织,切片厚5 μm,常规二甲苯脱蜡,梯度乙醇水化,按标准步骤对切片行HE染色。
1.5 免疫组化检测TNF-α、Iba-1及GFAP的表达
切片经二甲苯脱蜡,梯度乙醇水化;采用高压进行抗原修复,待高压气阀旋转2 min后终止,修复液自然冷却至室温;3%过氧化氢室温孵育15 min、山羊血清封闭室温40 min;滴加一抗TNF-α(1 ∶500)、Iba-1(1 ∶400)及GFAP(1 ∶300);4 ℃过夜;PBS洗去一抗,滴加相应二抗,室温孵育30 min;PBS洗去多余二抗,滴加辣根过氧化物酶,室温孵育30 min;DAB显色,自来水冲洗干净;苏木素复染2 min;经梯度乙醇脱水、二甲苯透明后,中性树胶封片,显微镜检。每张切片随机选5个视野用Image-Pro Plus软件分析测定免疫组化图像的阳性细胞数。
1.6 TUNEL法检测细胞凋亡
切片经二甲苯脱蜡、梯度乙醇水化后,用0.2%的Triton X-100室温孵育5 min、平衡缓冲液中孵育10 min,然后用TdT 37 ℃孵育60 min,PBS浸洗,终止反应,DAPI染核,采用荧光显微镜观察凋亡细胞(绿色荧光),每张切片随机选取5个视野统计凋亡细胞数。
1.7 Western blot检测p38 MAPK、Phospho-p38 MAPK及NF-κB的表达
DAI后3 d,每组取6只大鼠水合氯醛麻醉,经心尖灌注生理盐水后取皮层组织,加入裂解液完全匀浆后离心取上清,加入loading buffer,加热使蛋白变性。常规电泳、转膜、封闭1 h,加入p38 MAPK抗体、Phospho-p38 MAPK、NF-κB抗体、β-actin(均1 ∶1 000)一抗稀释液,4 ℃过夜,加入二抗,TBST洗膜,滴加化学发光试剂(ECL)显影液,Image J软件对结果进行灰度分析。
1.8 统计学分析
2 结果
2.1 TP对DAI后继发性轴索损伤的保护作用
各组大鼠脑皮层病理学显示:对照组皮层神经细胞形态结构正常,核圆,呈蓝色,胞质淡红;DAI 3 d组大鼠脑皮层的部分细胞核发生变形、固缩,并且深染,部分神经元肿胀,轴索扭曲,收缩变性;而DAI 3 d+TP组大鼠脑皮层内肿胀、扭曲的神经元数量明显减少,病理损伤减轻(见图1A)。与对照组相比,DAI 3 d组大鼠脑皮层内轴索损伤标志物tau的表达明显减少,同时NF-L的表达升高,提示皮层内存在明显的轴索损伤;而DAI 3 d+TP组大鼠脑皮层内tau的丢失明显减少,NF-L的表达降低,差异有统计学意义(P<0.05,见图1B,C),提示TP可以减轻DAI后的继发性轴索损伤。
2.2 TP抑制DAI后的细胞凋亡
为了阐明TP干预后对大鼠皮层细胞凋亡的影响,利用TUNEL法检测凋亡细胞(绿色),并利用DAPI染核(蓝色),TUNEL与DAPI同时阳性的细胞定义为凋亡细胞,结果见图2。对照组、DAI 3 d组及DAI 3 d+TP组大鼠脑皮层内凋亡细胞数分别为2.15± 1.87,34.75± 7.37,22.55± 6.04,组间两两比较差异均具有统计学意义(P<0.05)。

与对照组相比,*P<0.05;与DAI 3 d组相比,#P<0.05图1 各组大鼠皮层的病理改变及Tau及NF-L的表达变化 (bar=50 μm)Figure 1 Pathological changes and expression of Tau and NF-L in cortex of each group (bar=50 μm)
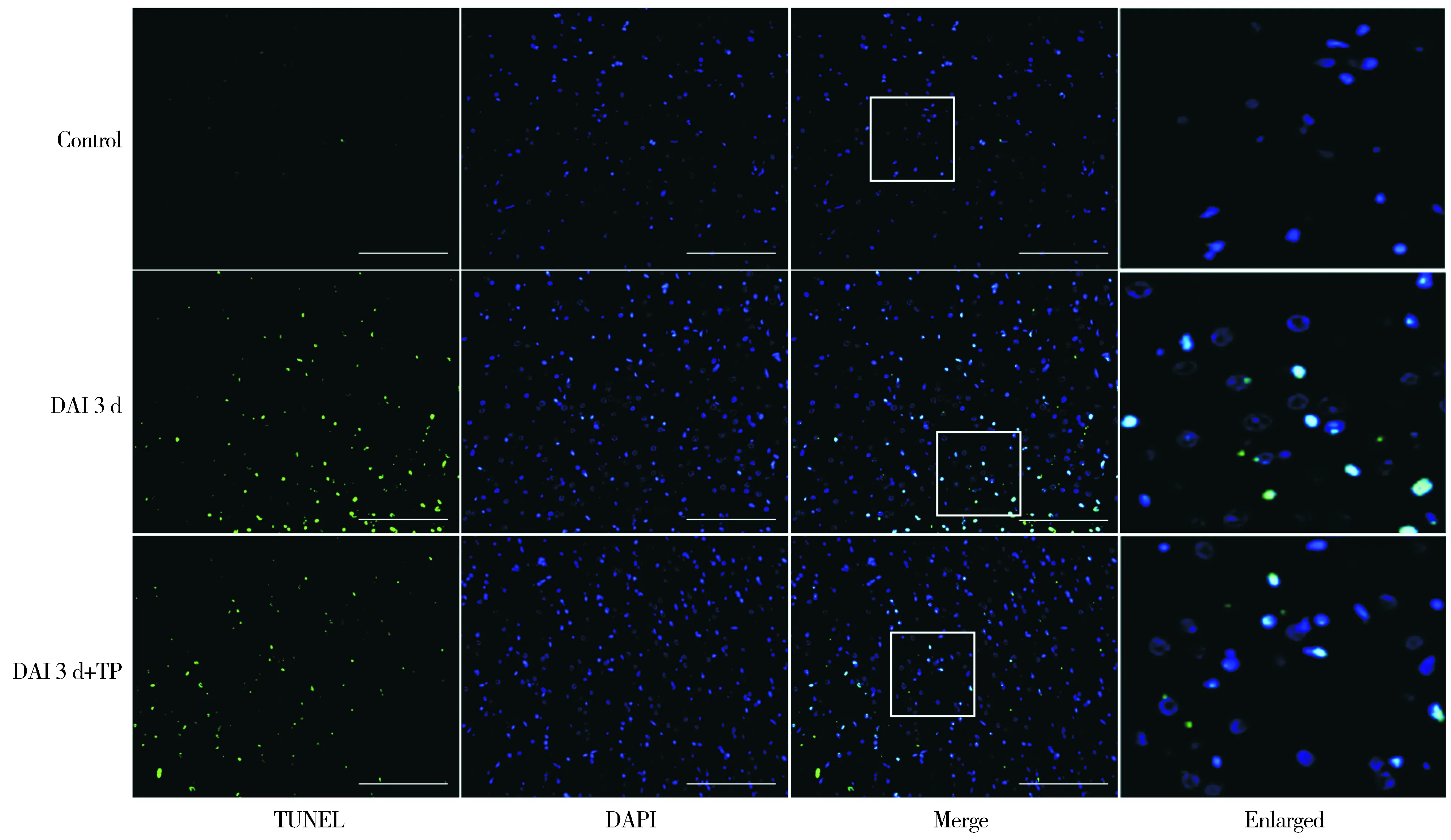
图2 各组大鼠皮层凋亡细胞数的变化 (scale bar=100 μm)Figure 2 The counts of TUNEL-positive cells in cortex of each group (scale bar=100 μm)
2.3 TP抑制DAI后的胶质反应及促炎因子TNF-α的释放
与对照组相比,DAI 3 d组皮层内星型胶质细胞标志物GFAP、小胶质细胞标志物Iba-1及促炎因子TNF-α的表达均明显升高,提示DAI后伴随着胶质反应及促炎因子TNF-α的产生和释放。与DAI 3 d组相比,DAI 3 d+TP组的皮层内GFAP、Iba-1及TNF-α的表达均显著减少,差异有统计学意义(P<0.05,见图3),提示TP可以减轻DAI后的星型胶质细胞增生、小胶质细胞活化,并抑制促炎因子的产生。
2.4 TP对NF-κB及MAPK信号通路的调控
为了阐明TP对DAI大鼠神经保护作用的机制,利用Western blot检测各组NF-κB的表达及p38 MAPK的磷酸化水平,结果提示,与对照组相比,DAI后3 d组NF-κB的表达及p38 MAPK的磷酸化水平明显升高,而DAI 3 d+TP组NF-κB的表达及p38 MAPK的磷酸化水平均有明显下降,差异有统计学意义(P<0.05,见图4)。提示TP对DAI的保护作用可能与抑制NF-κB及p38 MAPK信号通路有关。
3 讨论
DAI是脑外伤后常见的病理改变,DAI后的继发性轴索损伤与多种机制有关,如氧化应激、钙超载等,其中炎症反应也参与继发性轴索损伤的过程,因此抑制DAI后的炎症反应成为治疗DAI的新策略。本研究采用瞬间旋转损伤装置制作大鼠DAI模型,大鼠DAI后,大脑皮层中有明显细胞水肿、核固缩等病理改变,并且促炎因子及轴索损伤标志物NF-L升高,tau的表达量减少,并伴随有胶质细胞的活化,与既往报道DAI病理生理改变一致,提示本装置可有效地模拟临床DAI。
DAI有多种标志物,NF-L、tau及胶质细胞活化均可以反映DAI动物模型轴索损伤的程度。本研究中,连续3 d给予DAI大鼠雷公藤甲素,可减少NF-L的表达,减轻微管相关蛋白tau的丢失,并抑制小胶质细胞及星型胶质细胞的活化,提示雷公藤甲素能减轻大鼠DAI,而既往研究也证实雷公藤甲素对多种中枢神经系统疾病有保护作用,如:雷公藤甲素可以减少大鼠脑梗死的体积和脑含水量,改善神经功能缺损,抑制凋亡相关蛋白的表达[2]。体外模型中,雷公藤甲素可以减轻氧糖剥夺导致的细胞毒性和凋亡[3]。在皮层撞击所致的脑外伤模型中,>雷公藤甲素可以减轻脑外伤导致的脑水肿、降低脑挫伤灶的体积、细胞凋亡和多种炎性因子的水平,并改善神经行为学[4]。持续给予TP可以改善APP/PS1小鼠的认知功能,降低Aβ的沉积,减轻树突棘的退化、炎症反应和胶质反应[6,11,12]。TP还可以通过抑制星型胶质细胞的激活,减轻炎症反应和神经性病理痛,改善痛觉过敏及运动功能障碍[13,14]。
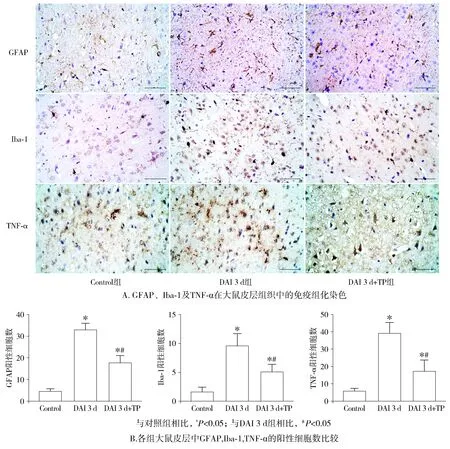
图3 各组大鼠皮层GFAP、Iba-1和TNF-α的表达变化 (scale bar=100 μm)Figure 3 The expression of GFAP, Iba-1 and TNF-α in cortex of each group (scale bar=100 μm)

与对照组相比,*P<0.05;与DAI 3 d组相比,#P<0.05图4 各组大鼠皮层NF-κB的表达及p38 MAPK磷酸化水平的变化Figure 4 The expression of NF-κB and phosphorylation-level of p38 MAPK in cortex of each group
本研究中,雷公藤甲素能减少TNF-α的产生及NF-κB的表达,并抑制MAPK磷酸化的水平,而其对大鼠DAI的保护作用可能与其抑制炎性因子TNF-α的产生及释放有关。TNF-α是重要的促炎因子,可刺激免疫细胞如NK细胞和巨噬细胞/单核细胞,促进炎症因子的分泌,并通过结合其受体调节细胞凋亡;TNF-α也能直接诱导原发性脱髓鞘反应和少突胶质细胞凋亡,提示TNF-α参与DAI后的病理过程,而抑制TNF-α的产生和释放可对脑外伤起一定的保护作用[15,16]。TNF-α相关的信号传导通路主要包括caspase家族介导的细胞凋亡、转录因子NF-κB和MAPK蛋白激酶的活化。既往研究已经证实雷公藤甲素可以抑制NF-κB活性及MAPK的磷酸化,减少TNF-α的产生,对脑卒中和神经性病理痛起到保护和缓解作用[11,17]。而本研究中,雷公藤甲素也能减少NF-κB的表达,并抑制MAPK磷酸化,提示雷公藤甲素对TNF-α的抑制作用可能与该信号通路有关。除了作用于NF-κB和MAPK途径,雷公藤甲素还可以调控多种信号通路,例如雷公藤甲素可以抑制脊髓胶质细胞内JAK-STAT3通路,进而抑制胶质细胞的激活;其也可以抑制小胶质细胞内的EP2-PKA通路,抑制小胶质细胞释放一氧化氮[14,18]。
综上,雷公藤甲素可以通过抑制NF-κB和MAPK信号通路,减少TNF-α的产生及释放,并抑制小胶质细胞和星型胶质细胞的活化,减轻大鼠DAI后的继发性轴索损伤。然而雷公藤甲素具有多种药理作用,其对DAI的保护作用仍有待进一步研究。
