胃黏膜活检少见病变12例临床病理分析
2019-03-28刘玉艳单景军
刘玉艳 董 丽 单景军 蒋 萍 黄 英#
哈尔滨市第一医院病理科1(150001) 哈尔滨市第二医院病理科2
背景:一些胃部少见病变的临床表现缺乏特异性,患者常因漏诊或误诊错过最佳治疗时机。目的:探讨一些胃部少见病变的临床病理特征和免疫组化标志物在其诊断和鉴别诊断中的应用。方法:从哈尔滨市第一医院2017年的胃镜活检标本中筛选出病理证实的少见、易误诊病变12例,对其临床病理特征、免疫组化染色进行回顾性分析。结果:纳入分析的病例包括胃原发性鳞状细胞癌1例,转移性癌8例(乳腺来源2例,肾脏来源3例,肺来源2例,肝脏来源1例),胃原发性神经内分泌肿瘤2例,胃巨细胞病毒(CMV)感染1例,各病例均有其独特的组织形态学表现和较特异的免疫组化标志物。结论:胃镜活检取材有限,熟悉一些少见病变的组织形态学特点和免疫组化标志物,可避免误诊、误治。
Immunohistochemistry
2014年全球癌症统计报告显示,我国胃癌新发和死亡病例数均居世界首位,全球近50%的新发胃癌病例来自中国[1]。在临床实践中,除原发性胃腺癌外,也可见到一些其他部位常见而胃部罕见的恶性肿瘤病例或转移性癌病例。对这些少见病变进行深入研究,探究其病因、发病机制以及临床和组织病理学特征,对于提高相关疾病的诊治水平具有重要意义。本研究回顾性分析12例胃黏膜活检少见病变,结合文献探讨其临床病理特征、免疫组化标志物以及诊断和鉴别诊断要点,以期提高对相关疾病的认识及其诊断和治疗水平。
对象与方法
一、病例来源
从哈尔滨市第一医院病理科2017年1月—2017年12月存档胃镜活检标本中筛选出病理证实的少见、易误诊病变12例,其中女性7例,男性5例,年龄26~76岁,中位年龄51岁。最终诊断分别为:胃原发性鳞状细胞癌1例,转移性癌8例,胃原发性神经内分泌肿瘤2例,胃巨细胞病毒(CMV)感染1例。
二、病理学检查
复习12例病例的存档切片,部分病例取蜡块重新做HE染色和相关标志物免疫组化染色。免疫组化标记采用EnVision法,检测所用抗体TTF-1、SP-B、Napsin-A、磷脂酰肌醇聚糖-3(glypican-3)、肝细胞石蜡抗原-1(HepPar-1)、精氨酸酶-1(Arg-1)、CD10、肾细胞癌标记(RCC)、碳酸酐酶Ⅸ(CAⅨ)、巨囊性病液体蛋白-15(GCDFP-15)、乳腺珠蛋白(mammaglobin)、GATA-3、CK5/6、p40、34βE12、p63、CK7、CK20等为福州迈新生物技术开发有限公司产品,CMV抗体、免疫组化EnVision检测试剂盒、DAB显色试剂盒为Dako公司产品。操作步骤严格按照产品说明书进行。
结 果
12例胃黏膜活检少见病变的临床病理特征见表1。1例胃原发性鳞状细胞癌(图1),免疫组化标记CK5/6(图2)、p40、34βE12、p63阳性。8例转移性癌病例以女性居多,见于胃体、胃底部,其中乳腺来源2例(图3),肾脏来源3例,肺来源2例,肝脏来源1例;乳腺来源的转移性癌GATA-3、GCDFP-15(图4)、乳腺珠蛋白、CK7阳性。2例胃原发性神经内分泌肿瘤均为小细胞癌,分别位于胃体上部和幽门部。1例胃CMV感染病例感染细胞明显增大(图5),CMV为均匀深染的棕褐色细胞核和细胞质着色(图6),个别细胞呈微弱细胞核着色。
讨 论
在胃恶性肿瘤中,胃腺癌约占95%,鳞状细胞癌和转移性癌临床上较为罕见。这些非常见型胃癌的临床表现缺乏特异性,患者常因漏诊或误诊错过最佳治疗时机。事实上,这些少见病变的胃镜活检标本在组织病理学检查中均有其独特的组织形态学表现和较特异的免疫组化标志物。本研究通过回顾性分析12例胃黏膜活检少见病变(包括非常见型胃癌和特殊感染),探讨其临床病理特征和免疫组化标志物在诊断和鉴别诊断中的应用。
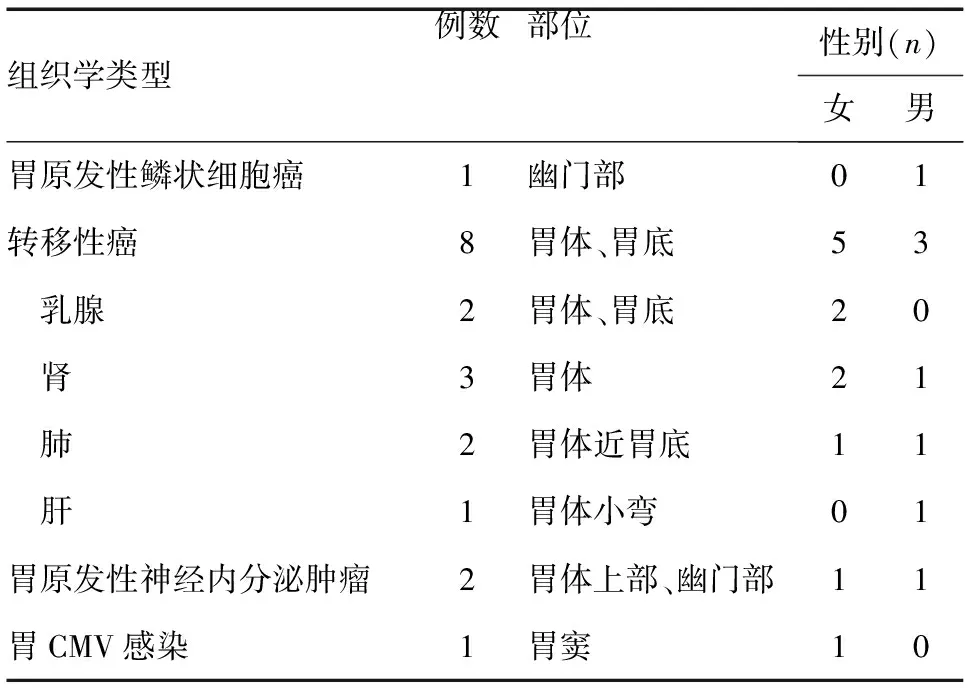
表1 12例胃黏膜活检少见病变临床病理特征

图1 黏膜固有层见鳞状细胞癌巢(HE染色,×200)
图2 鳞状细胞癌CK5/6表达阳性(免疫组化染色,×200)

图3 黏膜固有层肿瘤细胞印戒样(HE染色,×100)
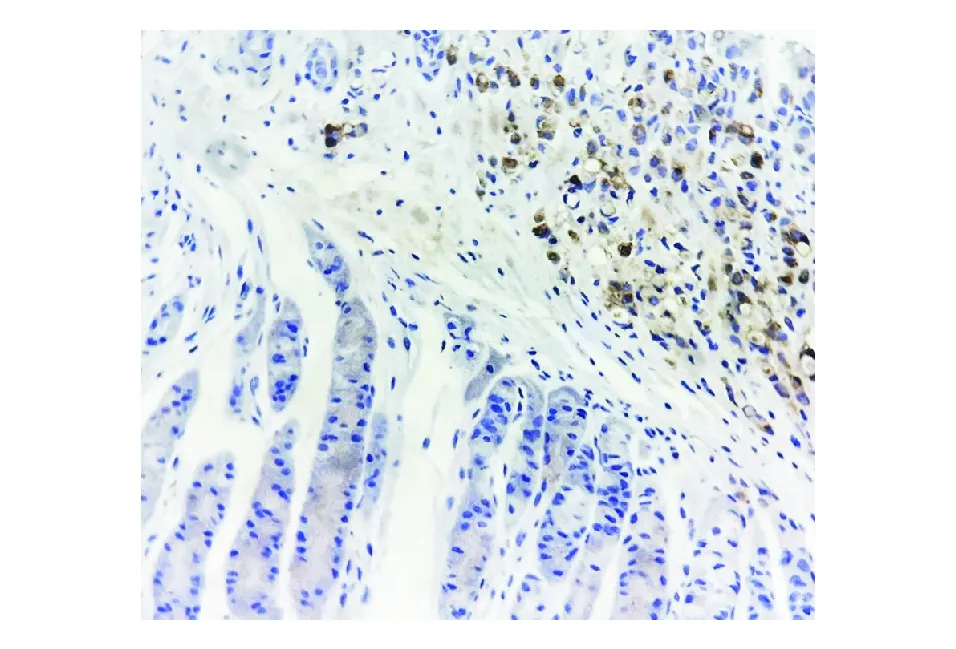
图4 肿瘤细胞GCDFP-15表达阳性(免疫组化染色,×200)
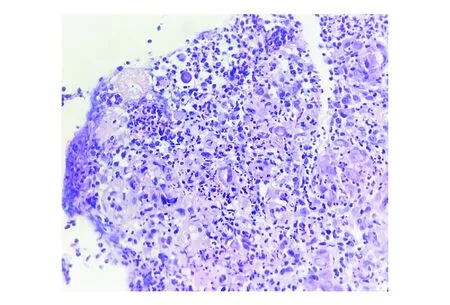
图5 黏膜肉芽组织背景中可见大细胞(HE染色,×100)

图6 大细胞胞质和胞核CMV阳性(免疫组化染色,×400)
胃原发性鳞状细胞癌首次报道是在1895年,该型胃癌极为罕见,在所有胃癌中仅占0.04%~0.07%,多见于60岁左右的男性[2]。其病因尚未明确,多与腐蚀性损伤、梅毒性革囊胃、长期应用环磷酰胺、皮肌炎、残胃、Ménétrier病等引起的鳞状上皮化生灶有关[3]。关于胃鳞状细胞癌起源的理论主要包括[2]:①胃黏膜异位鳞状上皮巢;②恶性转化前胃黏膜的鳞状上皮化生;③胃黏膜中的多能干细胞(可能性较小);④原发性胃腺癌中的鳞状上皮细胞;⑤胃血管内皮细胞。胃鳞状细胞癌侵袭性高,浸润性生长,多存在淋巴管浸润,发现时多数患者病变已处于进展期,常发生肝转移和腹膜转移,预后差,平均生存期仅数月[4]。本研究报道的1例胃原发性鳞状细胞癌患者为68岁男性,胃镜下发现幽门部溃疡性病变,活检病理检查见黏膜固有层高中分化鳞状细胞癌巢弥漫浸润,行根治性远端胃大部切除术,术后随访1年仍存活。
国外文献报道中,消化道外组织器官恶性肿瘤的非浸润性胃转移,以原发性恶性黑色素瘤和乳腺癌来源相对多见[5]。判断是否为转移性胃癌对临床治疗方案的选择和患者预后起决定性作用。Oda等[6]报道,尽管胃转移癌内镜下表现类似黏膜下肿瘤或原发性胃癌,但最终胃镜活检病理诊断率超过90%。
乳腺癌的胃转移部位多为胃体、胃底部,与一般转移性肿瘤不同,通常为单发而非多处转移。转移至胃的乳腺癌主要是富于印戒细胞的小叶癌,肿瘤细胞弥漫性浸润黏膜下和肌层,细胞单一,异型性明显,胞质丰富,可见胞质管腔内嗜酸性包含物,部分细胞富含黏液,呈印戒状,与胃原发性印戒细胞癌鉴别困难。因与原发性胃癌的临床、内镜甚至病理学表现相似,仅50%的小叶癌转移至胃最初被诊断为转移性。免疫组化染色在鉴别诊断中起至关重要的作用。雌激素受体(ER)、孕激素受体(PR)在胃癌中的阳性率分别为23%~44.2%和12%~30.8%,用于鉴别原发性与转移性胃癌意义不大[7]。GATA-3较特异地表达于乳腺癌和泌尿道上皮肿瘤中[8],联合GCDFP-15、乳腺珠蛋白等乳腺特异性标志物判断肿瘤组织的乳腺起源具有极高的敏感性和特异性。
其他部位,如肺、肝、肾癌等的胃转移较罕见。组织形态学结合器官特异性免疫组化标志物是诊断的关键。肺来源标志物有TTF-1、SP-B、Napsin-A等。Arg-1是一种敏感的肝细胞癌标志物,不同研究中Arg-1在肝细胞癌中的阳性率为75.5%~96.1%不等[9]。Glypican-3、HepPar-1、癌胚抗原(CEA)、CD10、甲胎蛋白(AFP)等亦可用于肝细胞癌的诊断和鉴别诊断。肾来源标志物包括RCC、CAⅨ等,对肿瘤起源的判断具有重要作用。
CMV感染可累及全消化道,症状取决于感染部位和严重程度,患者可有吞咽困难、恶心呕吐、腹痛、体质量下降等表现。炎症性肠病合并CMV肠病较多见,据报道CMV肠病总体患病率在溃疡性结肠炎患者中为4.6%,在克罗恩病患者中为0.8%[10]。胃肠道组织病理学检查对于CMV感染的诊断具有重要意义。组织学上,CMV感染的细胞明显增大,细胞核增大可达3~4个淋巴细胞核大小;可见圆形或椭圆形的紫色核内包涵体,大小10~15 μm,周围环绕透明的空晕,与核膜分离,形似“鹰眼”,此为具有特征性诊断意义的CMV包涵体。CMV包涵体可见于巨噬细胞、血管内皮细胞、肝细胞、多种上皮细胞、中性粒细胞、神经细胞等的细胞核内。有时可表现为不典型包涵体,核内有红染模糊物质,空晕不明显,此时可使用CMV抗体行免疫组化染色证实病毒的存在。免疫组化染色不仅能凸显CMV感染细胞,避免HE染色观察的假阴性,而且CMV免疫组化染色阳性被认为是活动性感染伴高CMV复制的标志[11]。组织形态学表现不典型、免疫组化染色判读为可疑阳性时,诊断CMV感染需慎重,结合病史或行CMV分子学检测是一个行之有效的方法。
胃镜活检取材有限,一些罕见疾病易误诊、漏诊。本研究分析的12例少见胃黏膜病变均为活检病例,胃原发性神经内分泌肿瘤、胃原发性鳞状细胞癌、肾转移癌等形态较典型,乳腺浸润性小叶癌胃转移和胃CMV感染则曾被低年资病理医师误诊为胃原发性低分化癌。通过总结复习加深对这些罕见疾病的认识,熟悉其组织形态学特点和免疫组化标志物,高度警惕其发生的可能性,可最大限度地避免误诊和误治。
