Wnt2、Dv-lmRNA及蛋白表达情况与食管癌细胞浸润转移的相关性分析
2019-03-27邵铁良邵一峰马平均
邵铁良,邵一峰,马平均
(1.平顶山市第一人民医院 胸外科,河南 平顶山467000;2.新乡医学院2015级基础临床10班)
食管癌极易出现转移,但血行转移比较少见,常见转移部位有胃、肝、肺、肾、胸膜、腹膜、肾上腺及胰腺等,以肝、肺较为常见。此外,食管癌转移还多见内壁的直接扩散、浸润及淋巴结转移[1]。Wnt2作为Wnt信号转导通路的重要启动因子,可通过Wnt信号通路介导肿瘤的发生、发展、侵袭转移和预后[2]。Dv-1位于β-catenin上游,属于Wnt信号通路的正向调节因子,其在基因到蛋白的多层次研究资料较少[3]。因此,本文对Wnt2、Dv-lmRNA及蛋白表达情况与食管癌细胞浸润转移的相关性进行研究并探讨其在临床上应用的意义,旨在为食管癌转移的预防提供数据参考。
1 资料与方法
1.1 一般资料
选取2015年2月—2016年2月我院确诊的食管癌患者手术切除标本100例(病灶组),癌旁组织标本50例(癌旁组)。 病灶组男性57例,女性43例,年龄35-77岁,平均年龄50.26±10.42岁;临床TNM分期Ⅰ期25例,Ⅱ期24例,III期51例;高分化30例,中分化35例,低分化35例;无淋巴结转移51例,有淋巴结转移49例;浸润侵及浆膜55例,未侵及浆膜45例。癌旁组男性24例,女性26例,年龄33-76岁,平均年龄49.22±11.19岁。两组标本患者的年龄、性别比较,差异无统计学意义(P>0.05)。
1.1.1纳入标准[5](1)术前未合并其他部位疾病; (2)术后病理证实为食管癌;(3)手术方法均为食管癌根治性手术;(4)有完整规范的术后病理报告及随访资料。
1.1.2排除标准 (1)合并其他系统严重疾病者。(2)未能完成随访者。(3)凝血功能障碍。(4)因其他部位肿瘤进行过放化疗治疗者。
1.2 检测方法[6]
采用RT-PCR法检测组织中Wnt2、Dv-lmRNA的水平:TRIzol法提取总RNA,具体操作按照试剂盒说明书(购于南京建成生物研究所)进行;以GAPDH为内参后cDNA为模板扩增,Wnt2 正向引物 5′-C CTTTGTTTA TGC CATCTCCTCA G-3′,反向引物 5 ′-G CG G TTGTC CA GTCA G C G TTCTT-3 ,扩增片段长度751 bp ;Dv-l正向引物 5′-CCTGTCA TCTG TCCC ACCTG-3,反向引物 5′-GTC CA G CCCTCTCTCG TCTT-3 ′,扩增片段长度为 119 bp ;Wnt2、Dv-l扩增条件为5 min 95℃,30 s 95℃,30 s,60℃,30 s 72℃,35个循环。GAPDH以30 s 59℃退火,取5 μl扩增物琼脂糖(2%)凝胶电泳40 min,目的基因mRNA表达量为目的基因积分光密度值/GADPH积分光密度值。
采用免疫组化法检测组织中Wnt2、Dv-l 蛋白的表达水平:分别取食管癌患者手术切除的标本和癌旁组织标本,甲醛(10%)固定,石蜡包埋后4 μm连续切片,采用SP免疫组化染色法,DAB显色,试剂盒购于南京建成生物研究所(批次20164327,产品编号PW017),实验操作严格按试剂盒说明书进行,PBS(0.01mol/L)代替一抗阴性对照,GLUT1兔抗人抗体为阳性对照。
再利用蛋白质印迹法检测Wnt2、Dv-l 蛋白表达情况:提取总蛋白后BCA法检测浓度,电泳分离后湿转法蛋白转至PVDF膜上,脱脂奶粉(5%)2 h封闭,孵育(4℃)一抗过夜,洗涤后二抗孵育,ECL发光试剂曝光显影。
1.3 结果判定标准[7]
1.3.1免疫组化判定标准 阴性对照用PBS代替一抗进行染色,结果做为阴性;阳性对照以各抗体说明书所提供组织进行染色,Wnt2、Dv-l表达阳性细胞有淡黄色或棕黄色着色,均主要表达在细胞质及细胞膜。每例标本在400倍光镜下随意选取10个视野,计数每个视野100个细胞中阳性染色的细胞数,取其平均值计算阳性百分率。采取二次计分法:先将染色按强度计分:0分无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再将阳性细胞百分比计分,0分阳性细胞为<25%,1分为25%-50%,2分为51%-75%,3分为≥75%。用染色强度得分与细胞数得分之和作为判断表达的结果,0分为阴性(-),1-2分为弱阳性(+),3-4分为中等阳性(+ +),5-6分为强阳性(+ + +)。所有病理切片均由高年资病理医师盲法评定结果。
1.3.2RT-PCR、蛋白质印迹判定标准 分别以每例标本Wnt2、Dv-l 与GAPDHCt值之比,作为该例标本目的基因mRNA的相对表达量;蛋白质印迹曝光结果以胶片上出现Wnt2、Dv-l 和GAPDH内参条带,且GAPDH内参基因的曝光条带在病灶组和癌旁组灰度一样。
1.4 统计学方法

2 结果
2.1 两组组织标本中Wnt2、Dv-l 蛋白的表达情况
Wnt2蛋白在病灶组的表达明显高于癌旁组(P<0.05);Dv-l 蛋白在病灶组的表达明显高于癌旁组(P<0.05),见表1。
2.2 两组组织标本中Wnt2、Dv-l mRNA及蛋白的表达水平比较
病灶组Wnt2、Dv-l mRNA及蛋白含量明显高于对照组,差异有统计学意义(P<0.05)见表2;western blot结果见图1。
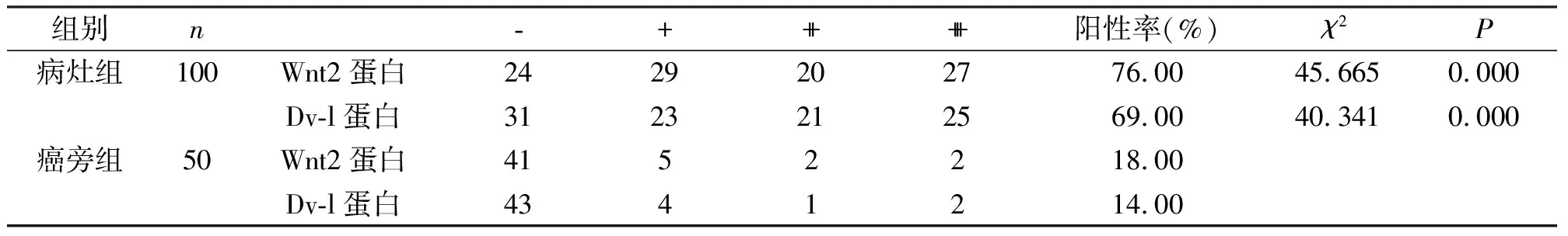
表1 两组组织标本中Wnt2蛋白表达情况 n(例)
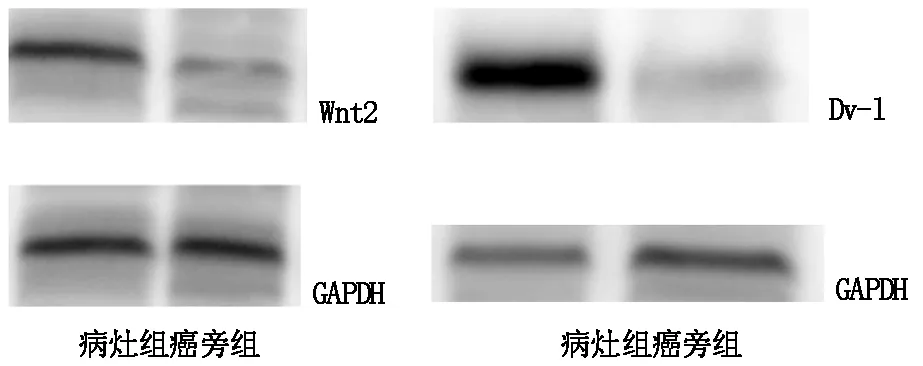
图1 Wnt2、Dv-l蛋白表达水平
2.3 组织标本中的Wnt2、Dv-l蛋白表达与患者临床病理学特征的关系
Wnt2、Dv-l 蛋白表达和相对含量在不同性别、年龄、组织学分级间比较,均无显著性差异(P>0.05);Wnt2、Dv-l 蛋白的表达与患者肿瘤的临床病理学分期、浸润程度、淋巴结转移情况有显著性差异(P<0.05),见表3。

表2 两组标本中Wnt2、Dv-l mRNA及蛋白相对含量比较
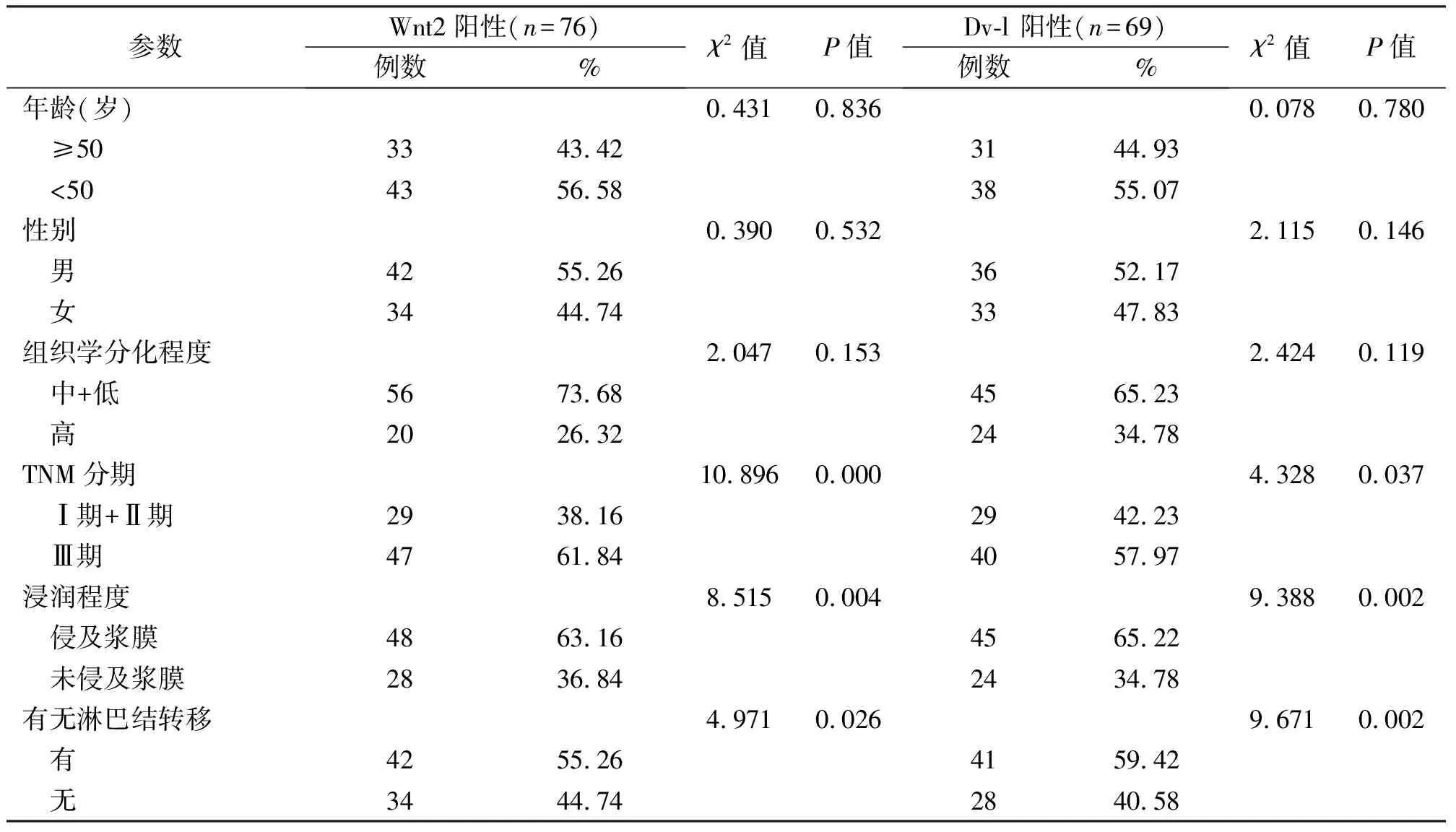
表3 Wnt2蛋白表达与临床病理因素的关系
3 讨论
食管癌是常见的消化道肿瘤,全世界每年约有30万人死于食管癌。其发病率和死亡率各国差异很大。我国是世界上食管癌高发地区之一,每年平均病死约15万人。男多于女,发病年龄多在40岁以上[8]。食管癌典型的症状为进行性咽下困难,先是难咽干的食物,继而是半流质食物,最后水和唾液也不能咽下,严重降低了患者生活质量。因而,食管癌的早期诊断并及时给予恰当的治疗显得尤为重要。
随着抑癌基因和癌基因的发现和研究,细胞信号通路逐渐被阐明,人类对细胞癌变的机制了解也逐渐得到了丰富,近年来的多项研究[9,10]均证明Wnt信号转导通路调节并控制着诸多生理过程,参与细胞的增殖、凋亡与抗凋亡等过程。Wnt途径是调节细胞生长和发育的重要途径,此外,该途径与细胞癌变的关系也较为密切,上述变化可能与通路中任何成分出现改变或Wnt基因本身存在的变化而引发[11]。Dv-1蛋白在宫颈鳞癌、乳腺癌、肺癌等肿瘤中存在异常表达,研究[13]发现Wnt2单克隆抗体可下调恶性黑色素瘤细胞诱导细胞凋亡,使 Dv-1蛋白失活,进而抑制黑色素瘤体外移植瘤的生长。资料[13]显示Wnt途径的异常激活主要可分为以下3类:(1)过多的Wnt信号异常活跃整个途径导致细胞出现不必要的增殖,促进Dv-1蛋白的表达;(2)组成Wnt途径的蛋白、基因或转录因子出现变异或被破坏导致局部Wnt途径或整个途径活跃异常,进而使Dv-1蛋白出现异常表达;(3)细胞内多因素通过Wnt途径诱发或刺激机体和细胞出现异常反应。
本研究结果显示Wnt2、Dv-lmRNA及蛋白在病灶组中表达水平明显高于癌旁组(P<0.05);病灶组Wnt2、Dv-lmRNA及蛋白含量明显高于对照组,差异有统计学意义(P<0.05)。上述结果说明Wnt2、Dv-l可参与食管癌的发生、发展过程。研究显示Wnt信号通路广泛存在于无脊椎动物和脊椎动物中,是一类在物种进化过程中高度保守的信号通路。Wnt信号在动物胚胎的早期发育、器官形成、组织再生和其它生理过程中,具有至关重要的作用,如果这条信号通路中的关键蛋白发生突变,导致信号异常活化,就可能诱导癌症的发生[14]。
本研究发现Wnt2、Dv-l 蛋白的表达与患者肿瘤的组织学分化程度、临床病理学分期及淋巴结转移情况有密切的联系(P<0.05)。上述结果说明,Wnt2、Dv-l 蛋白表达与食管癌细胞浸润转移具有密切的关联。在食管癌的浸润过程中Wnt2、Dv-l 蛋白的异常表达可导致食管黏膜上皮细胞的分化、增殖和凋亡出现异常,即表现出异常分化、过度增殖和凋亡减少且侵袭能力提升,进而诱发食管癌向深层和远处进一步转移[15]。因而,我们可认为Wnt2、Dv-l 蛋白表达异常可提示肿瘤细胞的吸收和利用增加有关,其可与食管黏膜上皮细胞的异常增殖相互促进,对食管癌的转移和侵入发挥重要作用。
综上所述,Wnt2、Dv-lmRNA及蛋白表达与食管癌细胞浸润转移具有密切的关联。
