Dickkopf-3在结肠癌间质微血管和肿瘤细胞中的表达及其临床意义
2019-03-27杨子荣丁丽敏于庆功
杨子荣,刘 城,丁丽敏,张 孟,于庆功
(大连大学附属中山医院 消化内科,辽宁 大连116001)
Dickkopf-3(DKK-3)是具有较高Wnt抑制活性的分泌性糖蛋白Dickkopf (DKK)家族中的一员,在胚胎发生过程中对细胞命运、增殖和极性等的控制有重要的作用[1]。近来研究表明DKK-3的表达可能参与一些肿瘤的发生和发展,本文通过检测DKK-3在人结肠癌组织芯片中的表达,分析结肠癌间质微血管内皮细胞和肿瘤细胞中DKK-3表达与其临床病理因素的关系,探讨其在结肠癌发生及侵袭转移中的作用。
1 材料和方法
1.1 试验材料
购自桂林泛普生物技术有限公司的人结肠癌组织芯片(产品编号:COC1501+COC1502)包括133例结肠腺癌组织和10例非癌结肠黏膜组织,双芯布阵,经过公司病理专业人员检查证实。在133例结肠腺癌组织中,女58例,男75例,年龄19-92岁,平均年龄(58.05±14.28) 岁。组织标本经10%中性甲醛缓冲液固定24 h,固定于美国Superfrost Plus防脱载玻片上,4℃保存。
1.2 免疫组化染色
羊抗人DKK-3多克隆抗体(AF1118)购自美国R&D公司,工作浓度为1∶50。SP免疫组化染色按SP试剂盒实验步骤操作。
1.3 结果判断
微血管内皮细胞染色阳性判断标准:阳性信号位于细胞间质微血管,不论染色强度,微血管染色达90%以上为阳性,微血管染色不足10%为阴性,其余均为中间染色[2]。
肿瘤细胞染色阳性判断标准:阳性信号位于细胞质,根据阳性细胞百分数和染色强度对每张切片进行分级:细胞数计分0分(无),1分(<10%),2分(<10%-50%),3分(<51%-80%),4分(>80%);染色强度0分(不着色),1分(弱),2分(中),3分(强);组织化学染色积分(细胞数计分和染色强度计分的乘积):>4分为阳性[3]。
1.4 统计学处理
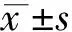
2 结果
2.1 结肠癌及非癌结肠黏膜组织中DKK-3的表达
淡黄色至棕黄色颗粒沉淀主要分布于结肠癌间质微血管内皮细胞和肿瘤细胞细胞质,DKK-3在上述两者中表达阳性率分别为72.93%(97/133)和41.35%(55/133)。DKK-3在10例非癌结肠黏膜组织间质微血管内皮细胞中均不表达,而在正常组织细胞中的8例表达为阳性,见图1。
2.2 DKK-3的表达与结肠癌临床病理特征的关系
结肠癌间质微血管内皮细胞中DKK-3的表达与其分化程度相关(P<0.05),而与性别、年龄、TNM分期、浸润深度及淋巴结转移无关(P>0.05)。结肠癌肿瘤细胞中DKK-3的表达与TNM分期、浸润深度及淋巴结转移相关(P<0.05),而与性别、年龄及分化程度无关(P>0.05),见表1。
3 讨论
结直肠癌(colorectal cancer,CRC)的发病率在过去的数十年中增加了2-4倍[4]。CRC的侵袭和转移是影响预后的主要因素之一,同时也是导致CRC患者死亡的重要原因[5],但是现在对于CRC侵袭转移涉及的分子机制仍不十分清楚。
近来研究显示[6,7],Wnt 信号转导通路包括通过Wnt/Ca2+和Wnt/JNK(平面细胞极性)调控的非经典Wnt信号通路和经典Wnt/β-catenin信号通路,对细胞的增殖、命运、极性和迁移起到重要的调节作用。Wnt拮抗因子主要包括分泌性sFRP 家族(the secreted Frizzled-related family)和DKK家族[8],这些拮抗因子直接结合Wnt,并改变它们结合Wnt受体复合物的能力,DKK家族在理论上特异性抑制β-catenin依赖的经典Wnt信号转导。
人DKK相关基因包括DKK-1、DKK-2、DKK-3和DKK-4以及一种独特的称为Soggy(Sgy)的DKK-3相关蛋白[1]。DKK-3,即REIC(Reduced Expression in Immortalized Cells),是DKK家族最有分歧的一员,普遍被认为可能是一种分泌性肿瘤抑制基因,因为其在很多肿瘤细胞中表达下调[8]。有趣的是,DKK-3在人胃腺体深部和结肠隐窝基底部强表达[9],而这些部位是胃肠道干细胞所在的位置,因此DKK-3可能是胃肠道组织中一种重要的Wnt信号调节因子,对于干细胞池自身稳定的维持可能起到一定的作用,DKK-3可能是胃肠道增殖调控网络的重要组件。
Zhang等[10]通过免疫组织化学SP法检测了DKK-3 在食管癌中的表达及其与临床病理参数之间的关系,结果显示DKK-3在食管鳞癌微血管中的阳性表达率为65.7%(44/67),其阳性表达与纤维膜浸润、淋巴结转移、浸润深度和TNM分期的相关性均有统计学意义(P<0.05),推测DKK-3可能通过调控食管癌血管形成而在食管癌进展中发挥作用。2010年,Muhlmann等[11]通过免疫组织化学的方法检测了DKK-3在136例人胃癌组织样本中的表达,结果分别在94.9%(129/136)的样本肿瘤血管内皮细胞和62.5%(85/136)样本肿瘤细胞中检测到了DKK-3的表达;其中DKK-3在30.1%(41例)的样本肿瘤细胞中过表达,并与pT分期和UICC分期呈显著相关(P<0.05);生存分析显示DKK-3在肿瘤血管内皮细胞中的表达是患者无瘤生存的一个独立预测指标。2008年,Untergasser等[12]应用免疫组化、Westeron Blotting、定量PCR在35例结肠癌组织、30例神经胶质瘤、80例非霍奇金淋巴瘤和30例黑色素瘤中研究发现DKK-3在这些肿瘤的微血管内皮细胞中的表达增加,而且在正常结肠黏膜组织细胞以及血管中DKK-3只有很弱的阳性表达(P<0.05),结果表明DKK-3可能参与

A:DKK-3在非癌结肠黏膜组织中的阴性表达;B:DKK-3在非癌结肠黏膜组织中的阳性表达;C:DKK-3在高分化结肠癌间质微血管内皮细胞中的阳性表达;D:DKK-3在高分化结肠癌肿瘤细胞中的阳性表达;E:DKK-3在中分化结肠癌间质微血管内皮细胞中的阳性表达;F:DKK-3在中分化结肠癌肿瘤细胞中的阳性表达;G:DKK-3在低分化结肠癌间质微血管内皮细胞中的阳性表达;H:DKK-3在低分化结肠癌肿瘤细胞中的阳性表达

表1 DKK-3在结肠癌间质微血管内皮细胞和肿瘤细胞中的表达与结肠癌患者临床病理特征之间的关系
并促进了肿瘤的血管重塑和形成。同年,Zitt等[2]研究发现在结直肠癌及其癌旁组织中,DKK-3阳性样本的平均微血管计数明显高于DKK-3阴性样本,且DKK-3的表达随微血管数增加而增加,而所有微血管在正常黏膜样本表现为DKK-3阴性,推测DKK-3可能是新生血管形成中的一种前血管原性蛋白,或是结直肠癌新生血管形成的一种标记。2009年,Fong等[13]分析了DKK-3在胰腺癌中表达的临床意义及其对体外内皮细胞生长的作用,同CD31染色相比较,只在肿瘤组织中发现DKK-3阳性血管,DKK-3微血管密度同肿瘤分级呈明显负相关;在生存分析中,低DKK-3微血管密度患者的平均存活时间是7个月,而高DKK-3微血管密度患者的平均存活时间是15个月(P=0.0013);接受吉西他滨治疗患者的亚组分析结果显示低DKK-3微血管密度组的总生存率同高DKK-3微血管密度组相比明显降低(P=0.009);在Cox回归中,DKK-3显示出是一个很重要的独立参数(P=0.024);内皮细胞中DKK-3过表达同正常内皮细胞和肿瘤细胞系相比增强了5-氟尿嘧啶或吉西他滨治疗后的生长抑制作用,DKK-3低血管密度同肿瘤进展和临床预后较差相关。本实验通过组织芯片和免疫组化染色技术,显示在结肠癌组织间质微血管内皮细胞和肿瘤细胞中表达阳性率分别为72.93%和41.35%,这与以往研究结果基本一致。本次试验也证实肿瘤细胞中DKK-3的低表达与结肠癌的TNM分期、浸润深度及淋巴结转移相关,同上述结果部分一致。DKK-3在结肠癌间质微血管内皮细胞和肿瘤细胞中不同的表达模式提示DKK-3可能在肿瘤细胞和微血管内皮细胞具有不同的功能。
目前DKK-3在机体内影响结肠癌发生和发展的生物学机制仍不十分清楚,还需要我们进一步研究。DKK-3有可能成为一种新的反映结肠癌生物学行为的客观指标,有望成为结肠癌治疗的新靶点。
