miR-15b-5p靶向CDK4抑制脉络膜黑色素瘤细胞增殖
2019-03-27张晓楠冯浩白雪应曼曼孙胜男宁宏
张晓楠,冯浩,白雪,应曼曼,孙胜男,宁宏
(中国医科大学附属第一医院眼科,沈阳 110001)
脉络膜黑色素瘤是成人最常见的原发性眼内恶性肿瘤,具有高转移率和死亡率,超过90%的患者会发生肝转移,平均生存时间为7个月。作为黑色素瘤中最致命的一类,脉络膜黑色素瘤患者即使接受过治疗,仍然有约50%会发生转移,10年生存率约为50%[1-3]。视力丧失是脉络膜黑色素瘤的主要危害之一,超过1/3的患者需要摘除眼球[4]。脉络膜黑色素瘤的早期诊断和治疗是提高患者生存率的关键。对脉络膜黑色素瘤发生发展机制的深入研究将有助于发现新的诊断和治疗方法。
肿瘤的发生常表现为失控性的细胞增殖。细胞周期依赖性激酶 (cyclin-dependent kinases,CDKs) 连续地激活和抑制则是增殖调控的关键因素。众多研究表明,P16-cyclinD-CDK4/6-RB 通路在脉络膜黑色素瘤的发生发展中起着重要的作用,但探讨CDK4与脉络膜黑色素瘤细胞增殖的研究却鲜有报道。同时,多种微小RNA (microRNAs,miRNAs) 也被证实与脉络膜黑色素瘤密切相关。miR-15b-5p是一种与肿瘤发生发展相关的miRNA,它能够与靶基因mRNA的3’UTR区结合,通过抑制靶基因的表达发挥功能,且它在多种疾病中发挥的生物学功能不尽相同。目前尚未见关于miR-15b-5p调节脉络膜黑色素瘤细胞增殖的报道。
因此,本研究从关键基因CDK4入手,参考miRNAs调控机制,检测miR-15b-5p与CDK4的靶向调控作用,进而探究miR-15b-5p在脉络膜黑色素瘤细胞恶性增殖中的作用。
1 材料与方法
1.1 双荧光素酶报告检测
将miR-15b-5p与CDK4 3’UTR结合区域的野生型 (WT) 序列和突变型 (MT) 序列插入至pMIR-REPORT荧光素酶质粒中,合成pMIR- REPORT Luciferase-CDK4-3’UTR (WT) 和pMIR- REPORT Luciferase-CDK4-3’UTR (MT) 2种质粒,用海肾荧光素酶质粒pmirGLO作为对照 (以上质粒由和元生物公司合成提供) 。将细胞分为4组: (1) WT+nc组,共转染CDK4 3’UTR野生型质粒与negative control RNA; (2)WT+mi组,共转染CDK4 3’UTR野生型质粒与mir-15b-5p mimics; (3) MT+nc组,共转染CDK4 3’UTR突变型质粒与negative control RNA; (4) MT+mi组,共转染CDK4 3’UTR突变型质粒与miR-15b-5p mimics。在质粒和RNA共转染293T细胞72 h后,使用双荧光素酶报告检测试剂盒 (美国Promega公司) 检测荧光强度。
1.2 细胞培养与转染
人眼侵袭性脉络膜黑色素瘤细胞系MUM-2B购自上海拜力生物技术有限公司,在含有5%CO2的37℃培养箱中使用含10%的胎牛血清的MEM培养基(美国HyClone公司) 培养。microRNA negative control(nc) ,miR-15b-5p mimics,microRNA inhibitor nc,miR-15b-5p inhibitor由苏州吉玛基因公司合成。使用lipofectamineTM3000 (美国Life Technologies Corporation公司) 转染RNA。将上述RNA和lipofectamine3000分别与无血清培养基混合,再将2种混合物相互混合,静置15 min,加入到更换新鲜培养基的细胞中。
1.3 实时荧光定量PCR
使用总RNA提取试剂盒 (miRcute miRNA Isolation Kit,北京天根生化科技有限公司天根) 提取总RNA;使用微量分光光度计 (英国BioDrop公司) 检测RNA的质量和纯度;使用miRNA PCR试剂盒 (Hairpin-itTMmicroRNA and U6 snRNA Normalization RTPCR Quantitation Kit,苏州吉玛基因公司) 完成反转录和qRT-PCR;使用PCR仪 (LightCycler 480Ⅱ,瑞士Roche 公司) 检测荧光。采用2-ΔΔCt法分析结果。以上操作均按照各自试剂操作手册进行。
1.4 Western blotting
使用RIPA 裂解缓冲液 (上海碧云天生物技术公司) 提取总蛋白,使用BCA蛋白检测试剂盒 (上海碧云天生物技术公司) 检测蛋白浓度。以每孔20 µg蛋白上样,10% SDS-PAGE电泳,将蛋白转印至PVDF膜 (美国BIO-RAD公司) ,用5%脱脂牛奶封闭2 h,加入CDK4抗体 (1︰1 000,ab108357,美国Abcam公司)和GAPDH抗体 (1︰5 000,5174s,美国Cell Signaling Technology公司) 于4 ℃孵育过夜。TBST清洗3次,于37 ℃孵育二抗 (ZB-2301,山羊抗兔1︰5 000,北京中山金桥生物技术有限公司) 1 h。使用ECL试剂 (美国Pierce公司) 在发光仪MicroChemi4.2 (以色列DNR公司) 上检测条带的荧光亮度。
1.5 CCK-8细胞增殖实验
采用CCK-8试剂盒( 日本Dojindo公司) 检测细胞增殖能力。将转染24 h后的细胞接种于96孔板中(3×103/孔) ,分别于0、24、48和72 h每孔加入混合有10 µL CCK8试剂的100 µL培养基,于37 ℃孵育2 h后,使用酶标仪( Model 680,美国Bio-Rad公司) 检测450 nm波长吸光度( optical density,OD) 值。
1.6 细胞周期检测
细胞转染12 h后更换新鲜培养基,再培养48 h后用胰酶消化收集细胞,使用PBS重悬细胞并用70%乙醇固定24 h。检测前每管细胞用500 µL PI/RNase常温避光染色30 min。使用流式细胞仪FACSCalibur (美国BD公司) 检测。使用cellQuest Pro分析检测结果。
1.7 统计学分析
采用SPSS 20.0和GraphPad Prism 7.0软件进行统计分析与作图。每个结果重复3次。使用两样本t检验比较2组数据。P < 0.05为差异有统计学意义。
2 结果
2.1 miR-15b-5p与CDK4的结合情况
利用生物信息学网站Targetscan 7.0进行分析,发现miR-15b-5p的种子序列与CDK4的3’UTR区域含有匹配的区段。使用双荧光素酶报告实验验证二者具有直接结合的位点及结合能力 (结合序列见图1A) 。4组细胞荧光素酶相对活性结果如图1B所示,WT+mi组荧光素酶活性 (0.880 7±0.025 67) 明显低于WT+nc组 (1.141 0±0.033 69) ,差异有统计学意义 (P < 0.01) 。而MT+nc组与MT+mi组的荧光素酶活性(0.980 7±0.048 09,0.968 0±0.0268 9),则无统计学差异 (P = 0.696 4) 。
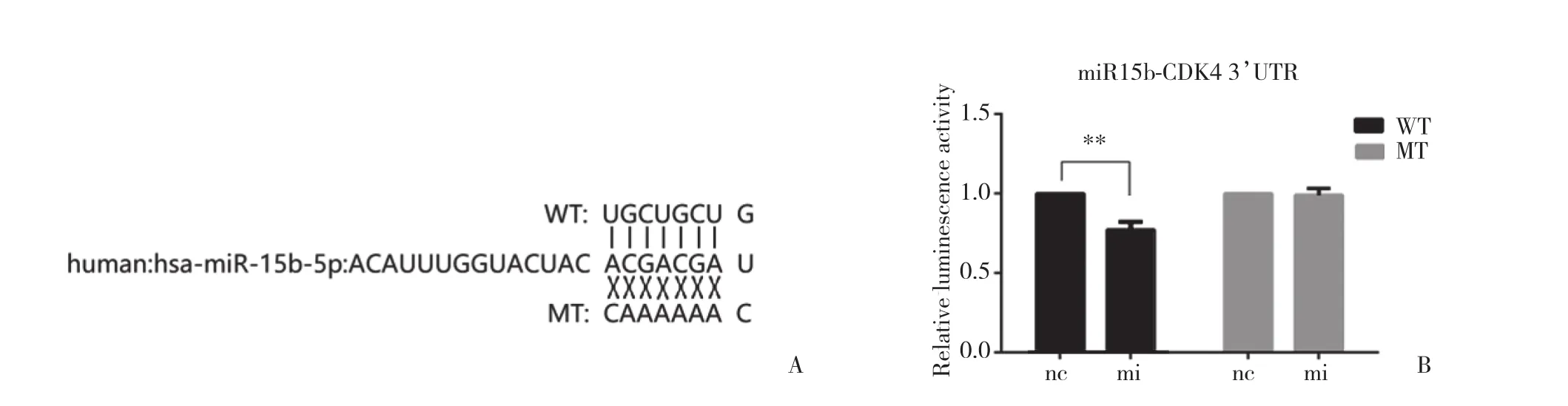
图1 双荧光素酶报告实验验证miR-15b-5p与CDK4 mRNA的3’-UTR区域直接结合Fig.1 Dual-luciferase assay result showed that CDK4 was a direct target of miR-15b-5p
2.2 miRNA的转染效率
通过实时荧光定量PCR检测miR-15b-5p表达水平。如图2所示,mimics组miR-15b-5p的相对表达量为nc组的389.3% (P < 0.000 1) ,提示转染mimics能有效增加miR-15b-5p表达水平;同时,inhibitor组miR-15b-5p的相对表达量为inhibitor nc组的3.166%(P < 0.000 1) ,提示转染inhibitor能有效减低miR-15b-5p表达水平。
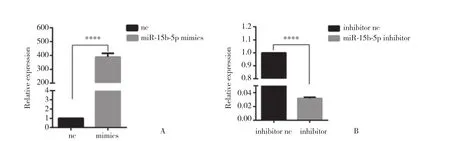
图2 实时荧光定量PCR检测miR-15b-5p表达水平Fig.2 The expression level of miR-15b-5p detected using QRT-PCR
2.3 CDK4蛋白的表达量
通过Western blotting检测CDK4蛋白的表达量,结果如图3所示,与nc组相比,mimics组CDK4蛋白条带的相对灰度值升高(0.610±0.079),差异有统计学意义 (P < 0.01) ;与inhibitor nc组相比,inhibitor组CDK4蛋白条带的相对灰度值降低(1.331±0.099),差异有统计学意义( P < 0.05) 。
2.4 miR-15b-5p对脉络膜黑色素瘤细胞增殖的影响
用CCK-8实验测定细胞增殖能力,结果如图4所示,转染72 h时nc组与mimics组的相对OD值分别为2.486±0.075 19和1.671±0.044 61,差异有统计学意义 (P < 0.001) ,与nc组相比,mimics组细胞的增殖能力下降;细胞转染72 h时,inhibitor nc组与inhibitor组的相对OD值分别为3.300±0.095 89和4.513±0.189 20,差异有统计学意义 (P < 0.01) ,与inhibitor nc组相比,inhibitor组细胞的增殖能力升高。
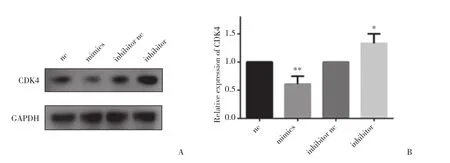
图3 Western blotting检测CDK4蛋白表达量Fig.3 The expression level of CDK4 detected by Western blotting
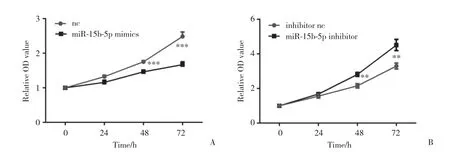
图4 CCK-8检测miR-15b-5p对脉络膜黑色素瘤细胞增殖的影响Fig.4 The effect of miR-15b-5p on the proliferation of choroidal melanoma cells detected by CCK-8
2.5 miR-15b-5p对脉络膜黑色素瘤细胞周期的影响
使用流式细胞术检测各组细胞周期情况。如图5所示,mimics组细胞G1期的比例[( 81.79±0.750 2) %]较nc组[ ( 75.98±0.499 7) %]增加,差异有统计学意义(P < 0.01) ;inhibitor组细胞G1期比例[( 70.82±1.013 0) %]较inhibitor nc组[( 76.36±0.978 4) %]减少,差异有统计学意义( P < 0.05) 。
3 讨论
脉络膜黑色素瘤的发生存在多种机制,如基因突变、染色体缺失或易位以及信号通路的异常激活等。研究[5-8]发现,脉络膜黑色素瘤中,p16的甲基化失活较为常见,cyclin D1呈高表达,促进CDK4磷酸化Rb;Rb的磷酸化可以释放转录因子E2F1,促进细胞周期从G1期向S期推进,进而促进细胞的恶性增殖。这些证据都表明,p16-cyclinD-CDK4/6-RB通路与脉络膜黑色素瘤的发生发展密切相关。CDK4作为通路中的核心分子,很有可能发挥了重要的作用。虽然一些关于遗传易感性的研究[9-10]发现脉络膜黑色素瘤中没有CDK4的可遗传突变发生,但这并不能排除包含miRNA机制在内的一些表观遗传学机制参与CDK4对脉络膜黑色素瘤发生发展调节的可能性。
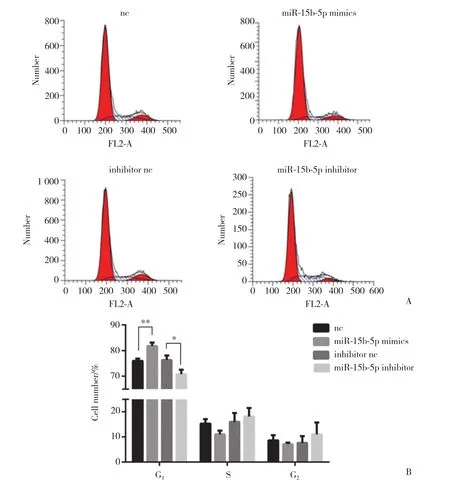
图5 流式细胞术检测miR-15b-5p对脉络膜黑色素瘤细胞周期的影响Fig.5 The effect of miR-15b-5p on the cell cycle of choroidal melanoma cells detected by flow cytometry
miRNA是一类长约22个核苷酸的内源性非编码单链RNA分子,其功能是与靶基因mRNA的3’UTRs互补性结合,从而反向调控靶基因的表达。目前发现异常的miRNA表达与包括癌症在内的许多疾病有关,而功能实验显示miRNA既可以作为抑癌基因,也可作为癌基因发挥作用[11]。研究[12-13]表明,miRNAs在脉络膜黑色素瘤患者的血清、玻璃体和肿瘤标本中都存在异常表达,许多miRNAs的生物学作用也进一步被验证[14-16]。因而miRNAs在脉络膜黑色素瘤进程中起着重要的作用。
本研究将人眼侵袭性脉络膜黑色素瘤细胞系作为研究对象,通过体外实验探讨miR-15b-5p靶向CDK4抑制脉络膜黑色素瘤细胞增殖的作用。双荧光素酶报告实验证明,CDK4是miR-15b-5p的直接靶点。在脉络膜黑色素瘤细胞系MUM-2B中转染4组miRNA (nc,miR-15b-5p mimics,inhibitor nc,miR-15b-5p inhibitor) ,实时荧光定量PCR结果证实转染有效,Western blotting结果证明miR-15b-5p能够负向调节CDK4的蛋白表达。上述结果共同证明在脉络膜黑色素瘤细胞系中miR-15b-5p能够靶向抑制CDK4的表达。应用CCK-8进一步对细胞增殖能力进行检测,结果表明miR-15b-5p能够抑制脉络膜黑色素瘤细胞增殖。流式细胞术结果证明,miR-15b-5p能够造成脉络膜黑色素瘤细胞发生G1期阻滞。这一结果与p16-cyclinD-CDK4/6-RB通路主要在G1期发挥作用的理论一致。以上结果共同证明了miR-15b-5p能够通过调节CDK4的表达,抑制p16-cyclinD-CDK4/6-RB通路,进而抑制脉络膜黑色素瘤细胞增殖。
miR-15b-5p已被报道与多种肿瘤的发生发展相关,但其发挥的生物学功能却不尽相同。一方面,miR-15b-5p作为肿瘤的抑制因子发挥着多种作用,如诱导细胞死亡、抑制增殖、拮抗转移、重新调节代谢、破坏染色体稳定性、诱导肿瘤相关炎症等[17-18]。另一方面,miR-15b-5p又扮演促癌角色,与皮肤黑色素瘤的发生和不良预后相关[19],且复发患者的血清miR-15b-5p的水平随时间显著升高[20]。miRNA在肿瘤中的具体作用与其靶基因密切相关,即使相同的miRNA作用于不同的靶基因也有可能呈现出完全不同的生物学功能。虽然脉络膜黑色素瘤与皮肤黑色素瘤有许多相似之处,但其中深入的发生发展机制仍有可能存在巨大的差别。本研究证明miR-15b-5p在脉络膜黑色素瘤中通过调控CDK4的表达而发挥抑癌作用。
综上所述,本研究发现miR-15b-5p可靶向调节CDK4在脉络膜黑色素瘤细胞系MUM-2B细胞中的表达,从而抑制脉络膜黑色素瘤细胞的生长。为探索脉络膜黑色素瘤的分子治疗靶点提供了实验依据,为脉络膜黑色素瘤的治疗提供了一种新的可能。
