Notch信号通路促进滑膜肉瘤细胞SW982增殖和侵袭的研究
2019-03-27高天余铃李舒刘佳勇白楚杰薛瑞峰张路方志伟樊征夫
高天,余铃,李舒,刘佳勇,白楚杰,薛瑞峰,张路,方志伟,樊征夫
(1. 北京大学肿瘤医院暨北京市肿瘤防治研究所骨与软组织肿瘤科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142; 2. 武汉大学人民医院骨1科,武汉 430060)
滑膜肉瘤是一种临床上常见的高度恶性软组织肉瘤,好发于青壮年且多在关节周围[1-2]。尽管手术联合放化疗的治疗手段使患者5年生存率达到60%,10年生存率仍然极低[3]。Notch信号通路是一种进化中高度保守的跨膜受体信号通路家族,其所编码的单链跨膜受体蛋白在细胞的分化、个体发育的中起关键作用[4]。Notch信号通路包括Notch受体、配体、修饰蛋白及靶点转录因子。配体与受体结合后,Notch受体发生裂解并释放Notch受体胞内段(Notch intracellular domain,NICD),随后NICD进入细胞核调控靶基因转录[5]。研究[6-8]发现Notch信号通路的失调控参与多种肿瘤的发生发展,如血液系统肿瘤、乳腺癌、胰腺癌等。Notch信号通路对滑膜肉瘤的影响尚未见报道,本研究拟探讨Notch通路相关蛋白在滑膜肉瘤细胞SW982中的表达状态及Notch通路对SW982细胞增殖及侵袭能力的影响。
1 材料与方法
1.1 细胞培养
人滑膜肉瘤细胞株SW982购自美国菌种保藏中心 (American Type Culture Collection,ATCC)。SW982细胞常规培养于含10%胎牛血清、1% 100 U/mL青霉素和100 U/mL链霉素的L-15专用培养基中,置于37℃、5% CO2的培养箱中进行常规培养。
1.2 细胞转染
NICD1过表达、CBF1-shRNA慢病毒和阴性对照病毒均购自上海吉凯基因化学技术有限公司。根据慢病毒转染手册对滑膜肉瘤细胞进行转染,从而得到SW982-Notch上调、W982-Notch下调细胞株。转染的细胞培养72 h后,用嘌呤霉素 (3 μ g/mL) 孵育48 h。筛选后的滑膜肉瘤细胞株即为稳定转染细胞株。
1.3 CCK-8实验
细胞分为SW982正常对照组、SW982-Notch上调组、W982-Notch下调组和DAPT处理组。收集各组细胞制成细胞悬液,用PBS调整细胞密度至1×105/mL。接种于96孔板中,每孔200 μ L,培养24 h,细胞贴壁后分别加入终浓度1、2、4、8 μ mol/L的DAPT,转染组细胞直接培养。培养24 h后,每孔加入10 μ L CCK-8试剂,37 ℃孵育2 h。采用酶标仪检测450 nm处的光密度值 (optical density,OD),计算细胞增殖率,每组实验均重复3次。
1.4 划痕实验
将各组细胞用L-15专用培养基 (含10%胎牛血清) 培养于6孔板上,待融合后,用灭菌枪头划直线,划痕后 0~24 h,用反转的 Olympus IX50 显微镜通过10 倍物镜和Image-ProPlus软件捕获测量划痕面积。所有实验重复 3 次,划痕面积越大,表示迁移能力越弱。
1.5 qPCR检测NOTCH-1、 HES-1、 HES-5、 HEY-1基因mRNA表达水平
按照Invitrogen公司的Trizol操作说明书进行操作,抽提完成后,加入20 μ L无RNA酶水,至完全溶解,紫外分析测定所抽提RNA的浓度。取5 μ g按逆转录试剂盒说明逆转录cDNA。以cDNA为模板PCR扩增NOTCH-1、HES-1、HES-5和HEY-1,以GAPDH为内参照。各基因引物序列如下:NOTCH-1:5’-GGCACT TTCTGTGAGGAGGAC-3’,5’-GCAGTCAGGCGTGTT GTTCT-3’。HES-1:5’-ATTCTGGAAATGACAGTGA AGCAC-3’,5’-CACCTCGGTATTAACGCCCTC-3’。HES-5:5’-GAAGCCGGTGGTGGAGAA-3’,5’-GCTTG GAGTTGGGCTGGTG-3’。 HEY-1:5’-GAAGCAGG TAATGGAGCAAGGA-3’,5’-GAAGCGTAGTTGTTGA GATGCG-3’。GAPDH:5’-ACTTTGGTATCGTGGAA GGACTCAT-3’,5’-GTTTTTCTAGACGGCAGGTCAG G -3’。PCR反应条件:预变性94 ℃ 5 s,94 ℃ 30 s,-60 ℃ 30 s,-72 ℃ 30 s,共40个循环; 溶解曲线条件:95 ℃ 15 s,-60 ℃ 30 s,-95 ℃ 15 s。 基因相对表达水平通过2-△△Ct法计算。
1.6 Western blotting法检测NOTCH-1及HES-1蛋白表达水平
取各组细胞弃去培养液,PBS洗涤3 次,提取细胞蛋白并定量。取适量裂解产物,以1∶4比例加入样品与缓冲液,进行SDS-PAGE,电泳完成后将蛋白转移至硝酸纤维素膜上,用脱脂牛奶室温封闭1 h,加入相应一抗于4 ℃孵育4 h,TBST 洗涤20 min;加入相应二抗于室温孵育1 h,TBST 洗涤20 min;显色,成像扫描分析系统保存图像。
1.7 统计学分析
数据采用SPSS 15.0 统计软件进行分析,实验结果采用±s表示,组间差异采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果
2.1 Notch信号通路相关蛋白在滑膜肉瘤细胞SW982中表达增高
NOTCH-1受体和目的基因 HES-1、 HES-5及HEY-1 在人滑膜肉瘤细胞SW982中mRNA表达水平明显高于正常滑膜细胞,分别较对照组提高1.67±0.36、1.75±0.48、1.56±0.21和1.62±0.25倍,差异有统计学意义 (P < 0.05,图1A)。Western blotting结果同样显示,NOTCH-1蛋白和其目的基因HES-1在人滑膜肉瘤细胞SW982中表达水平显著高于正常滑膜细胞 (图1B)。
2.2 上调Notch信号通路对滑膜肉瘤细胞SW982增殖及侵袭的影响
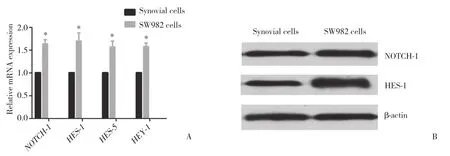
图1 正常滑膜和SW982细胞中Notch通路相关基因表达Fig.1 Expression of Notch signaling pathway related genes in normal synovial cells and SW982 cells
利用慢病毒转染技术构建NICD1持续表达的细胞SW982株。通过qPCR和 Western blotting 技术对NICD1表达发挥的Notch信号通路激活作用进行验证。qPCR结果显示,NOTCH-1及其靶基因HES-1,HES-5,HEY-1的mRNA表达量明显增高,平均较对照组提高1.58±0.27倍,差异有统计学意义 (P <0.05,图2A)。Western blotting验证也发现蛋白表达水平与mRNA表达相符 (图2B)。对Notch上调细胞SW982及对照细胞SW982进行增殖能力测定,CCK8结果显示,24~72 h时间范围内Notch上调的细胞SW982增殖能力明显强于对照细胞SW982,24 h、48 h及72 h较对照组分别提高1.24±0.08、1.48±0.18和1.72±0.47倍,差异有统计学意义 (P < 0.05,图2C)。划痕实验发现,Notch上调的细胞SW982侵袭能力与对照细胞SW982在24h无明显差别。但在48 h时,Notch上调的细胞SW982迁移距离明显长于对照细胞SW982 (图2D)。
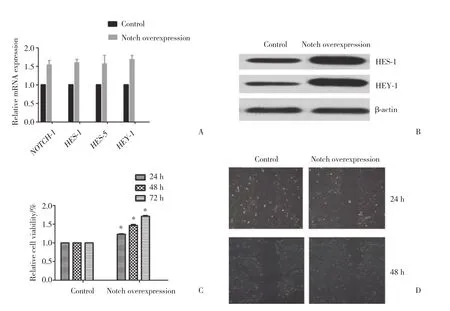
图2 过表达NICD1上调Notch通路活性,增加SW982的增殖和侵袭能力Fig.2 The proliferation and invasion of SW982 cells were upregulated following NICD1 overexpression
2.3 下调Notch信号通路对滑膜肉瘤细胞SW982增殖及迁移的影响
利用qPCR技术进行验证,下调组靶基因mRNA水平仅为对照组的46.3%±10.0%,差异有统计学意义 (P < 0.05,图3A),Western blotting实验也验证了上述结果 (图3B)。对Notch下调的细胞SW982及对照细胞SW982进行增殖能力测定,CCK8结果显示,24~72 h时间范围内Notch下调的细胞SW982增殖能力明显低于对照细胞SW982,24 h、48 h及72 h分别为对照组的72.3%±13.2%、57.6%±11.0%和34.6%±7.5%,差异有统计学意义 (P < 0.05,图3C)。划痕实验发现,Notch下调的细胞SW982迁移能力与对照细胞SW982在24 h无明显差别,48 h时Notch下调的细胞SW982迁移距离明显短于对照细胞SW982(图3D)。
2.4 DAPT对滑膜肉瘤细胞SW982增殖和侵袭的影响
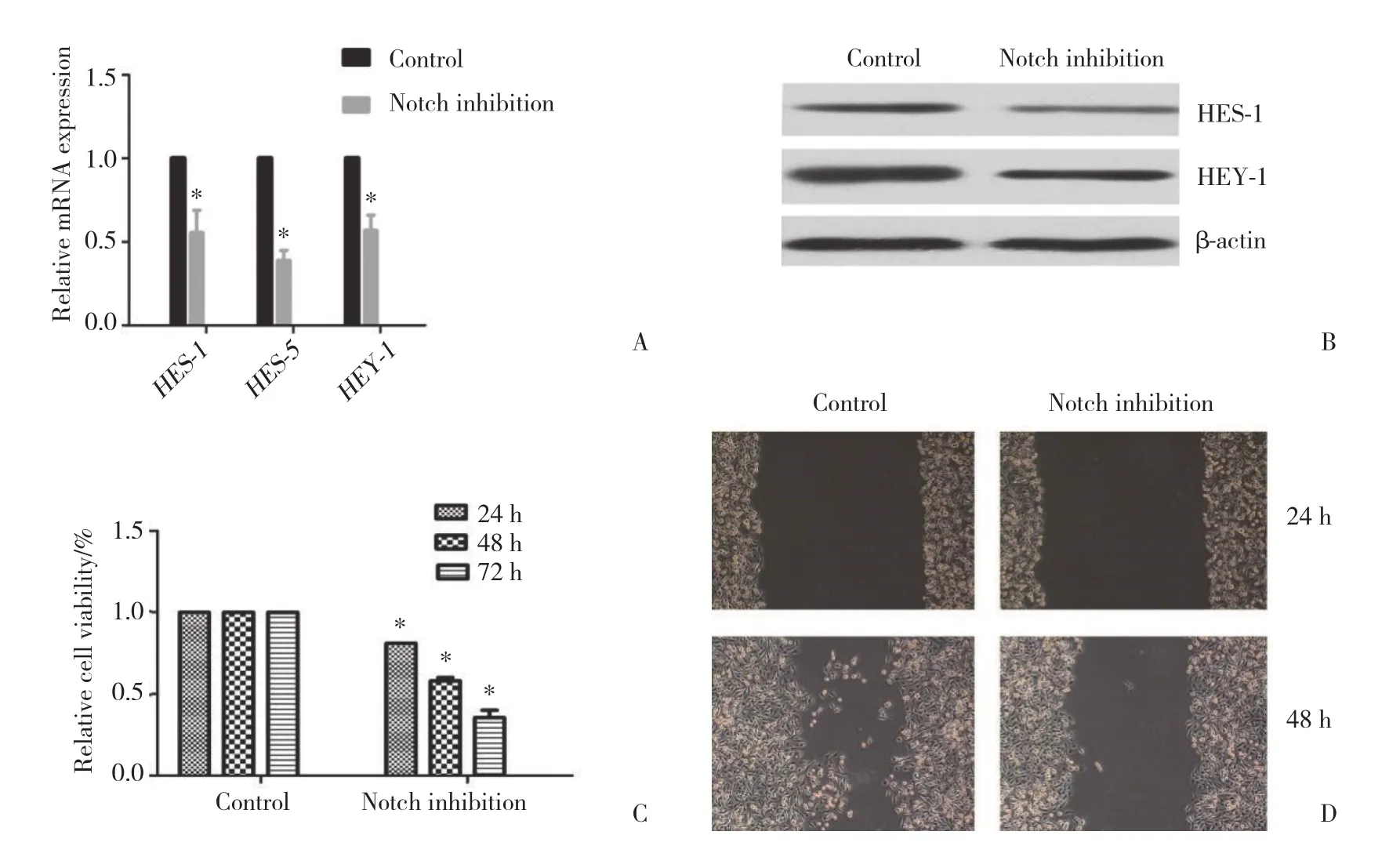
图3 干扰CBF1表达下调Notch通路活性,抑制SW982的增殖和侵袭能力Fig.3 The proliferation and invasion of SW982 cells were downregulated following CBF1 knockdown
CCK8检测发现,用不同浓度DAPT处理后,细胞SW982在24~72 h时间范围内增殖受到明显抑制,且抑制作用有明显剂量依耐性和时间依耐性。在一定范围内,随着DAPT剂量的增加 (1,2,4,8 μ mol/L) 和作用时间的延长,细胞SW982增殖抑制效果明显增加,DAPT 8 μ mol/L处理72 h的抑制率可达到87.3%±7.0%,差异有统计学意义 (P < 0.05,图4A)。
划痕实验结果显示,4 μ mol/L的DAPT孵育细胞SW982 48 h后,细胞迁移的数量明显减少。与对照组相比,有统计学差异 (图4B)。
3 讨论
在大多数滑膜肉瘤中存在特异性的染色体 t(X;18) (p11. 2;q11. 2) 易位,并在断裂处形成融合基因SYT-SSX[9],而这种融合基因带来的下游改变尚不清楚。在FRANCIS等[10]的研究中,对大量的软组织肉瘤样本行基因表达谱分析,其中包括31 例滑膜肉瘤的样本,结果发现,在滑膜肉瘤中差异表达的基因参与Notch、Hh和Wnt等信号通路,其中NOTCH-1和JAG1 明显上调。本研究结果与其一致,滑膜肉瘤细胞SW982中NOTCH-1及其下游基因HES-1、HES-5和HEY-1表达明显高于人源滑膜细胞,提示Notch信号通路在滑膜肉瘤细胞处于激活状态。
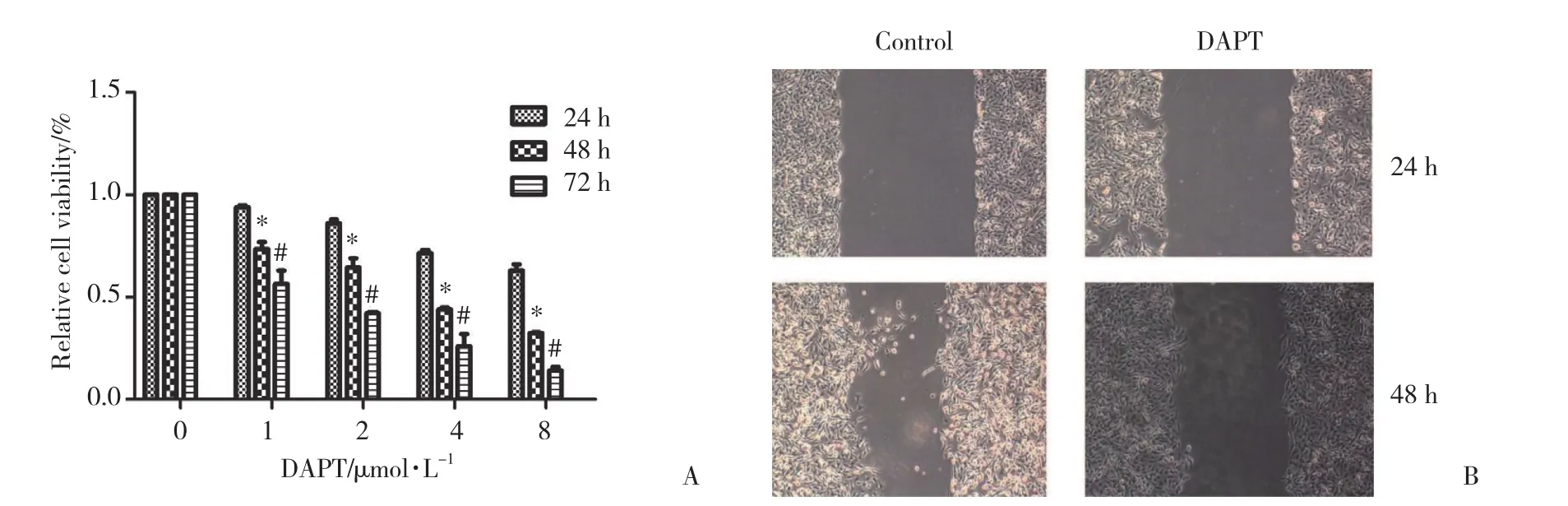
图4 DAPT抑制SW982细胞的增殖和侵袭Fig.4 The proliferation and invasion of SW982 cells were downregulated by DAPT
本研究通过慢病毒转染技术上调和下调Notch信号通路,结果显示,下调Notch信号通路后SW982细胞增殖及迁移明显受到抑制,而上调得到的结果完全相反。磷酸酶及张力蛋白同源的基因 (phosphatase and tensin homolog deleted in chromosome 10,PTEN) 作为抑癌基因发生突变,其与 Notch 通路的关系在多种肿瘤中得到证实。如在乳腺癌中,Notch信号通路通过下调PTEN表达水平,导致ERK1/2信号转导的过度激活,从而参与曲妥珠单抗耐药[11];而在胃癌中,通过抑制Notch信号通路,可上调PTEN活性,从而诱导胃癌G2/M细胞周期阻滞[12]。本研究发现,滑膜肉瘤中NOTCH-1上调,推测其可能导致PTEN基因的降低,从而发挥肿瘤促进作用。
Notch 信号通路无须第二信使,γ-分泌酶抑制剂能够靶向阻断活化的 Notch 受体从胞膜脱落,抑制下游靶基因激活[13-14]。在非小细胞肺癌移植瘤的模型中发现, γ-分泌酶抑制剂能够有效抑制肿瘤生长,且停药后仍然发挥着抗肿瘤作用[15]。同时,研究[16]也证实γ-分泌酶抑制剂对于软组织肉瘤具有抑制作用,如γ-分泌酶抑制剂可减少硬纤维瘤细胞的迁移和侵袭,并可导致其细胞周期阻滞,一项I期临床试验表明γ-分泌酶抑制剂用于硬纤维瘤患者中,可取得较好的疗效[17]。本研究发现,滑膜肉瘤中Notch 通路被过激活,因此,推测其抑制剂也可能对滑膜肉瘤发挥抑制效果。为了进一步检测γ-分泌酶抑制剂对于滑膜肉瘤的抑制效果,本研究采用DAPT处理SW982细胞,结果发现其增殖受到明显抑制。随后对Notch信号通路是否能影响SW982细胞迁移进行研究,与设想一致,DAPT处理SW982细胞48 h后,SW982迁移能力同样明显被削弱。上述结果高度提示Notch信号通路在滑膜肉瘤细胞SW982中扮演促进肿瘤发生发展的角色。
尽管如此,本研究仍具有一定局限性。第一,未能将Notch信号通路抑制剂与临床化疗药物联合应用观察对滑膜肉瘤细胞SW982的影响;第二,Notch信号通路是否能影响滑膜肉瘤细胞SW982体内的增殖和侵袭能力未知,需要后续的动物实验继续探究;第三,Notch 本身受体及配体类型较多,本研究证实,NOTCH-1在滑膜肉瘤的增殖侵袭中发挥重要作用,但与之相关的配体尚需进一步研究。相信随着 Notch 分子生物学的进一步研究,将为包括滑膜肉瘤在内的软组织肿瘤的诊断和治疗提供新思路和实验依据。
