血清胆碱酯酶评估炎症性肠病活动度的价值分析
2019-03-27陆世珉苏乐乐马静静季梦瑶董卫国
陆世珉,田 山,苏乐乐,马静静,李 娇,季梦瑶,董卫国
武汉大学人民医院消化内科,湖北 武汉 430060
炎症性肠病(inflammatory bowel disease,IBD)是一种病因尚不十分清楚的慢性、非特异性肠道炎性反应性疾病。近年来我国IBD发病率逐渐升高,已成为消化系统的常见病。准确评估IBD患者的疾病活动度对诱导并维持临床缓解起着至关重要的作用[1]。胆碱酯酶(cholinesterase,ChE)是由肝脏合成的一类糖蛋白,分为乙酰胆碱酯酶和丁酰胆碱酯酶。中枢神经系统中ChE主要为乙酰胆碱酯酶,通过降解乙酰胆碱确保神经信号的正常传递。外周血中主要为丁酰胆碱酯酶,浓度约为乙酰胆碱酯酶的10倍,其还存在于神经胶质细胞、心脏、肝脏、肾脏及肠道中[2]。近年来有研究发现ChE与IBD的发生、发展有关[3-5]。现分析IBD患者血清ChE水平并评估其在IBD疾病活动度中的应用价值及其临床意义。
1 资料与方法
1.1一般资料IBD组:选取2016年2月至2018年2月武汉大学人民医院胃肠外科和消化内科诊治为:(1)CD亚组患者57例,男34例,女23例,年龄(34.26±14.42)岁(18~73岁),其中病程<1年者21例,1~3年者23例,>3年者13例。并发症:肛瘘或肛周脓肿9例,肠梗阻或肠穿孔9例,外周关节疼痛1例,口腔复发性溃疡3例。(2)UC亚组患者94例,男55例,女39例,年龄(45.65±13.80)岁(20~77岁),并发症:原发性硬化性胆管炎1例,类风湿性关节炎1例,原发性Graves病1例,高血压4例,糖尿病7例。诊断标准[1]参照中华医学会消化病学分会炎症性肠病学组制定的《炎症性肠病诊断与治疗的共识意见(2012年·广州)》。
健康对照组:选取本院同期健康体检者150名作为对照组(体检结果无异常),男90名,女60名,年龄(43±10.1)岁(19~70岁)。IBD组与对照组年龄、性别比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准(2018K-C009),患者及家属同意并签署知情同意书。
1.2纳入及排除标准(1)粪便常规、粪便培养排除肠道致病菌和真菌感染,通过相关检查排除结核分枝杆菌感染及人类疱疹病毒4型、巨细胞病毒、HBV、HCV、HIV等病毒感染;(2)血、尿常规和胸部X线片检查排除感染可能;(3)排除妊娠、自身免疫病、血液系统疾病、恶性肿瘤、慢性肝肾疾病,及合并严重心脑肺等疾病者。
1.3观测指标
1.3.1 临床资料:包括性别、年龄、病程、肠外表现、有无手术治疗、分期;IBD疾病活动度:CD活度指数(CDAI)及UC活动指数Mayo评分等[1]。
1.3.2 生化资料:超敏C反应蛋白(hsCRP)、红细胞沉降率(ESR)、血小板计数(PLT)、白蛋白(ALB)、血清ChE等炎性指标,通过静脉穿刺法抽取清晨空腹血液,分装入3只试管:无抗凝、柠檬酸钠抗凝、乙二胺四乙酸二钾(EDTA-K)抗凝。无抗凝血试管及时离心并分离血清,离心率3 000 r/min,离心10 min,采用ADVIA2400全自动化临床化学分析仪(德国西门子,德国)检测ChE、ALB;采用免疫浊度分析仪检测hsCRP。柠檬酸钠抗凝血试管采用Vaeuette全自动血沉分析仪 (奥地利格雷那公司)检测ESR。EDTA-K抗凝血试管采用Bayer Advia 2120全血细胞分析仪 (德国西门子公司)检测PLT、Hb和HCT水平。
2 结果
2.1临床资料CD亚组中,确诊年龄≤16岁 3例,17~40岁40例,>40岁14例。病变部位:回肠13例,回肠末14例,回结肠28例,上消化道2例。活动度按CDAI[1]评估:缓解期(<150分)16例,轻度活动期(150~220分)18例,中度活动期(221~450分)22例,重度活动期(CDAI >450分)1例。UC亚组中,病变部位:直肠7例,左半结肠40例,全结肠47例;活动度按Mayo[1]指数评估:轻度活动期(3~5分)29例,中度活动期(6~10分)54例,重度活动期(11~12分)11例。
2.2血清ChE水平比较组间血清ChE比较:IBD组ChE水平均低于对照组,差异有统计学意义(P<0.05)。UC亚组与CD亚组比较,差异无统计学意义(P=0.635,见表1)。
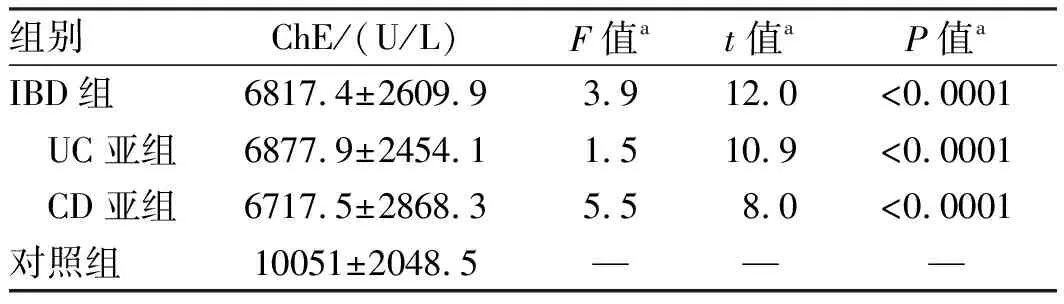
表1 各组血清ChE水平比较Tab 1 Comparison of serum ChE level in each group
注:a为与对照组比较。
2.3疾病不同活动期炎性因子及ChE的比较CD亚组、UC亚组中,中、重度活动组与非中、重度活动组(即缓解组和轻度活动组)比较,ChE、ESR、hsCRP、HCT水平差异均有统计学意义(P<0.05)。PLT水平仅在CD亚组中差异有统计学意义(P=0.006),UC亚组中PLT水平差异无统计学意义(P>0.05,见表2)。
2.4血清ChE与炎性指标及蛋白的相关性CD患者中,血清ChE与hsCRP、CDAI、PLT呈负相关;血清ChE与ALB呈正相关;血清ChE与ESR、HCT、Fn均无相关性(P>0.05)。UC患者中血清ChE与hsCRP、ESR、PLT、Mayo评分均呈负相关;血清ChE与HCT、ALB均呈正相关(见表3)。
表2 CD组、UC组及其疾病不同活动期炎性因子及ChE的比较 Tab 2 Comparison of inflammatory factors and ChE in different active stages of CD subgroup and UC subgroup
注:CD亚组中,与中、重度活动组比较,*P<0.05;UC亚组中,与中、重度活动组比较,ΔP<0.05。
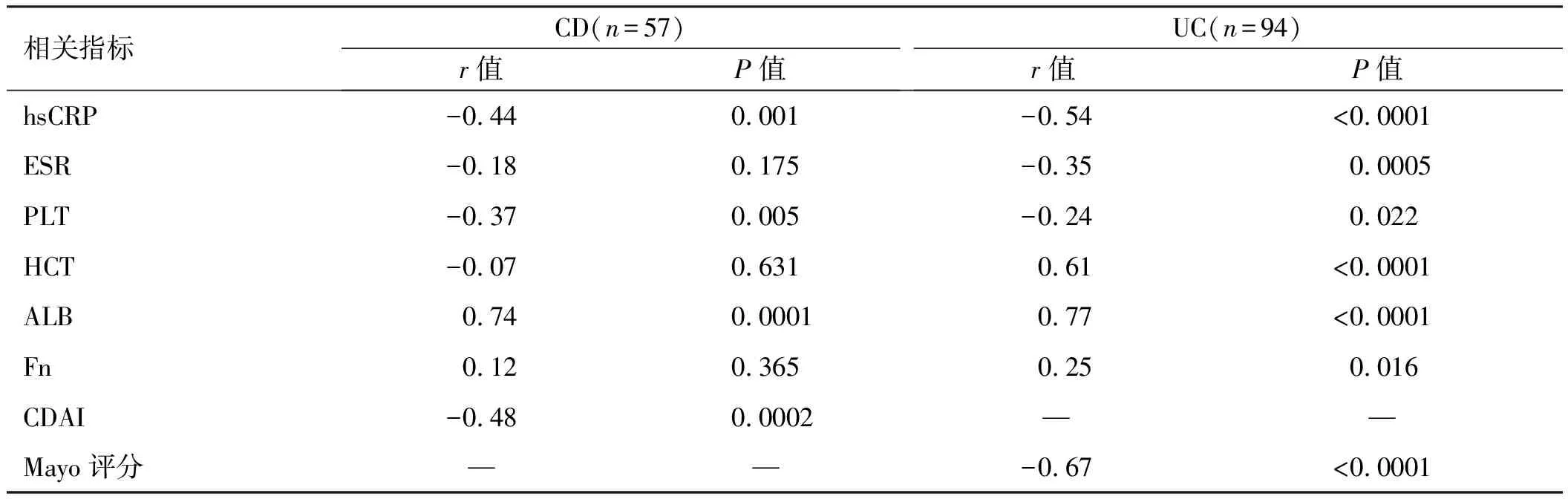
表3 CD及UC患者血清ChE与疾病活动度相关性 Tab 3 Correlation between serum ChE and disease activity in patients with CD and UC
2.5血清ChE诊断IBD的价值如图1所示,预测IBD的ROC曲线下面积为0.841,最佳界值为血清ChE≥7 612 U/L,敏感度为86.7%,特异度为68.2%,此时约登指数为0.549。各项炎症指标预测中、重度UC、CD的ROC曲线下面积如表4所示。预测中、重度CD的ROC曲线下面积为0.797,最佳界值为血清ChE≥6 514 U/L,敏感度为67.6%,特异度为83.6%,此时约登指数为0.502。预测中、重度UC的ROC曲线下面积为0.814,最佳界值为血清ChE≥7 418 U/L,敏感度为79.3%,特异度为73.9%,此时约登指数为0.532(见图2~3)。
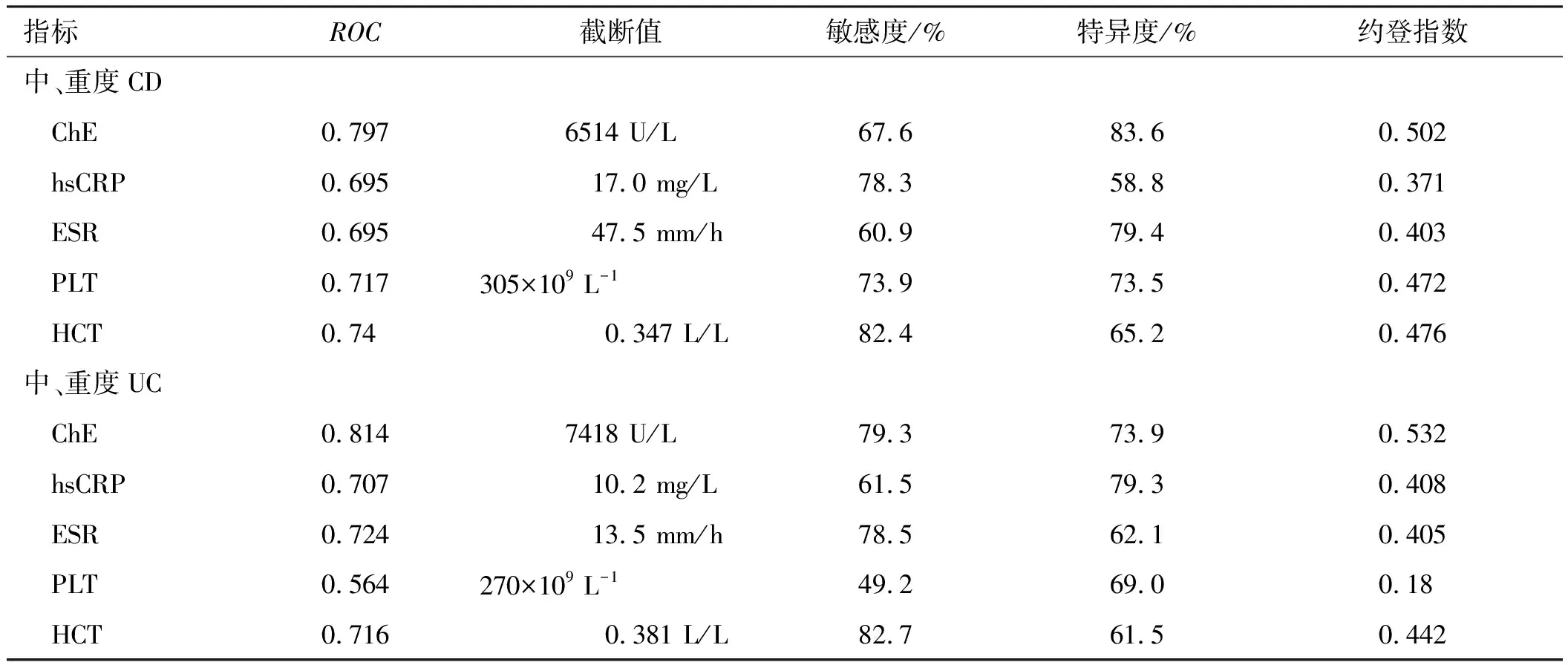
表4 血清ChE诊断IBD患者疾病活动度价值分析Tab 4 Analysis of value of serum ChE in diagnosing disease activity in patients with IBD
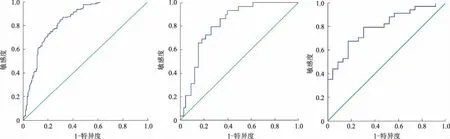
图1血清ChE水平诊断IBD的ROC曲线;图2血清ChE诊断中、重度UC患者的ROC曲线;图3血清ChE诊断中、重度CD患者的ROC曲线
Fig1ROCcurveofserumChEleveldiagnosisofIBD;Fig2PerformancecurveofpatientswithmoderatetosevereUCin
serumChEdiagnosis;Fig3PerformancecurveofpatientswithmoderatetosevereCDinserumChEdiagnosis
3 讨论
本研究发现,IBD患者的血清ChE水平明显下降,首次发现血清ChE水平对IBD及其中、重度活动度的诊断有很好的评估价值。此外本研究还发现,ChE水平与多种炎症因子(ESR、PLT、HCT、hsCRP)、ALB、疾病的活动指数(CDAI、Mayo评分)明显相关。
血清ChE作为肝脏合成的一类糖蛋白,是反映肝功能的重要指标[2],近年来研究IBD、全身炎症反应、肺炎等多种疾病中可观察到血清ChE水平的变化[3-5]。MAHARSHAK等[3]纳入77例IBD患者研究发现重度活动度的IBD患者血清ChE水平明显低于轻度及缓解期患者,且与炎症因子hsCRP呈负相关。这与本研究结果一致。该研究还发现,肠活检炎症组织中微小核糖核酸132(miR-132)水平明显高于非炎性组织,而miR-132的作用是调节局部ChE的表达,其水平变化反映的是提高乙酰胆碱浓度从而增强胆碱抗炎通路抵抗炎症反应的机体代偿表现。
多项研究发现,血清ChE水平间接反映的是乙酰胆碱及体内胆碱抗炎通路的水平[2,6]。如ARBEL等[7]进行有关不良心血管事件患者的血清ChE活性研究中,发现血清ChE水平降低是胆碱能神经功能障碍的表现,并可作为患者预后的预测指标。ASSAYAG等[8]研究也提示,血清ChE水平的降低是脑梗死患者体内胆碱能抗炎通路激活的表现,且血清ChE水平过低可能预示着胆碱能危象,而血清ChE低水平患者的预后差、生存率低。
IBD作为慢性非特异性炎性反应性疾病,由多种免疫细胞及炎症因子参与[1, 9]。胆碱抗炎通路作为可调节固有免疫的经典神经环路,参与多种免疫性及炎性反应性疾病(如干燥综合征、哮喘、类风湿性关节炎等)的发生与发展,且恢复胆碱能平衡有助于治疗这些疾病[10-12]。胆碱抗炎通路作用于免疫系统,主要依赖于表达在多种免疫细胞(如巨噬细胞、单核细胞、内皮细胞、上皮细胞、树突状细胞、T淋巴细胞和B淋巴细胞等)上的特异性尼古丁-乙酰胆碱受体(α7nAChR受体)。细胞因子或炎症产物引发产生乙酰胆碱并结合于该受体,从而发挥多重效应:(1)减少核转录因子(NF-κB)表达;(2)调节单核细胞、巨噬细胞中细胞因子的释放;(3)调节中性粒细胞、T细胞等的趋化、动员、招募等作用,从而抑制炎症反应[13-14]。在小鼠结肠炎模型中,刺激胆碱抗炎神经通路会增加乙酰胆碱水平,并显著降低髓过氧化物酶(myeloperoxidase,MPO)、诱导型一氧化氮合酶(iNOS)的水平;抑制肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转录因子蛋白家族(NF-κB)中 p65的活化;抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路;与对照组相比,刺激胆碱抗炎通路的结肠炎小鼠肠道炎症浸润减轻和体质量下降[15-16]。血清ChE水平下降可能与IBD患者体内多种细胞因子、炎症反应引起胆碱抗炎通路增强,以致机体主动下调ChE活性而产生的代偿反应有关:其血清ChE水平体现的是体内水解乙酰胆碱总能力的变化[3,6]。且BAHLOUL等[17]研究发现,血清ChE水平在诊断脓毒性休克时,较降钙素原和CRP更为准确,并具有更高的敏感度和特异度。另外,IBD的临床特点之一为肠道出血、营养不良,并发ALB的丢失也可能是血清ChE水平降低的原因之一。且中、重度活动度患者中细胞因子增多、炎性反应增强、营养不良的显著可能导致血清ChE进一步下降。
当然,本研究仍存在不足之处,具体如下:(1)患者的样本量较小,有待扩大样本量进一步验证;(2)本研究为回顾性病例对照研究,难免存在偏倚;(3)本研究未探究疾病并发症,以及既往治疗如手术、激素、生物制剂等对ChE的影响;(4)缺乏患者的随访资料,未能深入探究IBD患者血清ChE的动态变化。
综上所述,血清ChE作为简便、经济、无创的方法,可帮助诊断疾病及疾病所处不同疾病期。而随着生物医学对胆碱抗炎通路、ChE研究的深入,其也有望成为IBD免疫学治疗的新靶点。
