肠道菌群与胆汁酸的相互作用在炎症性肠病中的研究
2019-03-27余顺滢闫慧姣李华军
余顺滢, 闫慧姣, 李华军
1.大连医科大学,辽宁 大连 116044;2.大连医科大学微生态学教研室
炎症性肠病(inflammatory bowel disease,IBD)是一种慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD)[1]。欧洲、北美、中国和中东地区UC最高发病率分别为24.3/10万、19.2/10万、6.3/10万;CD最高发病率分别为12.7/10万、20.2/10万、5.0/10万[2]。提示IBD常见于西方国家且存在东西方地区差异。2013年武汉IBD、UC、CD的发病率分别为1.96/10万、1.45/10万、0.51/10万[3]。2014年大庆IBD、UC、CD的发病率分别为1.77/10万、1.64/10万、0.13/10万[4]。表明IBD的发病率存在南北方地区差异。造成地区差异性发生的原因可能与饮食习惯、气候、生活方式的不同有关。
虽然诊断水平提升,人民生活水平提高,环境与饮食结构发生改变,但我国IBD的发病率和患病率却逐年增加[5]。1990年至2003年的一项11省市23家医院多中心回顾性调查所报道的病例数为3 100例[6],是1990年病例数的2.78倍[7]。云南一项1998年至2013年的回顾性调查结果也显示,UC、CD的发病率和患病率均逐年增加[8]。IBD逐渐成为现代社会的常见病,所以亟需探明其发病机制及治疗方法。
IBD的发生极有可能是遗传、感染、环境、免疫等相互作用造成的。随着进一步的研究发现,在生理情况下,肠道菌群与胆汁酸的相互作用有助于维持宿主体内稳态。而肠道菌群失调则可导致胆汁酸代谢障碍,胆汁酸代谢紊乱也可改变肠道菌群的组成与分布。这种病理情况下的相互作用损伤了宿主体内正常的生物转化过程,抑制正常代谢产物的生成,扰乱正常的信号通路,破坏宿主体内正常的屏障功能和内环境稳态,逐渐被认为是导致IBD发生的原因之一。
1 肠道菌群与胆汁酸的相互作用
1.1肠道菌群与胆汁酸在生物转化中的相互作用胆汁酸是胆固醇的一种代谢产物,餐后胆囊收缩,胆汁酸被释放到十二指肠并在肠道菌群的作用下进行进一步代谢[9]。拟杆菌(Bacteroidetes)、双歧杆菌(Bifidobacterium)等通过胆盐水解酶(bile salt hydrolases, BSHs)对结合胆汁酸进行早期解离,具有bile acid-inducible(bai)的梭菌(Clostridium)、真细菌(Eubacterium)等再对其进行7-脱羟基反应生成次级胆汁酸。次级胆汁酸是人粪便中主要的胆汁酸成分,血液、胆汁和粪便中高浓度的次级胆汁酸会增加胆固醇结石病、结肠癌的发病风险,适当浓度的次级胆汁酸则具有免疫调节作用[10](见表1)。
白色念珠菌(Candidaalbicans)是人胃肠道中常见的机会致病菌,可导致免疫力低下的人发生危及生命的感染,是导致医院感染发生的第四大常见原因[11]。GUINAN等[12]证实,次级胆汁酸如石胆酸(lithocholic acid,LCA)和脱氧胆酸(deoxycholic acid,DCA)可以抑制80%白色念珠菌的生长并抑制其芽管、菌丝、生物膜的形成。此外还可降低白色念珠菌黏附于结肠癌细胞系HCT116细胞的百分比。
与健康人相比,IBD患者体内厚壁菌门丰度降低导致次级胆汁酸的含量减少,减弱了次级胆汁酸的抗炎作用,延缓了炎症愈合[13]。
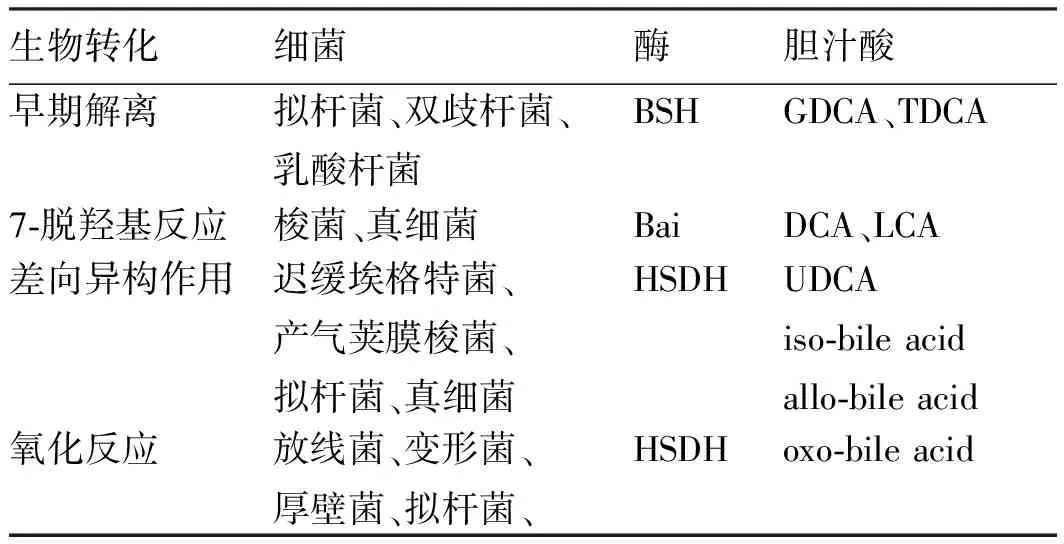
表1 参与胆汁酸代谢的细菌和酶Tab 1 Bacteria and enzymes involved in bile acid metabolism
注:GDCA:Glycodeoxycholic acid,甘氨脱氧胆酸;TDCA:Taurodeoxycholicacid,牛磺脱氧胆酸;DCA:deoxycholic acid,脱氧胆酸;LCA:lithocholic acid,石胆酸;UDCA:ursodeoxycholic acid,熊脱氧胆酸;HSDH:hydroxysteroid dehydrogenase,羟类固醇脱氢酶。
1.2肠道菌群产生的短链脂肪酸(short-chainfattyacids,SCFAs)在胆汁酸代谢调节中的信号分子作用SCFAs是一种主要由膳食纤维等不易消化的食物在结肠由乳酸菌等有益菌发酵产生的脂肪酸,可分为乙酸、丙酸、丁酸等。乙酸盐和丙酸盐通过上调G蛋白偶联受体(G-protein coupled receptors,GPCRs)GPR43依赖性GPR15的表达,促进Tregs在结肠的迁移。丁酸盐可以有效抑制组蛋白脱乙酰酯(histone deacetylates,HDACs)的表达。HDAC9受到抑制后,Fox3p的表达增加,促进了Tregs的增殖与表达,从而发挥免疫调节的作用[14]。此外,HDACs受到抑制后通过调节NF-κB,抑制巨噬细胞、树突状细胞等固有免疫细胞产生促炎细胞因子,发挥抗炎作用[15]。
抗菌肽(antimicrobial peptide,AMP)是一种由肠上皮细胞(intestinal epithelial cell,IEC)产生的物质,可以作为人体抵抗微生物和机会致病菌的第一道防线,有助于保持肠道稳态,包括RegⅢγ和β-防御素等[16]。ZHAO等[17]研究发现,与野生型小鼠相比,缺乏GPR43的小鼠体内RegⅢγ和β-防御素1、3、4的表达降低。以丁酸盐灌胃小鼠后,丁酸盐通过与GPR43结合,激活mTOR通路、信号传导和转录激活因子3(signal transducer and activator of transcription 3,STAT3),促进IEC产生RegⅢγ和β-防御素,维持肠道稳态。此外,丁酸盐促进IEC产生AMP的同时又反过来促进其体内普雷沃氏菌科(Prevotellaceae)的丰度下降,提示丁酸盐可以通过调节微生物组成发挥抗炎作用。
1.3肠道菌群与FXR、TGR5法尼醇X受体(farnesoid X receptor, FXR)是一种胆汁酸调节转录因子,也是肝细胞和胃肠道组织的保护性传感器[18]。FXR在肠道被胆汁酸激活后,促进成纤维细胞生长因子19(fibroblast growth factor 19,FGF19)的表达与释放,FGF 19循环回肝脏与FGF受体4(FGF receptor 4,FGFR4)结合后抑制胆汁酸合成限速酶CYP7A1的表达,从而抑制胆汁酸的合成,维持胆汁酸在体内的平衡[19]。INAGAKI等[20]进一步研究发现,将FXR敲除小鼠与野生型小鼠的胆管结扎后,野生型小鼠对FXR配体GW 4046的敏感性强于FXR敲除小鼠。以GW 4046灌胃后,野生型小鼠屏障的完整性逐渐恢复,细菌过度生长和移位的现象改善,具有抗菌特性的iNOS、IL-18、Angl的表达增加。这提示FXR具有改善胆汁酸代谢失衡与维持体内环境稳态的作用。此外,DEGIROLAMO等[21]实验发现,以VSL#3制剂灌胃小鼠后其体内厚壁菌和放线菌的数量增加,并通过抑制FXR-FGF15的表达,促进胆汁酸的早期解离和排出并促进肝脏重新合成胆汁酸,从而维持胆汁酸的代谢平衡。
G蛋白偶联胆汁酸受体5(G protein coupled bile acid receptor 5, TGR5)是一种高表达于肠道组织和免疫细胞的G蛋白偶联受体,被胆汁酸激活后可以与FXR共同维持黏膜屏障的完整性与肠道稳态[22]。TGR5被激活后细胞内第二信使环腺苷酸(cyclic AMP,cAMP)的表达增加,可以抑制LPS刺激巨噬细胞分泌细胞因子。此外,位于巨噬细胞上的TGR5被激活后,可以降低NF-κB的活化,这一过程反过来可以被蛋白激酶A(protein kinase A,PKA)的抑制剂所阻断。因此,TGR5-cAMP-PKA的激活可以共同降低NF-κB的活化。然而在非炎症状态下,TGR5激活后将诱导促炎细胞因子如IL-1β、TNF-α的表达。TGR5的这种双重作用可能是保护机体免受异常升高的胆汁酸的毒性作用的一种机制,但其具体作用机制仍需进一步研究证实[23]。
2 肠道菌群与胆汁酸在IBD中的相互作用
IBD发生时,患者体内的球形梭菌(Clostridiumcoccoides)、柔嫩梭菌(Clostridiumleptum,C.leptum)和普拉梭菌(Faecalibacteriumprausnitzii)等厚壁菌门的细菌数量明显降低[24]。同时,患者体内早期解离、转化和脱硫反应的活性降低,导致次级胆汁酸含量降低,3-OH硫化次级胆汁酸含量增加。次级胆汁酸的减少使其本身的抗炎能力下降,3-OH硫化次级胆汁酸的增加进一步妨碍了次级胆汁酸的抗炎作用,加重慢性炎症反应[13]。
此外,IBD发生时固有免疫系统被激活,促炎细胞因子和抗炎细胞因子的分泌失调。巨噬细胞(macrophage)是胃肠道调节细胞因子分泌的主要调控因子。M1型巨噬细胞具有促炎效应并分泌IL-1β、IL-6、IL-12等炎症因子,激活TH17和TH1。而M2型巨噬细胞具有免疫抑制效应,可以诱导IL-10的产生并激活Tregs。胆汁酸激活TGR5后可以使巨噬细胞表现出一种以M2型免疫抑制为主的“混合表型”。SRC激酶通过激活信号传导和STAT3,抑制TH17和TH1的激活,减少TNF、IFNβ、IL-6、IL-12的表达,增加IL-10和转化生长因子β(TGFβ)的表达,从而促进M2型巨噬细胞发挥抗炎能力。此外,胆汁酸激活TGR5后还可激活cAMP通路,cAMP则进一步激活PKA,从而上调cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的表达和活性。FOS是CREB的一种重要的靶基因产物,CREB一方面使FOS与激活的NF-κB p65亚基结合,抑制其转移到细胞核,缓解炎症过程。另一方面,CREB通过产生IL-10等细胞因子进而发挥免疫抑制效应,起到抗炎作用。
肠道发生炎症时肠道屏障受损,FXR的表达降低,FGF19-FGFR4信号通路受到抑制,导致肠胆汁酸结合蛋白(intestinal bile acid-binding protein,IBABP)与胆汁酸转运蛋白有机溶质转运体α亚单位(organic solute transporter subunit α,OSTα)和OSTβ的表达下调,钠盐依赖的胆汁酸转运体(apical sodium-dependent BA transporter,ASBT)表达上调。同时,IBABP转运的蛋白表达降低,导致肠上皮细胞向OSTα-OSTβ复合物转运的胆汁酸减少,通过门静脉返回肝脏的胆汁酸也相应减少,从而扰乱肠肝循环,使胆汁酸积聚在肠黏膜,加重了肠道炎症[25]。
3 胆汁酸与微生态制剂在IBD治疗中的应用
VAN DEN BOSSCHE 等[26]实验证明,将熊脱氧胆酸(ursodeoxycholic acid,UDCA)、牛磺熊脱氧胆酸(tauroursodeoxycholic acid,TUDCA)、甘氨熊脱氧胆酸(glycoursodeoxycholic acid,GUDCA)灌胃于以葡聚糖硫酸钠(dextra sulfate sodium,DSS)诱导的IBD小鼠后可以使其体内厚壁菌门与拟杆菌门的比例趋于正常,同时减轻其体质量下降程度、疾病活动度、结肠缩短程度并降低结肠和血清中促炎细胞因子的浓度。此外,人粪便中分离出的80%的产丁酸盐菌和Clostridiumspp.属于梭菌属ⅩⅣa。UDCA、TUDCA、GUDCA灌胃后可以促进小鼠体内梭菌属ⅩⅣa的生长,从而促进丁酸盐发挥抗炎能力并有利于Clostridiumspp.诱导结肠Tregs的产生,激活人体的免疫系统,起到抗炎效果。
现阶段氨基水杨酸类制剂、肾上腺糖皮质激素、免疫抑制剂等药物对IBD有较好的疗效,但其作用效果及远期疗效均存在局限。微生态制剂具有修复黏膜屏障、增强肠道免疫等作用,逐渐成为IBD治疗的新选择。
益生菌是一种在肠道增殖并对人体有益的活的微生物[27],可以通过重建肠上皮屏障功能、调节适应性免疫和抑制病原体黏附于结肠上皮细胞等作用缓解IBD。
IBD发生时,患者的肠黏膜屏障均出现不同程度的受损。婴儿双歧杆菌(Bifidobacteriuminfantile)可以增加极化肠上皮细胞的跨膜电阻(transepithelial electrical resistance,TER),TER的升高与肠黏膜屏障完整性的恢复程度呈正相关,从而有利于恢复黏膜的完整性。此外,将嗜酸乳杆菌13(Lactobacillusacidophilusstrain13)和长双歧杆菌33(Bifidobacteriumlongumstrain33)灌胃于三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)诱导的IBD小鼠后,小鼠体内Tregs的数量增加,上皮内淋巴细胞的数量减少,起到减轻炎症的作用。将嗜酸乳杆菌R0052(LactobacillusacidophilusstrainR0052)和鼠李糖乳杆菌R0011(LactobacillusrhamnosusstrainR0011)添加到IBD小鼠的饮食后可以通过减少病原菌与结肠上皮细胞的黏附从而缓解IBD[28]。
益生元是一类不易消化的食品配料,包括菊粉(Inulin)、低聚果糖(Fructooligosaccharides,FOS)、低聚半乳糖(Galacto-oligosaccharides,GOS)和乳果糖(Lactulose)等[27]。DSS诱导的IBD小鼠接受菊粉灌胃后其体内的丁酸盐等SCFAs合成增加,减轻了炎症对肠黏膜细胞的损伤。此外,菊粉使小鼠体内双歧杆菌、乳酸杆菌数量增加,梭菌、拟杆菌的数量减少。结肠的酸性范围与黏膜损伤的缓解程度相关,丁酸盐等SCFAs和乳酸杆菌的增加降低了肠道pH值并将酸性环境的范围延伸到末端结肠,减轻黏膜损伤的程度。过度生长的梭菌与拟杆菌是导致IBD发生的原因之一,菊粉的添加减少了IBD小鼠体内这两种菌的数量,进一步缓解了IBD[29]。一项UC患者服用双歧杆菌与GOS混合制剂的临床试验显示,与对照组相比,服用混合制剂的治疗组内镜评分、髓过氧化物酶、拟杆菌数量与粪便pH显著降低。提示GOS有助于改善UC患者的症状,但针对GOS具体的作用机制还有赖于进一步研究证实[30]。乳果糖是一种最初被用于缓泻药的物质,现发现服用乳果糖后可以增加体内双歧杆菌与乳酸杆菌的数量并显著降低拟杆菌的数量,有望未来成为治疗IBD的新选择[31]。
微生态制剂大多属于天然化合物且来源广泛、不良反应少,但其作用能力有限,现只能作为常规药物治疗的辅助治疗,有效且实用的微生态制剂还有望未来进一步研究发现。
