Aiolos基因多态性与贵州汉族人群系统性红斑狼疮的相关性*
2019-03-26杨莹杨英陈晓红陈林梁翰月罗丽贾常莎陈永艳晏文
杨莹, 杨英, 陈晓红△, 陈林, 梁翰月, 罗丽, 贾常莎, 陈永艳, 晏文
1遵义医学院附属医院皮肤科 (贵州遵义 563000); 2遵义医学院第二附属医院皮肤科(贵州遵义 563000); 3遵义市第一人民医院皮肤科(贵州遵义 563002)
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种多基因的疾病,多种基因表达的异常导致B淋巴细胞和(或)调节细胞如T细胞、树突状细胞功能失调,促使B细胞产生病理性自身抗体[1-4]。SLE遗传发病机制中其发病率和患病率在不同地区、种族有很大差异。Aiolos基因(IKZF3)基因位于染色体17q21区域,其编码的Aiolos蛋白是锌指蛋白家族的成员,对T、B淋巴细胞以及自然杀伤细胞的发育具有重要作用。近年来,Aiolos基因被发现是多种免疫相关疾病的候选基因[5-7]。目前一些研究提示Aiolos基因多态性(single nucleotide polymorphisms,SNP)可能与SLE有关[8]。为研究贵州汉族人群Aiolos基因多态性与SLE相关性,我们选择Aiolos基因rs9909593、rs9635726及rs12150079 3个SNP位点,利用SNaPshot法对其进行基因分型,探讨其与SLE发病风险的关系。
1 资料与方法
1.1 一般资料 选取SLE患者213例(SLE组),来自遵义医学院附属医院2014年10月至2017年10月就诊的门诊和住院患者,其中男16例,女197例,年龄8~68岁,平均(32.93±12.15)岁。所有纳入研究对象均符合1997年美国风湿病学会修订的SLE分类和诊断标准[9]。187例健康对照组为同一时期在我院体检的正常健康人群,其中男16例,女171例,年龄12~69岁,平均(33.48±10.61)岁。两组年龄、性别构成差异均无统计学意义(P>0.05),且其一、二、三级亲属中均无SLE患者。所有纳入对象均为贵州汉族人,无亲缘关系,无近期有感染及其他免疫性疾病。本研究获本院伦理委员会批准,所有的研究对象均签署知情同意书。
1.2 SNP位点选择 根据HapMap dbSNP数据库(www.hapmap.ncbi.nlm.nih.Gov)及查阅相关文献,我们选择标签SNP(rs9909593、rs9635726、rs12150079)纳入本研究,3个SNP位点均满足:(1)选择SLE有相关性的单核苷酸多态性;(2)位点在中国人群的最小等位基因频率(MAF)均>0.05。
1.3 实验步骤
1.3.1 标本采集及基因组DNA提取 采集SLE患者及健康对照者外周静脉血2 mL置于乙二胺四乙酸二钾(EDTA-K2)真空抗凝管中,根据Magen DNA提取试剂盒说明书提取白细胞基因组DNA,并标记置于-80℃低温冰箱保存备用。
1.3.2 SNaPshot基因分型
1.3.2.1 PCR扩增引物及SNaPshot引物设计及合成 参照GenBank中Aiolos基因的引物序列查找Aiolos基因rs9909593、rs9635726、rs12150079 3个位点的引物序列,运用primer5.0设计引物,由北京六合华大基因科技有限公司合成提供,见表1~2。
1.3.2.2 多重PCR PCR反应体积为30 μL,包括10×DNA聚合酶缓冲液3 μL,dNTP 2 μL,基因组DNA 2 μL,Taq DNA聚合酶0.2 μL,引物混合1 μL,H2O 20.8 μL。多重PCR扩增条件为96℃预变性2 min,96℃变性20 s,54℃退火10 s,72℃延伸30 s,反应35个循环,再次72℃延伸2 min,4℃保存。
1.3.2.3 PCR产物纯化 采用美国ABI公司生产的SAP和Exo Ⅰ进行。反应体系为8 μL,其中PCR产物为6 μL,酶混合液2 μL(含2U SAP和2U Exo Ⅰ);反应条件:37℃孵育保温1 h,然后75℃保温15 min以灭活SAP和Exo Ⅰ酶,纯化好后进行单碱基延伸反应,预先混好延伸引物。
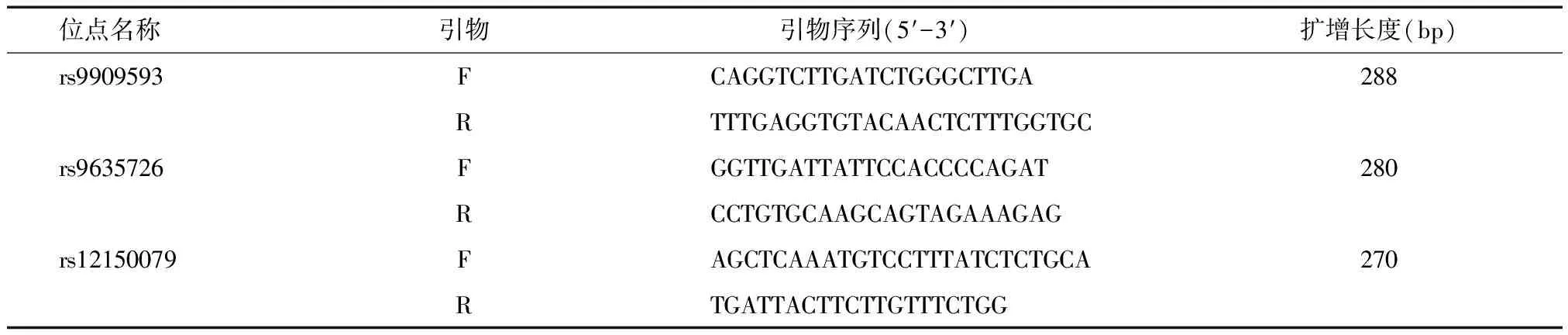
表1 PCR 扩增引物
F:正向扩增引物;R:反向扩增引物

表2 SNaPshot单碱基延伸引物
1.3.2.4 SNaPshot反应 采用美国ABI公司生产的ABI PRISM SNaPshot Muhiplex Kit进行。反应体系为5 μL,其中PCR产物为3 μL,SNaPshot Mix 0.5 μL,延伸引物混合1 μL;反应条件为95℃预变性2 min,95℃变性10 s,50℃退火5 s,60 ℃延伸30 s,反应35个循环,12℃保存。
1.3.2.5 SNaPshot反应产物纯化 SNaPshot延伸产物用SAP纯化。在5 μL上述SNaPshot PCR产物中加入0.5 U SAP,震荡混匀,37℃保温1 h,75℃保温15 min以灭活SAP,4℃可保存24 h 或-20℃长期保存。
1.3.2.6 采用ABI 3730XL测序仪测序分型产物 取1 μL SNaPshot延伸产物,加入Hi-Di Formamide 6.5 μL、GS-120LIZ 0.5 μL,上机经ABI 3730XL检测,使用GENEMarker软件分析峰图结果。为保证分型的准确度,随机挑选8例样本进行双向测序,均未发现分型错误。3个位点的分型成功率为98%。测序与基因分型由北京六合华大基因科技有限公司完成。
1.3.2.7 连锁不平衡和单体型分析 利用SHEsis 软件对Aiolos基因rs9909593、rs9635726、rs12150079 3个位点SNP进行连锁不平衡和单体型分析。
1.4 统计学方法 所有的SNP分型数据质控、等位基因和基因型分布频率比较采用SPSS 17.0统计软件。SLE组和健康对照组分别进行Hard-Weinberg遗传平衡检验。各等位基因和基因型个数采用直接计数法计算,多态性位点各等位基因和基因型分布频率比较用2检验,并计算等位基因相对危险度的比值比(OR值)及其95%可信区间(95%CI),采用非条件logistic回归模型分析等位基因的在多个遗传模型(加性、隐性、显性)下基因与疾病易感性,以P<0.05为差异有统计学意义。连锁不平衡和单体型分析采用SHEsis在线软件进行处理,以P<0.05为差异有统计学意义。
2 结果
2.1 样本及SNP质控 SNaPshot延伸反应:产物经ABI 3730XL扫描,结果显示400个样本均获得良好的分型结果。Aiolos rs9909593、rs9635726及rs12150079这3个位点在SLE组和健康对照组中的基因型频率进行Hard-Weinberg遗传平衡检验,结果显示所有位点均符合Hard-Weinberg遗传平衡定律(P>0.05),说明样本具有群体代表性,见表3。
2.2 SNaPshot PCR扩增产物测序结果 Aiolos rs9909593、rs9635726及rs12150079位点基因型扩增产物测序图分别见图1~3。通过峰的颜色判断碱基类型,通过峰的数量判断杂合还是纯合。其中蓝色、绿色、红色、黑色峰分别代表G、A、T和C碱基,单峰表现为纯合子,双峰表现为杂合子。
2.3 Aiolos 3个SNP位点基因型频率、等位基因频率分布及遗传模式分析 检测的Aiolos rs9909593、rs9635726及rs12150079 SNP位点中基因型频率和等位基因频率的分布在SLE组与健康对照组间,差异均无统计学意义(P>0.05);对上述3个SNP采用非条件logistic回归模型分析等位基因的在多个遗传模式(加性、隐性、显性)下进行不同遗传模型分析结果显示,在SLE组与健康对照组间,差异均无统计学意义(P>0.05)。见表4。
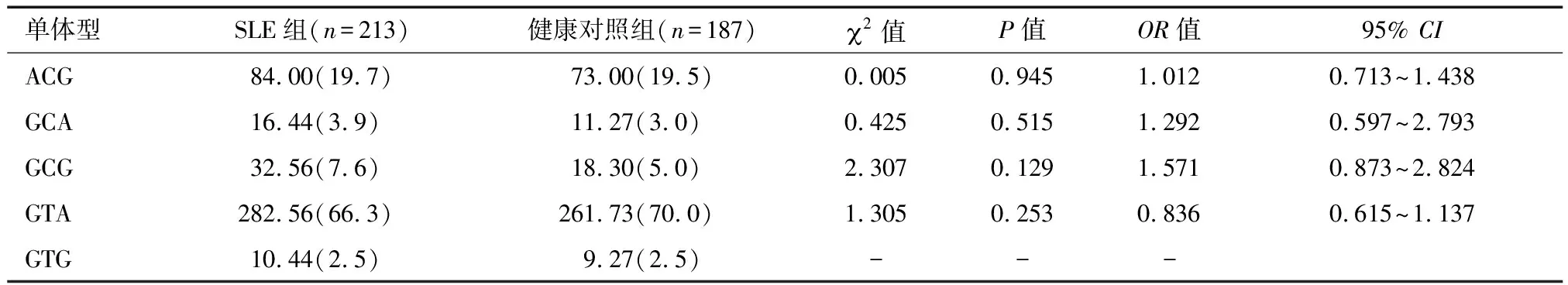
2.4 连锁不平衡检验和单体型分析 对rs9909593、rs9635726、rs12150079这3个SNP 进行两两间连锁不平衡检验,rs9909593与rs12150079、rs9635726与rs12150079存在完全连锁不平衡,rs9635726与rs9909593存在强连锁不平衡,见表5、图4~5。本研究采用SHEsis在线软件进行单体型种类和单体型频率的估计,以最低频率的阈值,即单体型频率<0.03的不纳入分析范围的标准,Aiolos基因rs12150079、rs9635726、rs9909593共3个位点可构建5种单体型(ACG、GCA、GCG、GTA、GTG),在SLE组与健康对照组中的分布差异无统计学意义(P>0.05),同时非条件logistic回归分析显示,各单体型与SLE发病均无关,见表5。
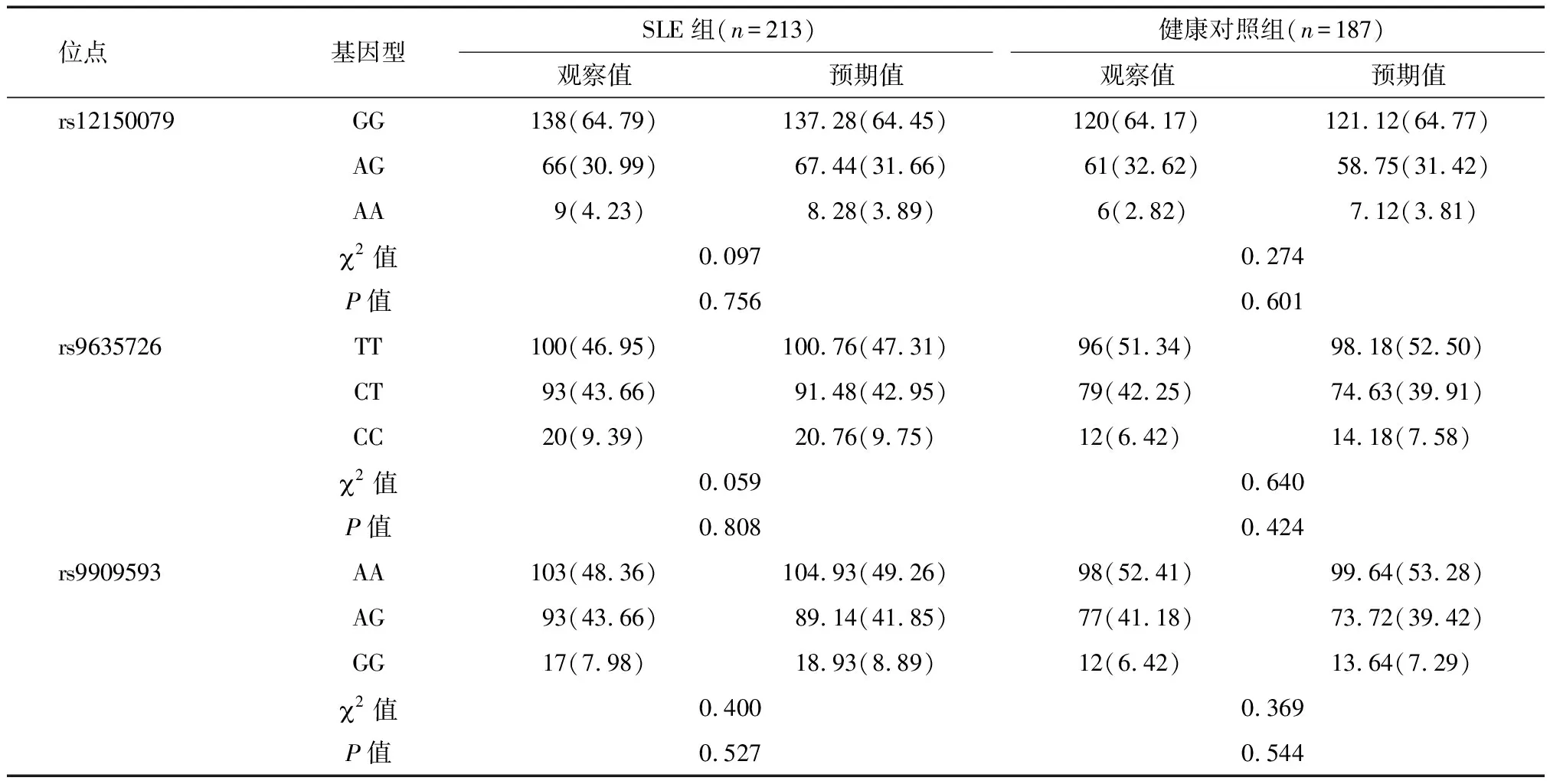
表3 Aiolos基因3个SNP位点基因型分布的Hardy-Weinberg平衡检验 例(%)

图1 rs9909593 测序结果
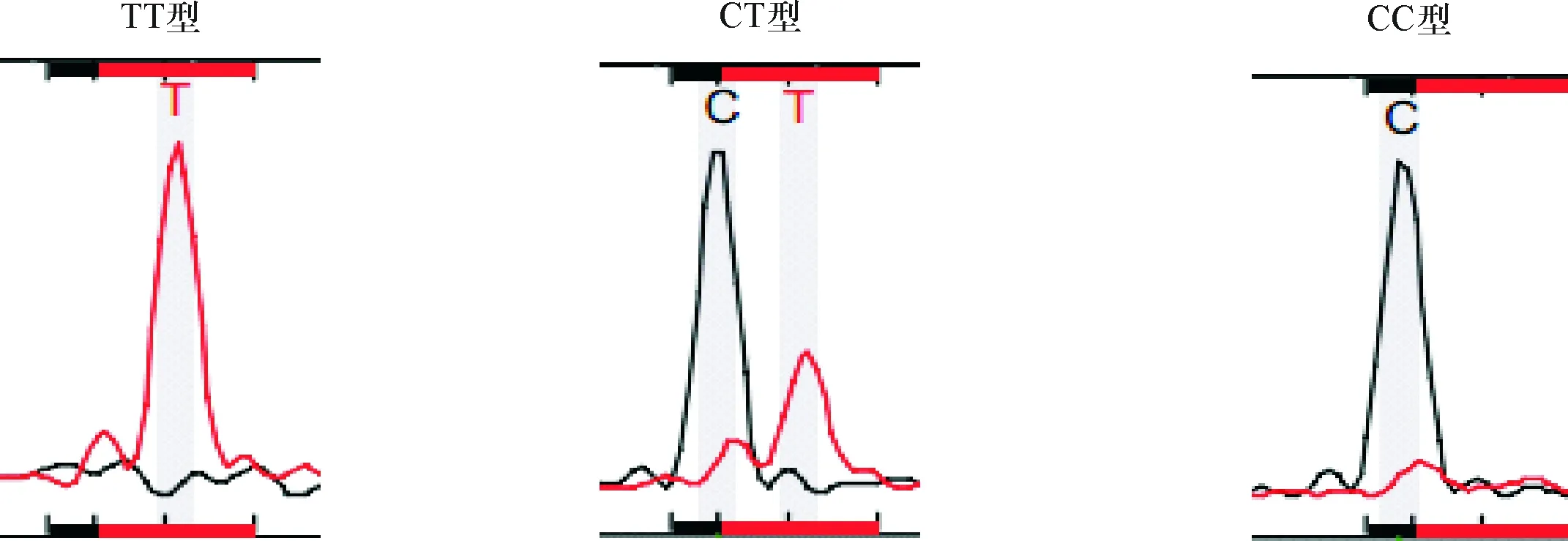
图2 rs9635726测序结果
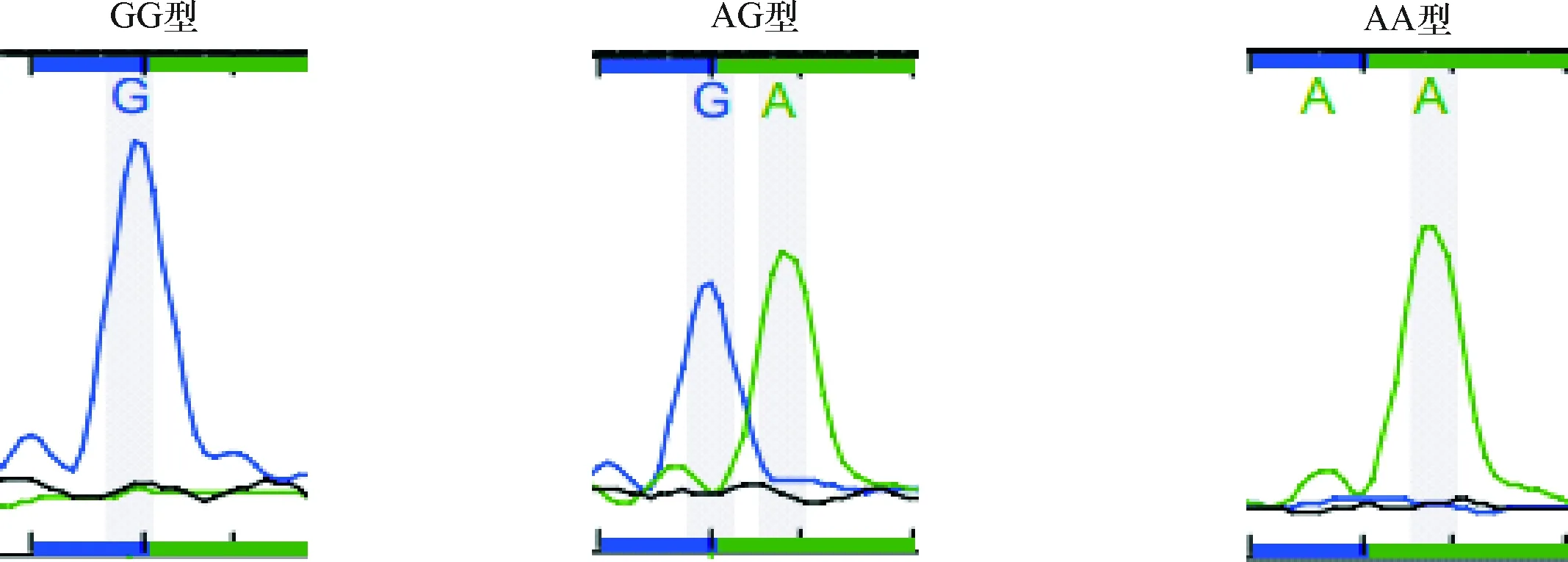
图3 rs12150079 测序结果


表5 Aiolos基因3个SNP位点连锁不平衡分析(r2/D′)
D′:连锁不平衡系数;r2:相关系数
3 讨论
Aiolos基因(IKZF3)作为IKaros家族的成员,位于17q21区域处于很强的连锁不平衡状态,参与淋巴细胞发育、分化、功能维持及凋亡的调控,是淋巴细胞发育必要的细胞因子[10]。一些研究表明,17q21
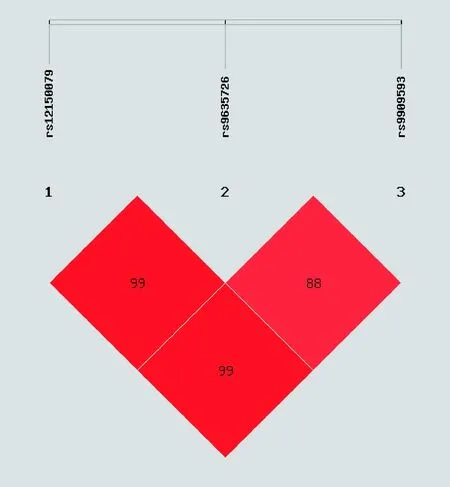
图4 SLE组连锁不平衡D′值
区域基因多态性与强直性脊柱炎、SLE、哮喘、类风湿性关节炎等的发生显著相关,因此该区域很可能是多种自身免疫病的易感区域[11]。近年来通过全基因组关联分析,IKZF1基因的rs2366293、rs1456896及Aiolos基因的rs9913957、rs8076347、rs8079075、rs907091、rs12150079[12-15]等位点在不同人群中发现与SLE具有相关性。我们早先对SLE患者Aiolos基因mRNA及蛋白表达研究发现,SLE患者Aiolos基因的mRNA及蛋白明显降低,且与SLE活动指数呈一定的相关性[16-17]。提示Aiolos基因的表达与SLE相关,因此,我们通过研究贵州汉族人群SLE患者Aiolos的多态性,进一步认识Aiolos基因与SLE的关系,同时也为分子水平诊治SLE提供一定的理论依据。
越来越多的证据表明Aiolos基因在SLE 发病机制中有重要作用,与其他自身免疫病如类风湿关节炎等易感性也相关。美国近年的一项多种族全基因组关联分析(GWAS)研究[18]提示Aiolos基因中的rs8079075、rs9913957、 rs8076347 与欧洲SLE和非裔美国SLE均具有相关性,在亚洲人群中未发现多态性位点,本研究我们也选取了上述3个SNP位点进行重测序,均未发现多态性位点。本研究我们首次对贵州汉族人群Aiolos rs9909593、rs9635726及rs12150079位点进行多态性分析,结果显示贵州汉族SLE 患者这3个SNP位点基因型和等位基因频率与正常健康人群差异无统计学意义(P>0.05),在多个遗传模式(加性、隐性、显性)下,利用logistic回归模型分析显示两组间差异均无统计学意义(P>0.05);联合基因型进一步分析发现,rs12150079与rs9635726、rs9909593存在完全连锁不平衡,rs9635726与rs9909593存在强连锁不平衡,5单体型(ACG、GCA、GCG、GTA、GTG)频率在SLE组及健康对照组中的分布差异无统计学意义(P>0.05),同时非条件logistic回归分析显示,各单体型与SLE发病均无关。在叶丽霞等[19]研究中发现了rs9909593、rs9635726位点与SLE存在关联,与本研究结果不一致;Cai等[20]研究中rs12150079位点与SLE不存在关联,与本研究结果一致。
本研究我们只选取了3个标签SNPs,不能完全代表Aiolos基因。虽然本研究并未发现上述3个标签SNPs与贵州汉族SLE疾病有相关性,但不能完全排除Aiolos基因与中国汉族SLE疾病的相关性,仍需全面研究该基因的遗传变异,还需要进一步对Aiolos基因其他多态性位点进行全面分析,从而深入探索Aiolos基因与中国汉族SLE疾病的关系。由于本研究的选取SNP位点及研究对象数较少,仅对单个位点进行关联分析研究,基因-基因交互作用研究仍有待进一步开展,结果仍需今后进一步在不同地区、不同民族以及大样本人群中进一步验证。
