高钙离子诱导人肾小管上皮细胞自噬对炎症因子生成的影响*
2019-03-26易凯赵嘉闻黎承杨程继文赵雨桐马晨俊廖乃凯邓耀良
易凯, 赵嘉闻, 黎承杨, 程继文, 赵雨桐, 马晨俊, 廖乃凯, 邓耀良
广西医科大学第一附属医院泌尿外科(广西南宁 530021)
高钙尿症是草酸钙肾结石形成和复发的重要危险因素[1]。研究发现,高浓度的钙离子可刺激肾小管上皮细胞损伤,细胞大量表达炎性因子导致炎症反应。上皮细胞损伤后继发出现的炎症反应被认为是参与结石形成的重要过程,是当前结石基础研究的关注点之一[2]。我们前期的体内及体外研究已经发现,含钙肾结石患者尿液炎性细胞因子单核细胞趋化蛋白-1 (monocyte chemoattractant protein-1,MCP-1) 和高迁移率族蛋白B1(high mobility group protein B1,HMGB1) 生成增多,高钙离子可刺激肾小管上皮细胞大量表达这两种细胞因子[3]。因此我们设想,MCP-1和HMGB1在草酸钙肾结石的形成过程中可能起重要作用,抑制这两种细胞因子的生成可能对预防高钙尿症导致的草酸钙肾结石的形成有效。细胞自噬是一种以溶酶体途径的生物降解过程,对细胞生存、分化、发育和体内平衡至关重要,并且细胞自噬参与人类许多疾病的发病机制,如癌症、某些神经退行性疾病、肌病和传染病[4-5]。最近一些研究已经证实细胞自噬与肾脏疾病有关[6]。目前,尚缺乏有关细胞自噬与炎症和肾结石疾病是否存在关联的文献报道。2017年4—12月,我们进行体外细胞培养实验,观察高钙离子诱导人肾小管上皮细胞(HK-2)发生细胞自噬对细胞炎症因子生成的影响。
1 材料与方法
1.1 主要材料 HK-2 (中国典型培养物保藏中心); 逆转录试剂盒和real-time PCR 相关试剂购自TaKaRa; 人MCP-1、HMGB1 和GAPDH 引物上海生工合成;Western blot所用二抗从购自Sigma;β-actin鼠一抗购自Abcam; LC3B兔一抗购自CST; beclin 1 兔一抗购自CST; MTT购自凯杰;DMEM培养液、胎牛血清购自Gibco;氯喹(CQ)、3-MA购自Sigma。
1.2 正常培养液和钙离子培养液的配制 正常培养液为DMEM+10%胎牛血清+1%青霉素-链霉素混合液。钙离子培养液使用6.66 g 二水氯化钙(CaCl2·2H2O)配制成含0.3 mol/L Ca2+的母液,经过高压灭菌冷却后,用DMEM稀释成含5 mmol/L、10 mmol/L Ca2+的两个浓度梯度高钙离子培养液。
1.3 实验方法 体外培养HK-2细胞,分别用正常培养液(不含Ca2+溶液),5 mmol/L Ca2+溶液,10 mmol/ L Ca2+溶液进行处理12 h,以及用10 mmol/L Ca2+液各处理0、6、12 h。之后采用Western blot检测自噬标记蛋白(LC3B-Ⅱ/LC3B-Ⅰ比值)和自噬相关因子Beclin1的表达水平,实时定量PCR(RT-PCR)方法检测细胞炎症因子HMGB1及MCP-1的表达水平。同时,利用不同浓度的细胞自噬抑制剂3-甲基腺苷(0、5、10、15 mmol/L 3-MA)和氯喹(0、10、20、30 μmol/L CQ)分别预处理HK-2细胞6 h,随后再用上述3个浓度梯度的Ca2+溶液处理HK-2细胞12 h,采用RT-PCR检测细胞自噬对炎症因子HMGB1及MCP-1表达的影响。另外,HK-2细胞分别用4个浓度梯度(0、10、20、30 μmol/L)CQ预处理6 h,再用10 mmol/L Ca2+培养液处理12 h,MTT法检测各组细胞的细胞抑制率。
1.4 实时荧光定量PCR(RT-PCR) 处理的细胞直接在6 孔培养板中加入TRIzol 裂解细胞,按总RNA 提取试剂盒操作说明步骤提取总RNA,紫外分光光度仪测定RNA的浓度。取500 ng RNA用PrimeScriptTMRT Master Mix逆转录体系获得cDNA。实时定量RT-PCR采用SYBR ExScript RT-PCR Kit试剂盒对胞内的RNA进行定量,看家基因GAPDH表达作为内参。反应步骤:95℃ 30 s;95℃ 15 s;60℃ 1 min;40个循环。MCP-1 的上游引物为5′-AGCAGCAAGTGTCCCAAAGA-3′,下游引物为5′-GGTGGTCCATGGAATCCTGA-3′;HMGB1 的上游引物为5′-GATCCCAATGCACCCAAGAG-3′,下游引物为5′-TCGCAACATCACCAATGGAC-3′;GAPDH 的上游引物为5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物为5′-TGGTGAAGACGCCAGTGGA-3′。
1.5 蛋白印迹检测(Western blot) 处理的HK-2细胞用无菌的PBS洗涤3次,RIPA细胞裂解液(含1%蛋白酶抑制剂(PMSF)(博士德)裂解细胞。裂解的细胞液蛋白浓度用BCA(bicinchoninic acid)法测定(碧云天)法测定。本实验中Western blot使用的一抗浓度分别为:兔抗-LC3B 1∶2 000;兔抗-beclin1:1∶2 000鼠抗-β-actin 1∶2 000,二抗浓度:1∶5 000。Western blot步骤参照文献[7]进行。
1.6 MTT 检测各组细胞活力的抑制率 取生长良好的第5 代HK-2 细胞,以1×104/孔的密度接种于96 孔板,每个组设5个重复孔。处理的细胞每孔加入50 μL 的MTT 溶液,37 ℃孵育4 h 后,弃上清液,每孔加入200 μL DMSO。用酶联免疫检测仪于570 nm波长下,测定吸光度(absorbance,A) 值。根据公式: 细胞活力抑制率=1-(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值) 计算抑制率。
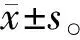
2 结果
2.1 高钙离子诱导HK-2细胞自噬 不同浓度Ca2+液处理的HK-2细胞内LC3B-Ⅱ/LC3B-Ⅰ蛋白的表达相对水平的比值分别为1.00±0.34、2.10±0.10、3.89±0.21(P<0.05);Beclin1的相对表达水平分别为1.00±0.06、2.12±0.17、3.28±0.29(P<0.05),见图1-A。10 mmol/L Ca2+液处理的不同时间段HK-2细胞内LC3B-Ⅱ/LC3B-Ⅰ蛋白的表达相对水平的比值分别1.00±0.12、3.06±0.24、4.24±0.28(P<0.05);Beclin1的相对表达水平分别为1.00±0.15、2.58±0.30、3.55±0.37(P<0.05),见图1-B。
A:不同浓度高钙离子溶液处理的HK-2细胞内LC3B和Beclin1蛋白表达水平;B:10 mmol/L高钙离子溶液处理不同时间的HK-2细胞内LC3B和Beclin1蛋白表达水平
图1高钙溶液处理的HK-2细胞内LC3B和Beclin 1蛋白表达水平
2.2 高钙离子刺激HK-2细胞MCP-1、HMGB1的表达 与不含Ca2+溶液处理组比较,高钙离子环境刺激下,HK-2细胞MCP-1和HMGB1 mRNA的表达显著增多(P<0.05),具有浓度及时间依赖趋势。见表1。

项目不同浓度Ca2+液10 mmol/L Ca2+液处理不同时间0 mmol/L5 mmol/L10 mmol/L0 h6 h12 hMCP-11.00±0.313.27±0.46∗4.65±0.23∗1.00±0.102.67±0.05△4.29±0.27△HMGB11.00±0.051.34±0.20∗1.56±0.16∗1.00±0.071.30±0.19△1.67±0.24△
*与0 mmol/L Ca2+液组比较P<0.05; △与处理0 h组比较P<0.05
2.3 自噬抑制剂3-MA和CQ对高钙离子环境刺激下HK-2细胞MCP-1和HMGB1表达的影响 不含CQ处理组与20 μmol/L CQ处理组细胞内LC3B-Ⅱ/LC3B-Ⅰ蛋白表达水平的比值分别为:1.00±0.23、4.34±0.14,P<0.05;不含3-MA处理组与10 mmol/L 3-MA处理组细胞内LC3B-Ⅱ/LC3B-Ⅰ比值分别为:1.00±0.09、0.45±0.15(P<0.05)。见图2。
与不含Ca2+溶液处理组比较,CQ或3-MA预处理能显著下调高钙离子诱导的细胞内MCP-1 mRNA的表达水平(P<0.05),CQ或3-MA预处理对高钙离子诱导的细胞内HMGB1 mRNA的表达无显著影响(P>0.05)。见表2。
与不含CQ处理组比较,10、20、30 μmol/L CQ预处理能显著下调高钙离子处理的细胞内MCP-1 mRNA的表达(P<0.05),呈浓度依赖趋势;CQ预处理对HMGB1 mRNA的表达无显著影响(P>0.05)。见表3。
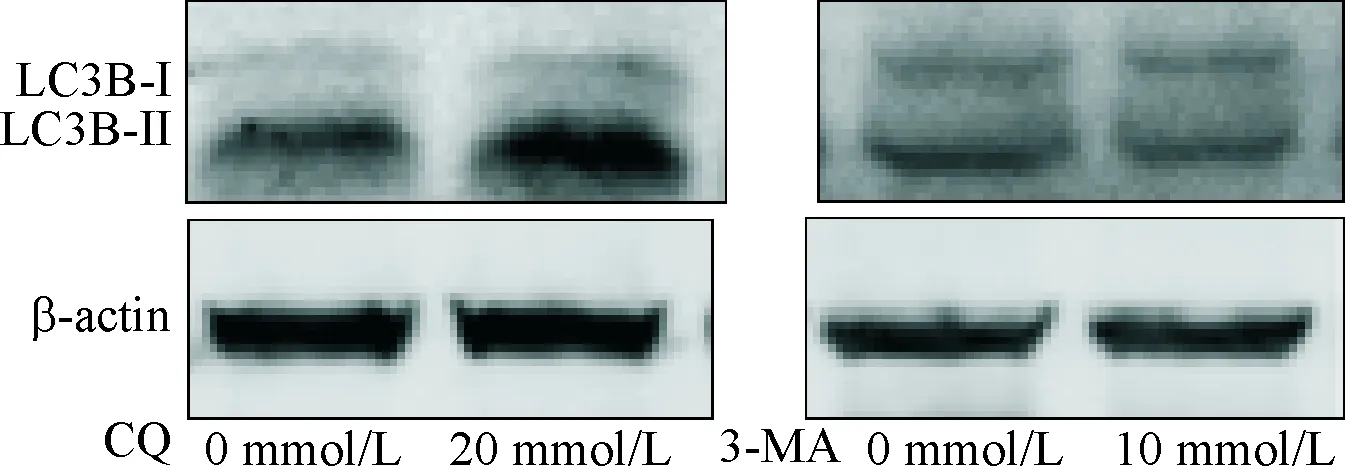
图2 CQ和3-MA处理后LC3B-Ⅰ、Ⅱ蛋白的表达

Ca2+液CQ(20 μmol/L)3-MA(10 mmol/L)MCP-1HMGB1MCP-1HMGB10 mmol/L1.00±0.121.00±0.141.00±0.091.00±0.095 mmol/L 0.32±0.03∗1.26±0.17 0.58±0.12∗ 0.96±0.1210 mmol/L 0.41±0.15∗1.13±0.21 0.60±0.06∗ 1.16±0.10
*与0 mmol/L Ca2+液组比较P<0.05
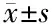

因子0 μmol/L10 μmol/L20 μmol/L30 μmol/LMCP-11.00±0.110.77±0.15∗0.46±0.09∗0.30±0.11∗HMGB11.00±0.091.09±0.141.13±0.171.04±0.21
*与0 μmol/L CQ处理组比较P<0.05
2.4 自噬抑制剂对高钙离子环境下细胞活性的影响 与不含CQ处理组比较(未预处理组),不同浓度的CQ预处理后,10 mmol/L Ca2+离子液处理的细胞抑制率显著降低(P<0.05),见表4。
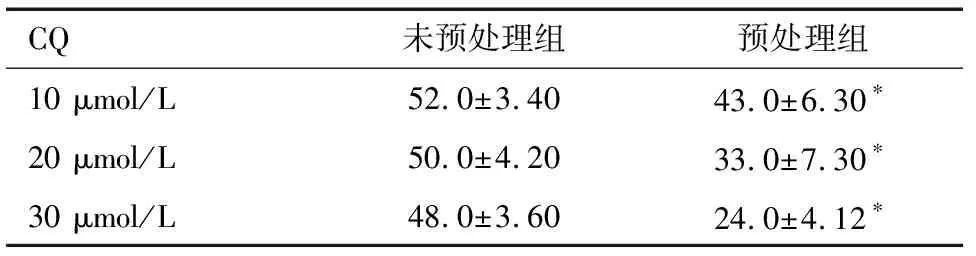
CQ未预处理组预处理组10 μmol/L52.0±3.4043.0±6.30∗20 μmol/L50.0±4.2033.0±7.30∗30 μmol/L48.0±3.6024.0±4.12∗
*与未预处理组比较P<0.05
3 讨论
肾结石在形成过程中,肾小管上皮细胞会暴露在高浓度的钙离子、草酸、草酸钙和(或)磷酸钙晶体中。高浓度钙离子可刺激肾小管上皮细胞活性氧大量形成,导致细胞出现氧化应激损伤[2]。此外,活性氧还能激活细胞内多个分子信号通路,包括转录因子激活蛋白-1、核转录因子-κB,炎性因子[如MCP-1、白细胞介素(IL)-6、转化生长因子-β(TGF-β)、IL-1β、肿瘤坏死因子-α(TNF-α)]生成增多[8]。上皮细胞损伤后继发出现的炎症反应被认为是参与结石形成的重要过程,其不仅可以导致肾间质炎症和纤维化,同时又可以进一步扩大炎症反应[2,9-10]。炎症因子MCP-1、HMGB1均可趋化单核/巨噬细胞进入炎症组织[11-12]。研究已经发现高钙尿症患者尿液炎性细胞因子MCP-1、HMGB1生成增多[3,13]。本研究结果进一步证实高浓度钙离子能促进肾小管上皮细胞上调MCP-1、HMGB1的表达水平。
自噬是一种通过溶酶体途径降解内源性异常及过剩蛋白、损坏的细胞和细胞器的过程,它在维持细胞稳态和适应包括细胞饥饿、细胞氧化应激、活性氧、缺氧、蛋白质聚集或受损细胞器等各种应激状态中起着重要的作用[14]。细胞自噬基本过程包括:在细胞质中形成双层膜结构-自噬体,自噬体吞噬异常、过剩蛋白,损坏的细胞和细胞器;然后自噬体与溶酶体融合,自噬体运载的异常、过剩蛋白、损坏的细胞和细胞器在溶酶体中进行酶消化。使细胞有害物质不仅从细胞中清除,而且被溶酶体消化后形成的新物质还可用于合成新的蛋白质或细胞[15]。自噬与肾脏疾病有明显关联,例如,自噬基因ATG 5或ATG 7突变能导致小鼠局灶性节段性肾小球硬化症[16];TGF-β通过诱导自噬促进肾纤维化[17]。肾缺血再灌注性损伤的发生能诱导近端肾小管上皮细胞上调细胞自噬[18]。在本实验中,体外培养的人肾小管上皮细胞在高钙离子刺激下,LC3B-Ⅱ(细胞自噬标记蛋白)和Beclin1蛋白(细胞自噬形成中的重要因子)表达水平显著上调,并且呈现时间及浓度依赖性,提示高钙离子诱导了HK-2细胞自噬。
近年来有关细胞自噬与炎症因子的相互作用被广泛研究。在肾缺血再灌注性损伤研究中,自噬发生能抑制细胞HMGB1、TNF-α、IL-6和IL-10的表达[19]。有研究发现,MCP-1在心力衰竭疾病过程中不仅能趋化单核/巨噬细胞进入炎症组织,还能通过诱导心肌细胞产生细胞自噬而促进心力衰竭[20]。在本实验中,使用自噬抑制剂CQ或3-MA能有效地抑制高钙离子刺激HK-2 细胞MCP-1的表达水平,但对HMGB1的表达无影响,提示高钙离子刺激HK-2 细胞MCP-1的生成与自噬有关,而HMGB1的生成则与自噬无明显关联。结合以往研究结果,炎性因子MCP-1的生成可通过细胞氧化应激[2]和自噬两个途径进行。
有关自噬对于器官的作用目前仍是有争议的。在肾缺血再灌注性损伤中,有文献报道自噬是肾脏保护因素,也有文献报道自噬加重肾脏的损伤[18,21]。目前认为在复杂的不同信号通路之间,细胞自噬不仅具有保护作用,同时也能促进细胞死亡[21-22]。最近,有研究发现,暴露在草酸钙晶体之下的肾小管上皮细胞自噬增多,提示自噬在草酸钙晶体导致的肾小管上皮细胞损伤中起重要作用[23]。本研究发现,使用CQ抑制细胞自噬后,高钙离子诱导的细胞死亡率也明显降低,细胞活性增加。本研究结果间接表明,高钙离子诱导细胞自噬促进炎症因子的表达及细胞死亡。抑制自噬可能对处于高钙离子环境的肾小管上皮细胞起保护作用,减少炎症反应,进而减少草酸钙肾结石的形成。
综上所述,HK-2细胞在高钙离子环境下炎症因子MCP-1、 HMGB1表达增多,细胞自噬水平上调。抑制细胞自噬能够减少细胞MCP-1的表达,改善细胞活力,但对HMGB1表达无明显影响。仍需要进一步研究自噬与各炎症因子相互作用并参与肾结石形成的具体机制。临床上能否通过调控自噬来控制炎症以达到预防和治疗肾结石的目的,值得期待。
