妊娠期妇女骨密度及骨代谢特征研究
2019-03-26顾海燕陈玲英
丁 莉,顾海燕,陈玲英
(浙江省宁波市北仑区人民医院妇科,浙江 宁波 315800)
为确保胎儿健康成长,妊娠期妇女体内钙质大量转移至胎儿体内,有研究发现,胎儿从母体吸收而来的钙质在30g左右[1]。除钙质向胎儿转移外,妊娠期妇女还存在肾滤过功能增强,这导致其尿钙排出率上升,此时如妊娠妇女未及时补充钙等矿物质,其骨密度将大幅降低,严重者甚至可能发生骨质疏松[2-3]。受经济水平及饮食习惯的影响,我国女性妊娠期饮食结构普遍存在问题,妊娠女性矿物质补充情况堪忧[4]。为分析妊娠期妇女骨密度(bone mineral density,BMD)变化趋势及骨代谢情况,并为临床妊娠期骨质疏松防治提供理论基础,本文选取在宁波市北仑区人民医院住院分娩的200例妊娠妇女进行了以下研究。
1资料与方法
1.1一般资料
选取2016年1月至2018年1月在宁波市北仑区人民医院住院分娩的妊娠妇女200例(妊娠组),纳入标准:①在我院接受全程产检;②年龄≥20岁,≤35岁;③单胎妊娠;④孕妇知情同意。排除标准:①合并妊娠高血压、妊娠糖尿病等合并症或并发症;②有骨折史、肝肾疾病、骨代谢疾病等。同时选取健康妇女150例作为对照组。
1.2检测方法
选用美国好乐杰Hologic SAHARA超声骨密度仪检测200例妊娠妇女在早孕期(10周)、中孕期(25周)和晚孕期(36周)BMD动态变化水平,检测部位取研究对象右手前臂桡骨、尺骨的中远端,对照组检测时间间隔、检测方法、部位等与妊娠组保持一致。选用迈瑞医疗BS-480全自动生化分析仪检测两组研究对象的血清钙、碱性磷酸酶(alkaline phosphatase,ALP)水平,操作参照说明书内容进行;选用放射免疫法检测两组研究对象的骨钙素(BGP)水平,试剂盒由北京奥维亚生物技术有限公司提供;选用碱性苦味酸法检测两组研究对象的尿钙/尿肌酐(creatinine index,Cr)水平,试剂盒由北京雷根生物技术有限公司提供;选用酶联免疫吸附法检测两组研究对象的尿脱氧吡啶啉(deoxypyridinoline,DPD)水平,试剂盒由上海纪宁实业有限公司提供,相关操作参照对应说明书。以上指标与BMD同时进行测定。
1.3 BMD的判定标准
根据本研究测得的BMD水平与健康年轻人的数据两者之间的标准差(SD),定出以下4项指标:正常,即BMD在年轻人平均值的1SD内(-1~+1SD);低BMD,即BMD低于年轻人平均值的1~2.5SD(-2.5~-1SD);骨质疏松症,即BMD低于年轻人平均值2.5SD(低于-2.5SD);严重骨质疏松症,即BMD低于年轻人平均值2.5SD,伴有一处或多处骨质疏松性骨折。
1.4统计学方法
统计分析采用SPSS 19.0软件,计量资料采用(χ±S)表示,组间比较采用t检验,多组间比较采用方差分析。相关性采用Pearson相关分析。以P<0.05表示差异有统计学意义。
2结果
2.1两组一般资料比较
两组年龄、体质量指数(BMI)比较差异均无统计学意义(均P>0.05),具有可比性,见表1。
表1两组一般资料比较(χ±S)
Table 1 Comparison of general data between two groups(χ±S)
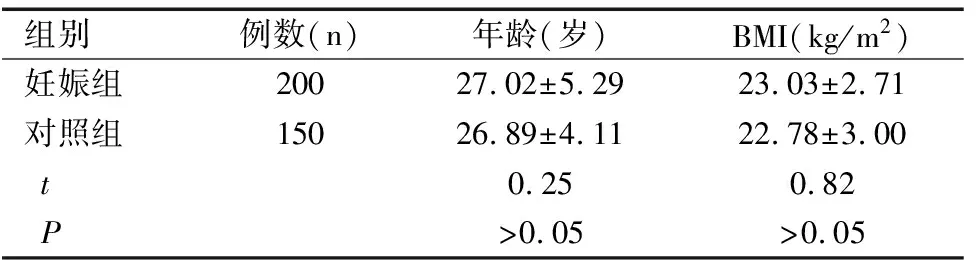
组别例数(n)年龄(岁)BMI(kg/m2)妊娠组20027.02±5.2923.03±2.71对照组15026.89±4.1122.78±3.00t0.250.82P>0.05>0.05
2.2两组BMD及血清钙浓度比较
妊娠组晚孕期BMD低于中孕期、早孕期水平及对照组(t值分别为11.16、12.40、11.69,均P<0.05);对照组和妊娠组各孕期血清钙水平比较差异均无统计学意义(均P>0.05),见表2。
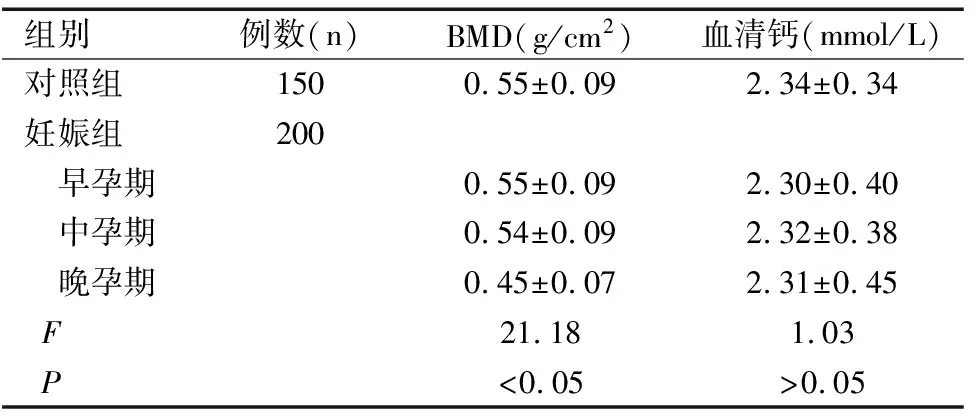
表2 两组BMD及血清钙浓度比较(χ±S)
2.3两组骨代谢指标比较
妊娠组晚孕期血清ALP、尿钙/Cr及尿DPD/Cr明显高于早孕期、中孕期水平及对照组(ALP:t值分别为24.15、16.12、25.12;尿钙/Cr:t值分别为28.04、9.20、33.71;尿DPD/Cr:t值分别为27.64、19.26、34.32,均P<0.05),而血清BGP明显低于中孕期、早孕期水平及对照组(t值分别为9.03、15.86、17.19,均P<0.05),见表3。

表3 两组骨代谢指标比较(χ±S)
2.4妊娠组各孕期BMD与血清钙、骨代谢指标相关性分析
将妊娠组孕妇各孕期BMD与血清钙、骨代谢指标进行相关分析,结果显示:晚孕期孕妇BMD与对照组血清ALP、尿钙/Cr及尿DPD/Cr呈负相关(r分别为-0.46、-0.42和-0.43,均P<0.05),与BGP呈正相关(r=0.38,P<0.05);早孕期、中孕期BMD与对照组血清钙、骨代谢指标无相关性(均P>0.05)。
3讨论
3.1妊娠期女性骨密度代谢变化
超声骨密度检测以其无创、无辐射的特点而被广泛应用于新生儿、妊娠期女性等特殊人群的BMD检测工作[5]。既往研究表明,妊娠期女性普遍存在BMD下降的情况[6],但对于BMD下降的具体时间,临床上还存有一定争议。本研究中,妊娠组晚孕期BMD为(0.45±0.07)g/cm2,低于中孕期、早孕期水平及对照组,表明晚孕期是妊娠期女性BMD下降的主要时间,其原因可能与胎儿发育所需的营养物质随着孕周增加而逐步上升有关。有研究发现,40%以上孕36周以上妇女存在骨质丢失的情况,10%妇女伴不同程度的骨质疏松[7],这也表明晚孕期是BMD下降的主要时期,这与本组研究结果相似。为应对这一情况,临床需加强孕期保健,嘱咐孕妇积极补充钙及其他矿物质,适当补充维生素D,改善骨量,避免骨质疏松,并保障胎儿的正常发育。妊娠期女性整体激素水平增高,成骨细胞活性增强,对钙质的吸收能力上升,并促进骨盐的沉积[8]。此外,孕妇这一时期的细胞外液容积上升,诱使尿钙排出率增高,加之部分钙质流向胎儿,孕妇整体血钙水平维持在一个特殊的微平衡范围内[9]。本研究中,对照组和妊娠组各孕期血清钙水平比较差异无统计学意义,这与孕妇血钙的微平衡有关。
3.2妊娠期女性血清学指标代谢状况
ALP是广泛存在于肝脏、骨骼的一种酶,其确切的生理功能尚不明确,但其与骨钙化之间联系密切[10]。临床研究表明,成骨细胞内的ALP可通过合成磷酸来作用于钙质,并形成磷酸钙沉积于骨内[11]。ALP还可对磷酸酯形成水解效应,并以此降低磷酸酯对骨盐形成的抑制效应,增强机体成骨能力[12]。本研究中,妊娠组晚孕期血清ALP明显高于中孕期、早孕期水平及对照组,表明晚孕期女性代偿性成骨需求增强,对钙质需求上升,这可能与胎儿晚孕期成骨需求增加有关。BGP是成骨细胞分泌的一种多肽,其是骨形成、骨代谢平衡的重要检测指标[13]。本研究中,妊娠组晚孕期血清BGP为(4.12±1.82)g/L,明显低于中孕期、早孕期水平及对照组,分析其原因可能为高激素水平导致孕妇对BGP拮抗增强,肾脏对BGP分解率、滤过率上升有关。尿钙/Cr则是临床常用的对骨吸收检测指标[14]。本组研究中,妊娠组晚孕期时尿钙/Cr明显高于中孕期、早孕期水平及对照组,表明骨吸收存在于整个孕期,并且随着孕周增加而增强。DPD是骨Ⅰ型胶原分子间的交联产物,该物质可从胶原链游离进入血液循环系统内,并通过泌尿系统排出。DPD仅存在于骨与牙质内,是一项具有高特异性的骨吸收检测指标[15]。本组研究中,妊娠组晚孕期女性尿DPD/Cr明显高于中孕期、早孕期水平及对照组,这也表明随着孕周增加,孕妇骨吸收率上升。随后的相关性研究表明,孕妇晚孕期BMD与血清ALP、尿钙/Cr及尿DPD/Cr呈负相关,与BGP呈正相关,提示骨形成及骨吸收是孕期女性BMD的重要影响因素。
3.3本研究的结果和意义
本研究通过分组实验,选用超声对研究对象BMD进行检测分析,并选用放射免疫法、碱性苦味酸法及酶联免疫吸附法等对研究对象BGP、尿钙/Cr、DPD/Cr等指标进行检测,并将结果导入SPSS 19.0软件进行了数量统计,发现妊娠期妇女BMD明显下降,并与孕周、骨代谢平衡等有关。但本研究样本量较少,研究还有一些不足之处。
综上所述,妊娠期妇女BMD有所降低,尤其晚孕期下降明显,与骨代谢指标有一定相关性,临床需加以重视,并积极通过补充钙及其他矿物质、维生素D等孕期保健方案进行防治。
