鲜茧与干茧生丝的结构与性能比较及其鉴别方法
2019-03-25盖国平董永春陈兴灿
李 冰, 盖国平, 郭 蔚, 董永春, 陈兴灿
(1. 广西出入境检验检疫局 检验检疫技术中心, 广西 南宁 530021; 2. 天津工业大学 纺织科学与工程学院, 天津 300387)
目前缫丝企业所缫制的生丝主要包括鲜茧生丝和干茧生丝。鲜茧生丝通常是指将收购鲜茧冷冻干燥并在特定温度的水中真空渗透或煮茧处理后直接缫丝而制成的生丝;而干茧生丝则是采用传统高温烘干技术处理并在较高温度中煮茧而得的生丝。由于鲜茧生丝在生产过程不需要高温烘茧和煮茧等工艺,能耗低,且鲜茧比干茧更易抽丝,因此其生产效率高,工人劳动成本低,已近成为生丝加工的发展趋势[1]。此外,鲜茧缫丝企业还可以充分利用鲜茧制丝时产生的副产品蚕蛹,以获得较高的经济利润。与干茧生丝相比,鲜茧生丝具有生产成本低,生产效率高等优势。在缫丝成本日益高涨和冷冻储存成本降低的背景下,越来越多的缫丝企业选择缫制鲜茧生丝[2],但由于鲜茧生丝较低的价格,使得以鲜茧生丝冒充干茧生丝进行交易而谋求高利润的不良现象时有发生。此外,目前缫丝企业通常不会在生丝产品包装上直接标注生丝的鲜或干茧性质,且2种生丝外观形貌几乎相同,这使得丝绸企业在采购原料时难以辨识而导致使用不当的织造工艺,直接影响蚕丝织物生产效率和产品质量;因此,关于生丝表面性能的研究以及鉴别技术的建立十分重要。
目前已经出现了关于生丝性能比较和鉴别方法的报道。黄继伟等[3]发现,与干茧生丝相比,鲜茧生丝含胶率和白度较高,但抱合力较差,二者均以无规卷曲和β折叠的结晶结构为主。章琪超等[4]则认为鲜茧生丝较粗糙,初期丝胶溶失率高,而结晶度低。乔铁军等[5]研究表明,在鲜/干茧生丝的抱合实验中,鲜茧生丝的抱合力比干茧生丝差。而实践证明基于生丝强度、白度或含胶率等方面差异的鉴别方法准确性和普适性较差。此外,目前也出现了基于红外光谱或高效液相色谱技术的鉴别方法[6],但是都存在鉴别过程复杂,成本高且时间长,难以满足企业需求的问题。
为此,本文借助扫描电子显微镜、傅里叶红外光谱仪、X射线衍射仪、热重分析仪和表面接触角测试等手段对2种生丝的结构与性能进行了表征和比较,然后基于2种生丝在特定表面活性剂水溶液中沉降时间的显著不同建立了一种更加准确和简单的鉴别技术,以期为生丝商检、生丝质量指标完善以及丝绸企业选择正确的织造工艺等提供更加科学的理论依据,以促进我国缫丝和丝绸制造技术向低成本和高性能方向发展。
1 实验部分
1.1 材料与试剂
27种生丝样品来自广西缫丝企业,其规格均为22.22~24.44 dtex;溴化钾、丙酮、十二烷基苯磺酸钠、十二烷基磺酸钠、聚氧乙烯辛基苯酚醚-10,均为分析纯试剂,购于天津市科密欧化学试剂有限公司。
1.2 实验仪器
Nicolet Magna-560型傅里叶红外光谱仪(美国尼高力仪器公司);PHI 5600型X射线光电子能谱仪(美国珀金埃尔默公司);S-4800型场发射扫描电子显微镜(日本日立公司); STA 409 PC型热分析仪(德国耐驰公司);DSA100 型光学接触角测量仪(德国克吕士公司);HWCL-1型恒温磁力搅拌器(郑州长城仪器有限公司)。
1.3 生丝的表面形貌观察
使用丙酮对2种生丝样品进行洗涤处理,2 min后取出烘干,然后使用导电胶将伸直生丝黏附在样品台上,并在其表面喷金处理后放入干燥器中静置12 h,最后在20.0 kV电压条件下使用扫描电子显微镜(SEM)观察和比较其表面形貌差异。
1.4 生丝的化学组成和微结构分析
将生丝样品与一定量的溴化钾混合后压片制样,使用傅里叶红外光谱仪(FT-IR)在分辨率为4 cm-1和扫描20次的条件下对样品的化学组成进行分析。
使用X射线衍射仪(XRD)对样品表面的晶体结构进行分析。测试条件:辐射源为CuKα,波长为0.154 nm,管电压和电流分别40 kV和100 mA,扫描范围为3°~40°,扫描速度为2(°)/min。
1.5 生丝的热性能表征
使用热分析仪测量生丝样品从室温升温到800 ℃过程中的质量损失率,得到其热失重(TGA)和微商热失重(DTG)曲线。测试条件:样品质量为(1.0±0.01)mg,环境介质为氮气,流速为20 mL/min,升温速率为5 ℃/min。
1.6 生丝表面接触角测试
在温度为(20±1)℃和相对湿度为(65±5)%的条件下使用接触角测量仪测定生丝样品的表面接触角。首先将经丙酮处理的样品以伸直状态固定在样品台上,然后通过脉冲将超纯水液滴喷射到样品表面上,在10 s内拍下液滴与样品接触的全过程,并采用量角法计算单纤维的静态接触角。
1.7 生丝的鉴别实验
生丝预处理工艺:在室温条件下首先使用丙酮洗涤处理生丝样品2 min,取出后再使用蒸馏水对其水洗3次后晾干。然后将其置于温度为20 ℃和相对湿度为65%的环境中平衡12 h以上备用。
测试液的配制:称取一定质量的十二烷基苯磺酸钠、0.05 g有机硅消泡剂和200 mL蒸馏水添加到250 mL烧杯中,将它们混合均匀并静置2 h后待用。
生丝样品的制备:将一定根数经过上述预处理的生丝纤维整齐码好,并用1根相同生丝进行捆扎打结,随后量好丝束长度并用剪刀裁剪成2.5 cm的长度,即制得生丝样品。
测试方法:在室温环境条件下,使用干净的镊子将上述捆扎的生丝样品平行地轻放于测试液的液面中央(避免与烧杯壁接触影响沉降)并同时开始计时,记录生丝样品最终沉降触到烧杯底部的时间。
2 结果讨论
2.1 生丝的表面形貌分析
图1示出干茧生丝和鲜茧生丝的扫描电镜照片。可以看出,2种生丝均由多根茧丝平行排列而成,且表面附着的丝胶将茧丝黏着在一起形成束状结构。比较2种生丝表面形貌发现,干茧生丝较鲜茧生丝表面附着的丝胶膜更厚、更均匀,连续性也更好。在干茧生丝结构中,茧丝之间的缝隙几乎都被丝胶填满,茧丝之间排列得更加紧密。而在鲜茧生丝结构中,茧丝之间的缝隙明显变大,其中存在的丝胶较少。此外,鲜茧生丝表面附着细小丝胶颗粒的现象更加明显,这主要与2种生丝缫丝工艺方面的差异有关。具体而言,鲜茧生丝在缫丝过程中未经过高温煮茧,茧丝表面附着的杂质颗粒不能完全从其表面脱落溶解到水中,且包覆在丝素外面的丝胶也没有得到充分膨润,使得鲜茧生丝缫丝上胶时丝胶的黏合力度不及干茧生丝,因此纤维表面颗粒多和茧丝之间空隙大。这表明2种生丝纤维在形态结构上有差异,可在鉴别时参考,但是由于扫描电镜测试成本较高,因此在实际应用中受到一定的限制。

图1 干茧生丝和鲜茧生丝的扫描电镜照片Fig.1 SEM images of two kinds of raw silk. (a)Dry cocoon raw silk(×1 000);(b)Fresh cocoon raw silk(×1 000);(c)Dry cocoon raw silk(×1 800);(d)Fresh cocoon raw silk(×1 800)
2.2 生丝的化学结构分析


图2 鲜茧生丝和干茧生丝的红外光谱图Fig.2 FT-IR spectra of fresh cocoon silk and dry cocoon silk
2.3 生丝的晶体结构分析
使用X射线衍射仪对鲜茧生丝和干茧生丝表面的晶体结构进行测定,得到2种纤维的XRD图谱,并参照Hermans等[10]提出的方法利用Peakfit软件对其进行分峰拟合处理, 以考察二者在结晶度和晶粒尺寸等方面的差异,分峰拟合处理结果如图3所示。

图3 鲜茧生丝和干茧生丝的XRD谱图Fig.3 XRD spectra of fresh cocoon silk (a) and dry cocoon silk (b)
丝素蛋白的结晶形态可分为Silk I型和Silk II型2种晶体结构。Silk I型是一种趋向于α螺旋的结构,而SilkⅡ型则是一种趋向于反向平行β折叠链的结构[11-13],丝素蛋白分子的构象和结晶形态在不同条件下也会有所改变。在蚕丝纤维中,Silk I型和SilkⅡ型2种晶体结构通常是同时存在的,且尽管Silk II型 较 Silk I 型结构相对稳定,但是在一定的化学反应条件下这2种构象也可以相互转化。据文献[3,14]报道,Silk I型结构的主要衍射特征峰分别在2θ为12.2°(中强)、19.7°(强)、24.7°(中强)、28.2°(中强)、32.3°(弱)、36.8°(中弱)、40.1°(中弱)处;而SilkⅡ型结构的主要衍射特征峰在2θ分别为9.1°(中强),18.9°(中强)和 20.7°(很强)、24.3°(弱)、39.7°(中弱)处。图3中的XRD谱线经过分峰拟合处理后可以清楚地看到鲜茧丝在2θ为11.1°、17.1°、20.6°、25.3°、29.6°、34.2°和38.2°处存在衍射吸收峰,干茧丝则在9.1°、17.0°、20.5°、25.2°、29.8°和37.0°处存在衍射吸收峰,二者在20.6°左右的衍射吸收峰均有很高的峰值,该特征峰与SilkⅡ型结构的特征衍射吸收峰相对应。这表明鲜茧丝与干茧丝蛋白中同时存在α螺旋结构和β折叠结构,且以SilkⅡ型(β折叠结构)的晶体结构为主[15]。根据图中曲线计算得到鲜茧丝结晶度为38.85%,干茧丝结晶度为47.04%。这表明鲜茧生丝的结晶度略低于干茧生丝,因此可通过2种生丝纤维的结晶度来辅助判定其鲜干茧丝性质。但2种生丝纤维的结晶度相差值不稳定,所以不能仅通过结晶度来区分。
2.4 生丝的热性能分析
生丝热分解反应的质量损失过程主要分为3个阶段,如图4所示。鲜茧生丝和干茧生丝的第1个质量损失阶段是温度从室温升到125 ℃的阶段,在该阶段鲜茧生丝和干茧生丝的质量减少分别为10%和8%左右,且微商热质量损失在63 ℃左右达到峰值,此时2种生丝的热分解曲线趋势基本一致,但鲜茧生丝的质量减少速率略高于干茧生丝,这是因为此阶段主要对应于生丝纤维中自由水、结合水以及纤维表面小分子有机溶剂等的挥发,鲜茧生丝在缫丝之前未经过高温烘干,因此纤维中存在较多的自由水和结合水。在第2质量损失阶段2种生丝纤维分解速率最快,其从200 ℃开始逐渐发生质量损失,并在305.5 ℃达到峰值,该阶段终止温度约为450 ℃,因此鲜茧生丝和干茧生丝在200~450 ℃质量损失过程中其质量减少分别为 59%和57.5%,此时鲜茧生丝的质量损失速率略高于干茧生丝,其主要原因是该质量减少阶段对应着生丝纤维中氨基酸链的分解和结晶区的分裂[16],最终导致纤维发生热分解。由上述XRD谱图可知,鲜茧生丝的结晶度低于干茧生丝,因此导致其质量减少速率略高于干茧生丝。第3质量损失阶段2种生丝纤维的TGA和DTG曲线基本一致,该阶段主要是纤维分子裂解和炭化阶段,此时鲜茧生丝和干茧生丝的最终质量减少约为70% 和69%。由此可以看出,鲜茧生丝和干茧生丝的热分解曲线尽管稍有不同,但其趋势基本一致,因此并不能通过热质量损失曲线来区分这2种生丝纤维。

图4 鲜茧生丝和干茧生丝的热分析曲线Fig.4 Thermal analysis curves of fresh cocoon silk and dry cocoon silk. (a)TGA curves;(b)DTG curves
2.5 生丝的表面接触角比较
使用接触角测量仪测试了多组鲜茧生丝和干茧生丝对水介质的接触角,结果如图5和表1所示。
由图5和表1看出,干茧生丝的水接触角为48°~53°,而鲜茧生丝的水接触角为31°~39°,二者相差约15°,表明鲜茧生丝比干茧生丝具有更好的亲水性能。这主要与鲜茧生丝中茧丝之间的缝隙较大以及表面相对粗糙有关。此外,干茧生丝在缫丝前经过高温烘茧,这会导致油脂从茧蛹外层溢出并被吸附到茧丝表面,使得干茧生丝表面的亲水性变差。

图5 鲜茧生丝和干茧生丝的水接触角比较Fig.5 Comparison on water contact angle of fresh cocoon raw silk b (a) and dry cocoon raw silk g (b)

Tab.1 Comparison on water contact angle of two kinds of raw silk(°)
2.6 生丝鉴别方法的建立
根据2种生丝表面亲疏性能方面的差异,建立了测定生丝束在特定表面活性剂水溶液的沉降时间的方法,以有效地鉴别2种生丝。为更加显著地增加2种生丝在沉降时间上的差别以提高鉴别的准确性,本文考察了表面活性剂的性质、浓度以及生丝束样品中生丝根数对其沉降时间的影响。
2.6.1表面活性剂种类对生丝沉降时间的影响
分别使用2种阴离子型表面活性剂十二烷基苯磺酸钠(SDBS)与十二烷基磺酸钠(SDS)和1种非离子型表面活性剂聚氧乙烯辛基苯酚醚-10(OP-10),配制浓度均为0.5 mmol/L的水溶液,然后将20根生丝组成的2种生丝束样品分别放置于溶液表面并测定它们的沉降时间。结果表明:当SDBS存在时,鲜茧生丝的沉降时间为17 s,干茧生丝的沉降时间则大于600 s;当SDS存在时,鲜茧生丝和干茧生丝的沉降时间均大于1 800 s;当OP-10存在时,鲜茧生丝的沉降时间为34 s,干茧生丝的沉降时间则大于150 s。
当使用SDBS时,2种样品的沉降时间差别巨大,其中鲜茧生丝样品的沉降时间远小于干茧生丝,说明鲜茧生丝样品更易被SDBS水溶液润湿和浸透,表1也已证明鲜茧生丝比干茧生丝具有更好的亲水性能。而当使用SDS时,2种样品的沉降时间都很长,无法用来鉴别2种生丝束样品。当使用OP-10时,尽管2种样品的沉降时间也有显著差别;但是远不如使用SDBS时2种样品的沉降时间差别大,因此,有必要进一步研究SDBS浓度对沉降时间的影响,以获得最佳实验条件。
2.6.2SDBS浓度对生丝沉降时间的影响
为考察SDBS浓度对2种生丝沉降时间的影响,首先配制不同浓度的SDBS水溶液,然后将不同数量生丝构成的生丝束样品分别放置于溶液表面并测定它们的沉降时间,结果见表2。
从表2看出:当水中未添加SDBS时,2种样品在600 s内均未出现沉降现象;当溶液中SDBS浓度为0.50、1.0 mmol/L时,鲜茧生丝样品的沉降时间均在50 s以内,而干茧生丝样品的沉降时间均已超过600 s;当其浓度增加至2.5 mmol/L时,鲜茧生丝样品的沉降时间仍低于50 s,干茧生丝样品中由4~20根生丝组成的其沉降时间仍超过600 s,而超过20根生丝组成的2个样品的沉降时间缩短显著,尤其是由36根生丝组成样品的沉降时间仅为53 s,已接近由相同根数鲜茧生丝组成样品的沉降时间(49 s);当其浓度为3.50~5.0 mmol/L时,鲜茧生丝样品的沉降时间并未发生显著变化,而干茧生丝样品的沉降时间随着样品中生丝根数的增加而逐渐下降,但是未超过相应鲜茧生丝样品的沉降时间。这说明水溶液中SDBS的添加对2种生丝样品的沉降时间具有显著影响。对于鲜茧生丝样品,较低浓度(0.50、1.0 mmol/L)的SDBS就会导致其沉降时间明显下降,而SDBS浓度的提高并未引起其沉降时间显著缩短。对于鲜茧生丝样品,低浓度(0.50、1.0 mmol/L)的SDBS不会导致其沉降时间发生显著降低,而SDBS浓度的提高则引起其高根数样品沉降时间显著变短,且这种趋势随着SDBS浓度的提高变得更加突出。导致这种现象的主要原因是鲜茧生丝比干茧生丝具有更好的亲水性能,其更易于被SDBS水溶液浸透而沉降;而干茧生丝表面亲水性较差,需要较高浓度的SDBS水溶液才能使其浸透而沉降。此外,鲜茧生丝样品的根数对其沉降时间的影响并没有明显的规律性,当其根数为20时样品的沉降时间通常最短。与其不同的是,随着干茧生丝样品根数的增加,其沉降时间逐渐变短,尤其在SDBS浓度提高时这种变化趋势更显著,这种差异仍然与2种生丝表面亲水性不同有关。

表2 2种生丝束样品在不同浓度SDBS溶液中的沉降时间Tab.2 Settling time of two kinds of raw silk in SDBS solutions with different concentrations
根据上述2种生丝样品表面亲水性的差异以及表面活性剂性质和浓度的影响作用结果,能够建立一种基于二者在特定浓度SDBS水溶液中沉降时间的有效鉴别方法,其中建议SDBS浓度为0.50~1.0 mmol/L,样品根数不多于20根,这是因为在此条件下2种样品沉降时间的差异最大,提高了鉴别方法的准确性。通常在此条件下,沉降时间大于600 s的样品被认定为干茧生丝,否则为鲜茧生丝。
2.7 生丝鉴别方法的验证
从生丝生产企业收集26种商品化生丝样品(鲜茧生丝和干茧生丝各13种),首先对其进行前处理,然后采用上述方法测定它们的沉降时间,并根据实验结果进行鲜茧、干茧的判定,结果如表3所示。
表3数据显示:所有鲜茧生丝样品的沉降时间相对较短,大多数不超过100 s,其与实验结果相符的准确率达到100%;而10种干茧生丝样品的沉降时间高于600 s,3种样品的沉降时间在180~230 s之间,其准确率接近77%。值得说明的是,对于3种测试不准确的样品,其沉降时间明显长于鲜茧生丝样品,也可基本判断为干茧生丝样品;但是需要使用其他技术进一步考察。基于以上分析看出,采用此方法鉴别鲜茧生丝样品的准确性明显高于干茧生丝样品。
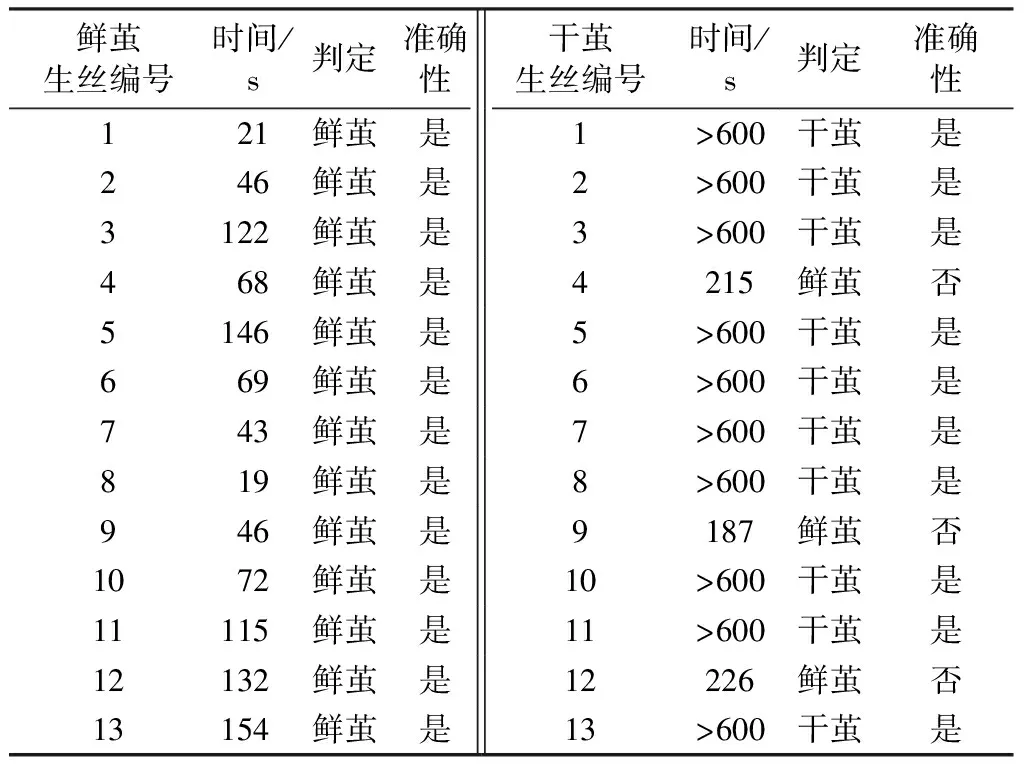
表3 26种商品化生丝样品的沉降时间Tab.3 Settling time of 26 kinds of commercial raw silk
3 结 论
1)鲜茧生丝的表面形貌与干茧生丝相比,前者的表面颗粒较多且茧丝之间空隙也较大。鲜茧生丝和干茧生丝大分子二级构象主要为β折叠构象,鲜茧生丝的结晶度略低于干茧生丝。鲜茧生丝和干茧生丝的热分解曲线尽管稍有不同但其趋势基本一致。
2)鲜茧生丝比干茧生丝具有更好的亲水性能,二者水接触角相差约15°。根据2种生丝表面亲疏性能方面的差异,建立了测定生丝束在特定表面活性剂水溶液的沉降时间的方法以有效地鉴别2种生丝。最终确定该方法的最佳工艺参数:测试液中十二烷基苯磺酸钠的浓度为0.5~1.0 mmol/L,捆扎的纤维根数在20以内。采用该方法对26种鲜茧生丝和干茧生丝样品进行鉴别验证,其鉴别鲜茧生丝的准确率能达到100%,鉴别干茧生丝的准确率达到77%。
FZXB
