鲜茧丝与干茧丝性状对比研究
2018-11-12赵媛黎国勇马林曹轶群谭凯燕刘坤
文/赵媛 黎国勇 马林 曹轶群 谭凯燕 刘坤
鲜茧缫丝古已有之,随着生产的发展,产能提高,收获的鲜茧短时间内无法全部加工而化蛹成蛾,为延长鲜茧贮存时间,方便运输存放,出现烘干杀蛹并逐渐形成干茧缫丝技术[1]。
鲜茧缫丝省略了烘茧与煮茧两个步骤,缫丝成本降低,且缫丝副产物鲜茧蛹的市场需求不断增加。自2010年部分缫丝企业在利益驱使下自建冷库,收储鲜茧,转向鲜茧缫丝[2]。鲜茧丝出现初期,织绸企业普遍对鲜茧丝评价不高,一方面鲜茧丝没有明确标注,价格基本与同质干茧丝相同,另一方面在干茧丝占主导地位的情况下,企业工艺不能适应鲜茧丝,各道工序问题频发。至今,织绸企业工艺调整,基本适应鲜茧丝,对鲜茧丝的态度已经转变,从拒绝到主动,不论鲜、干茧丝均以丝等级确定其织造工艺,以最终产品为导向,但高端绸厂织造缎类丝织物时,只会采用干茧丝。
鲜茧丝确实有异于干茧丝的性能,我们在肯定鲜茧缫丝技术创新带来的优点的同时,也要看到这些性能的改变对后续丝绸生产带来了困扰。本文从鲜茧丝与干茧丝的质量关键指标、表面形态、分子结构等方面进行研究,对比两者性能、结构存在的差异,为加强丝绸企业质量控制,提升检验单位服务效能提供参考。
1 试验
1.1 试验材料
收集南宁、柳州、宜州、百色不同庄口的鲜茧10份,各庄口鲜茧分为两组,一组放入冷库,一组通过烘干工艺干燥后放入常温茧库。冷库中的鲜茧经过真空渗透、缫丝、复摇整理得到鲜茧丝,常温茧库中的干茧经过真空渗透、煮茧、缫丝、复摇整理缫丝得到干茧丝。
将得到的10份鲜茧分别标记为1、2、3,……,8、9、10,共10份。每份鲜茧分别获得的鲜茧丝和干茧丝各10组,其中鲜茧丝标记为X1、X2、X3、X4,……,X9、X10,与之对应的干茧丝标记为G1、G2、G3、G4,……,G9、G10,见表1。
1.2 试验方法
1.2.1 生丝物理指标测试
鲜茧丝和干茧丝的断裂强度测试、生丝抱合性能测试、生丝含胶率测试所用设备均按GB/T 1798—2008《生丝试验方法》执行。

表1 茧丝基本信息
1.2.2 纵向超微形态观察
利用日本JSM-6610LV型电子扫描显微镜在放大500倍下观察生丝纵向表面形态。取约1cm蚕丝粘贴于导电胶,置于样品台,用日立JFC-1600仪器镀金(40mA,30S),在扫描电镜加速电压5kV下观察拍片。
1.2.3 红外光谱测试
生丝裁剪为约5cm,捆绑成束,利用配备ZeSe晶体ATR附件的PerkinElmer Frontier(美国PE)测定茧丝红外光谱,波长扫描范围500 cm-1~4000cm-1,分辨率2cm-1,累计扫描次数15次。相同条件下每个样品测试3次,取平均结果进行光谱分析。
1.2.4 高效液相色谱测试
利用高效液相色谱仪(品牌:热电DIONEX,型号:Ultimate 3000)对鲜茧丝与干茧丝的水溶性微量组分进行对比,试验条件按浴比为1:10(g/mL),柱温:50℃,柱压范围:170bar~70bar(2320psi~1015psi,1bar≈14.5psi,1psi=6.895kPa=0.06895bar)进行。
1.2.5 氨基酸测试
茧丝中的蛋白质经盐酸水解成为游离氨基酸,经离子交换柱分离后,与茚三酮溶液产生颜色反应,再通过可见光分光光度检测器测定,以外标法定量,计算氨基酸含量。
利用德国赛卡姆 Sykam 全自动氨基酸分析仪,茚三酮柱后衍生来检测,检测器采用570nm、440nm双波长可见光分光光度,洗脱泵流速为0.45mL/min,衍生泵流速为0.25mL/min,柱温为58℃~74℃梯度控温,反应器温度130℃,压力0bar~40bar。选用57min水解法,茚三酮停止时间为43.0min。
2 结果与讨论
2.1 断裂强度、断裂伸长率对比分析
表2为鲜茧丝与干茧丝断裂强度、断裂伸长率的测试结果。不同庄口的鲜茧丝断裂强度区间为(32.31~37.35)cN/tex,干茧丝断裂强度区间为(31.59~36.45)cN/tex,两种生丝断裂强度重合区域为(32.31~36.45)cN/tex,断裂强度重合区域大,没有出现增强或减弱。
对比同一庄口的鲜茧丝与干茧丝断裂强度、断裂伸长率的数据,可发现有7组鲜茧丝断裂强度大于干茧丝断裂强度,而鲜茧丝的断裂伸长率均低于干茧丝,这表明鲜茧丝抵抗外力能力增加,变形能力减弱。
2.2 生丝抱合性能对比分析
按照GB/T 1798—2008《生丝试验方法》,每个样品进行10次抱合测试,取其平均值为最终结果。
表3为鲜茧丝与干茧丝抱合性能测试的结果,不同庄口的鲜茧丝与干茧丝的抱合次数不存在显著性差异。同一庄口鲜茧丝与干茧丝抱合次数对比发现,有7组鲜茧丝抱合次数少于干茧丝,最大相差10次并出现2次,在GB/T 1797—2008《生丝》标准中生丝抱合的分级区间为10,说明同一庄口的鲜茧丝抱合性能不如干茧丝。

表2 鲜茧丝与干茧丝断裂强度、断裂伸长率

表3 鲜茧丝与干茧丝抱合性能测试
2.3 生丝含胶率对比分析
表4为鲜茧丝与干茧丝含胶率测试结果。不同庄口的鲜茧丝含胶率区间为21.60%~25.23%,干茧丝含胶率区间为20.78%~25.53%,鲜茧丝含胶率平均值23.59%,大于干茧丝的22.83%。
同一庄口鲜茧丝与干茧丝含胶率对比,有7组(第2、3、4、5、6、8、10组)鲜茧丝含胶率高于干茧丝,其中第6组相差最大,鲜茧丝高于干茧丝2.55个百分点。可发现,同一庄口鲜茧丝含胶率高于干茧丝。
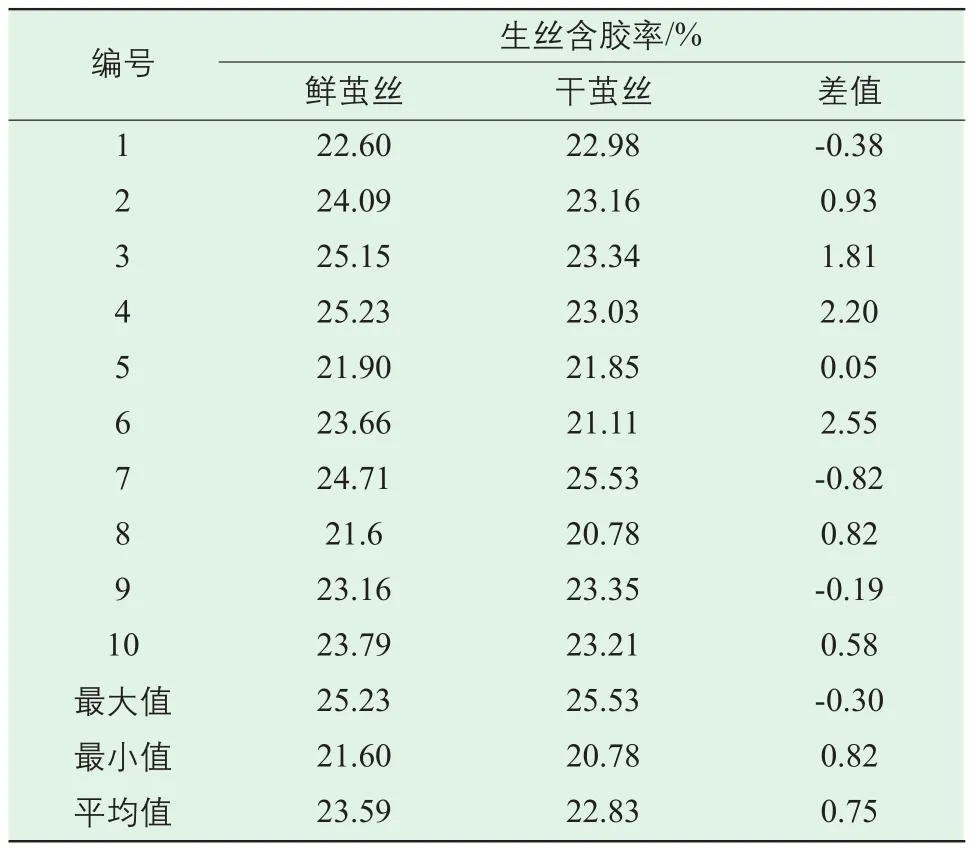
表4 鲜茧丝与干茧丝含胶率
2.4 纵向超微形态对比分析
分析10组鲜茧丝与干茧丝的电子显微镜照片可知,同一庄口鲜茧丝与干茧丝在生丝表面、生丝边缘、丝胶颗粒、丝条并合、丝胶包覆一个或几个方面有细微区别,但是不同庄口的鲜茧丝与干茧丝的区别没有统一规律,图1是从10组结果中选取出的两组样品(第5组、第7组)电子显微镜照片。
另外测试中发现,对于同一样品,取样部位不同,外观表现也会出现差异。

图1 鲜茧丝与干茧丝电子显微镜照片(第5组、第7组)
2.5 红外光谱对比分析
蚕丝主要由丝素蛋白和丝胶组成,由于丝素蛋白和丝胶含有丰富的甘氨酸、丝氨酸和丙氨酸氨基酸残基,因此,蚕丝红外光谱在3280 cm-1和1068 cm-1附近出现明显的羟基吸收,在2920 cm-1和2850 cm-1附近出现弱的亚甲基对称和反对称伸缩振动吸收,并在另外1620 cm-1、1515 cm-1和1230 cm-1附近出现明显的酰胺基团特征吸收,选取两组(第5组、第7组)光谱图,见图2。
比较发现,鲜茧丝与干茧丝的亚甲基伸缩振动吸收有差异,使得茧丝红外光谱在(3000~2800)cm-1波长范围内出现细微的变化,因此,截取(3000~2800)cm-1波长范围红外光谱,以经过3000cm-1和2800cm-1两点的直线为基线,扣除基线,并经过面积归一化后得到10组鲜茧丝和干茧丝在(3000~2800)cm-1波长范围的光谱图,以第5组、第7组为例,见图3。鲜茧丝与干茧丝相比在2917cm-1和2850cm-1的吸收增强,而2926cm-1和2875cm-1的吸收减弱。计算茧丝在2917cm-1与2926cm-1透过率比值、2850cm-1与2875cm-1透过率的比值,结果见表5。利用t-test (two population) 方法对上述结果进行统计分析,结果显示,在P<0.05的条件下干茧丝与鲜茧丝的T2917/T2926和T2850/T2875的差异明显,但是P<0.01 的条件下差异不明显。
蚕丝的羟基和酰胺基团具有明显的红外吸收,但是,由于ATR-FTIR光谱分析方法本身的特点造成不同样品测试时红外谱图的基线和吸收强度略有差异,对鲜茧丝和干茧丝红外光谱的直接比较造成困难。由图2可以看到,茧丝在(4000~3750)cm-1波长范围基本没有吸收,因此,把图2中各组样品红外谱图向上平移使该波长范围透过率平均值为100%,并乘以一定的校正系数使各谱图具有相同的吸收峰面积,处理得到10组干茧丝和鲜茧丝在(1750~500) cm-1波长范围的光谱图,见图4(第5组、第7组)。结果显示,鲜茧丝与干茧丝羟基的伸缩振动吸收差异不大,但是与鲜茧丝相比,干茧丝酰胺基团的特征吸收略有减小,并以酰胺II带(1600~1500) cm-1的变化最为明显,分析茧丝在1514 cm-1与1069 cm-1透过率的比值(1-T1514)/(1-T1069),结果见表6。利用t-test (two population)方法对上述结果进行统计分析,结果显示,在P<0.05的条件下干茧丝与鲜茧丝的(1-T1514)/(1-T1069)值的差异明显,但是P<0.01 的条件下差异不明显。
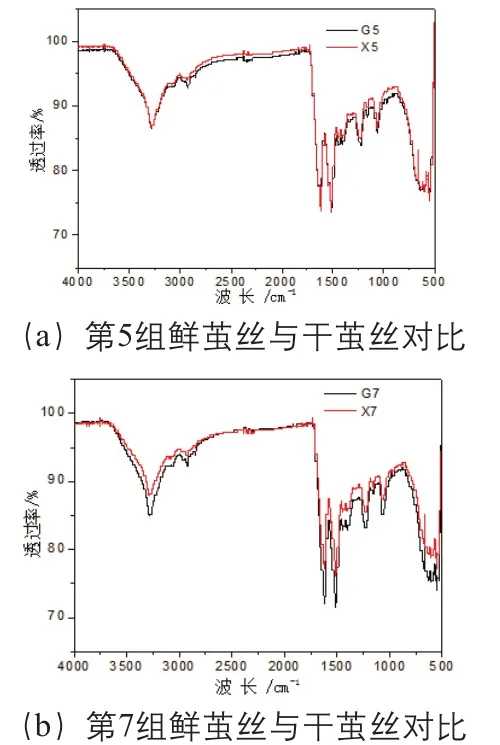
图2 干茧丝与鲜茧丝红外光谱对比(第5组、第7组)
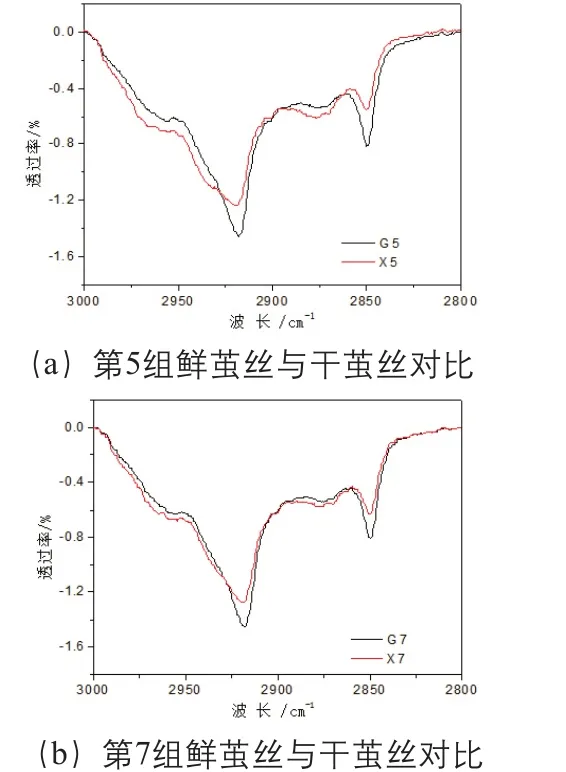
图3 鲜茧丝与干茧丝在(3000~2800)cm-1波长范围光谱对比(第5组、第7组)
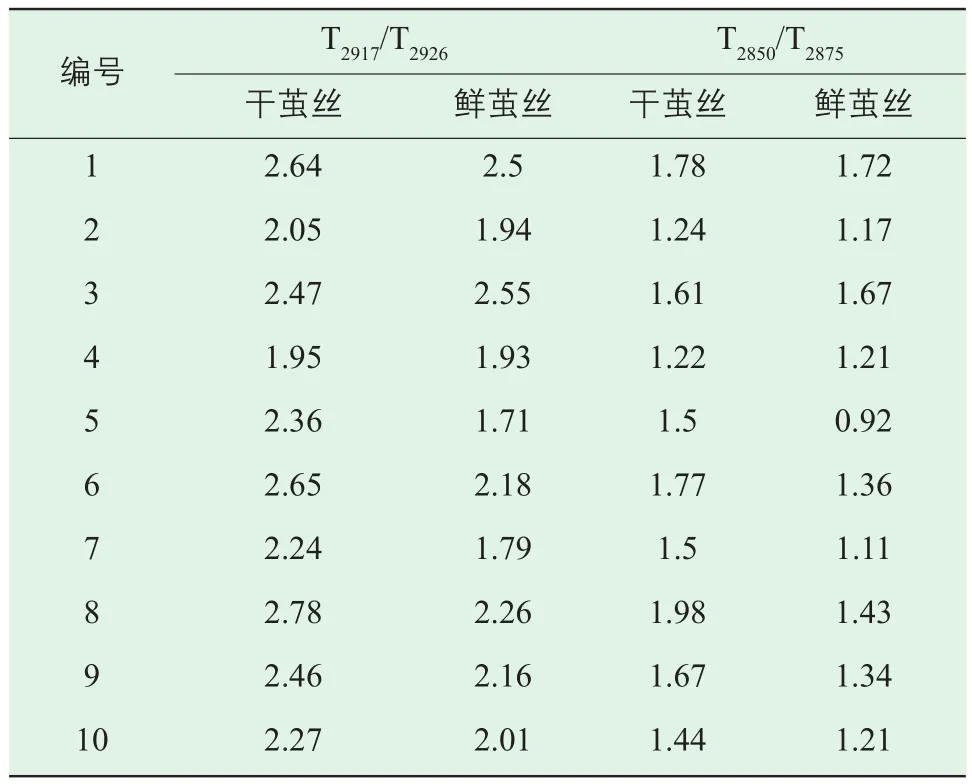
表5 鲜茧丝与干茧丝在2917 cm-1与2926 cm-1波长透过率比值、在2850 cm-1与2875 cm-1波长透过率比值

图4 鲜茧丝与干茧丝在(1750~500)cm-1波长范围光谱对比(第5组、第7组)

表6 鲜茧丝与干茧丝在1514 cm-1与1069 cm-1波长透过率比值(1-T1514)/(1-T1069)
2.6 高效液相色谱对比分析
在所得的10组样品色谱图中,第2组、第6组鲜茧丝的色谱图中保留时间为1.5min组分色谱峰稳定存在且具有很强的检测信号,保留时间为10min~15min组分色谱峰也能较稳定地存在,吸收峰强度变化不明显。这两组干茧丝的色谱图中保留时间为1.5min组分色谱峰同样是稳定存在且具有很强的检测信号,但保留时间为10min~15min组分色谱峰下降明显,特别是第6组接近消失。其余8组鲜茧丝与干茧丝样品色谱图10min到15min对比色谱峰无典型差异。
图5为鲜茧丝与干茧丝高效液相色谱图,以第5组、第6组为例,分别代表10min~15min组分色谱无变化、色谱明显下降。综合评价高效液相色谱图变化发现其趋势呈现起伏性和随机性,水溶性微量组分无规律性差异。

图5 鲜茧丝与干茧丝高效液相色谱图(第5组、第6组)
2.7 氨基酸对比分析
表7是各样品中氨基酸总量,由表可知,鲜茧丝与干茧丝的水解氨基酸总量均很高,全部在90%以上,样品都不溶于水,这说明无论鲜茧丝,还是干茧丝的主要成分都是蛋白质及多肽,总量均大于90%。鲜茧丝水解氨基酸总量范围为90.81%~92.9%,干茧丝水解氨基酸总量范围91.29%~93.29%,两者的水解氨基酸总量重合区域较小。不同庄口鲜茧丝与干茧丝水解氨基酸总量存在差异。同一庄口的鲜茧丝与干茧丝,鲜茧丝的水解氨基酸总量均低于干茧丝的,但差别不大,一般只有1%左右。
同一庄口鲜茧丝与干茧丝的水解氨基酸种类主要有17种,同一样品各种氨基酸的含量高低差别很大,含量较高的几种依次是甘氨酸、丙氨酸、丝氨酸、酪氨酸、天冬氨酸,这5种氨基酸之和占氨基酸总量的80%以上,这与红外光谱的结果相对应。不同庄口生丝各类氨基酸含量无明显差异,同一庄口干茧丝与鲜茧丝的各类氨基酸含量也极为接近。
3 结论
同一庄口的鲜茧丝与干茧丝对比,断裂强度无明显差异,鲜茧丝的断裂伸长率均低于干茧丝,鲜茧丝抱合性能弱于干茧丝,鲜茧丝含胶率高于干茧丝。
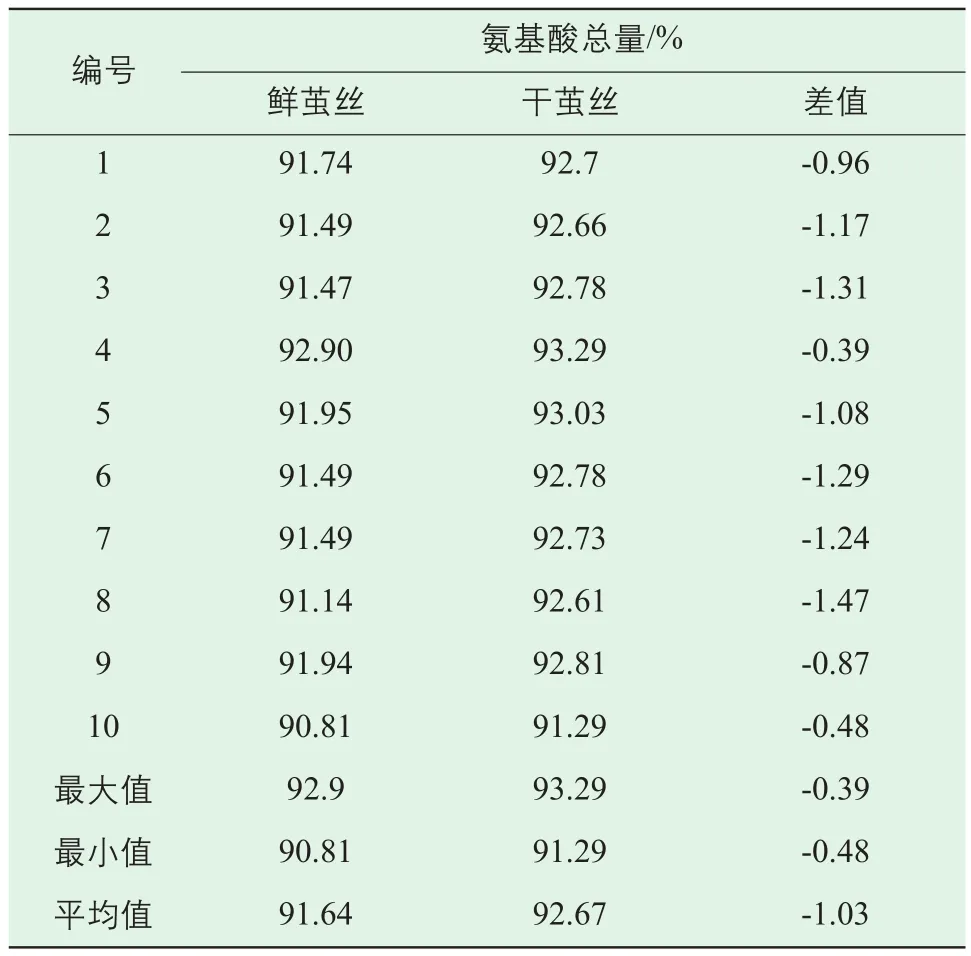
表7 茧丝水解氨基酸总量
利用扫描电子显微镜观察鲜茧丝与干茧丝纵向表面超微形态,两者无差异,同一样品取样部位不同,表面形态会有明显差异。
鲜茧丝与干茧丝高效液相色谱图变化趋势呈现起伏性和随机性,两者水溶性微量组分无规律性差异。
鲜茧丝与干茧丝的水解氨基酸总量、各类氨基酸含量极为接近,无明显差异。
红外光谱测试中,鲜茧丝与干茧丝的亚甲基伸缩振动吸收略有差异,使得茧丝红外光谱在(3000~2800)cm-1波长范围内出现细微的变化,经统计分析,鲜茧丝与干茧丝在波长2917 cm-1与2926 cm-1透过率的比值,波长2850 cm-1与2875 cm-1透过率的比值有明显区别,另外与鲜茧丝相比,干茧丝酰胺基团的特征吸收略有减小,并以酰胺II带(1600~1500)cm-1的变化最为明显,经统计分析鲜茧丝与干茧丝在1514 cm-1与1069 cm-1吸光率的比值(1-T1514)/(1-T1069)有显著差异。
