响应面法优化黑果枸杞蛋白提取工艺及其抗衰老活性研究
2019-03-25杨重晖赵大庆王德慧荆礼唐晓雷孙伟杰潘黛安刘莉齐滨
杨重晖,赵大庆,王德慧,荆礼,唐晓雷,孙伟杰,潘黛安,刘莉,*,齐滨,*
(1.长春中医药大学药学院,吉林长春130117;2.长春中医药大学吉林省人参科学研究院,吉林长春130117;3.长春中医药大学创新实践中心,吉林长春130117;4.长春中医药大学附属医院,吉林长春130117)
黑果枸杞(Lycium ruthenicum Murr.)为茄科枸杞属多年生灌木,是我国西北地区的一种野生植物,分布范围较广,分布于宁夏、新疆、西藏、青海、内蒙、甘肃等地,其味甘、性平。其果实含丰富的维生素、多糖、黄酮、类黄酮、微量元素、天然原花青素等多种活性成分[1-3]。近年来,黑果枸杞的药理作用受到了广泛的关注,现代药理学研究表明,黑果枸杞的生理活性与花青素类天然色素、甜菜碱、多糖类等成分有关[4-6]。
黑果枸杞中含有丰富的氨基酸,氨基酸是枸杞果实中主要的营养及药用成分,其含量是评价食品和中药材品质的一项重要指标[7-9]。黑果枸杞中含有多种氨基酸,其中以天门冬氨酸、谷氨酸、丙氨酸和脯氨酸的含量较高,而且多数呈游离状态。游离氨基酸约占氨基酸总量的50%。
氨基酸是蛋白质的基本组成单位,现有研究结果表明黑果枸杞中的蛋白质也可能是重要的活性成分。近年来,中药蛋白质被证明是一些中药中主要的活性成分,具有抗真菌,抗氧化,增强免疫等功效[10-11]。但目前黑果枸杞中蛋白质的提取工艺鲜见报道,本试验通过响应面分析法(response surface methodology,RSM)优化黑果枸杞蛋白的提取工艺,并对黑果枸杞蛋白的抗衰老活性进行了初探。本试验结果可为该植物蛋白的开发利用提供科学依据。
1 材料与方法
1.1 材料与仪器
黑果枸杞:广州汉草荟生物科技有限公司,批号20170914,产自青海柴达木。黑果枸杞由长春中医药大学中药鉴定教研室翁丽丽教授鉴定为茄科植物黑果枸杞的干燥果实。
Bradford蛋白质定量试剂盒:天根生化科技(北京)有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(gutathion peroxidase,GSH-Px)试剂盒:南京建成科技有限公司;D-半乳糖:上海恒信化学试剂有限公司;所用试剂均为分析纯。
DT100型电子天平:常熟市双杰测试仪器厂;JB-1B型磁力搅拌器:上海雷磁新泾仪器有限公司;DS-1型匀浆机:上海标本模型厂;CENTRIFUGE 580离心机:德国Eppendorf公司;Multiskan MK3型酶标仪:Thermo公司。
1.2 试验方法
1.2.1 黑果枸杞蛋白的制备
将黑果枸杞称重,粉碎,用30 mmol/L pH 7.4的Tris-HCl缓冲液4℃浸提1 h,浸提液7 000 r/min离心,收集上清液,用膜孔径为0.45 μm的中空纤维膜过滤系统进行微滤,将收集的滤液用截留分子量为10kDa的中空纤维膜过滤系统进行超滤、浓缩,将内滤液冷冻干燥后即得黑果枸杞蛋白[12-18]。
1.2.2 黑果枸杞蛋白的含量测定
按考马斯亮蓝法(Bradford法)[19-21]以蛋白浓度(mg/mL)为横坐标,吸光度值为纵坐标,绘制标准曲线,并测定黑果枸杞蛋白的含量,计算提取率。
1.2.3 黑果枸杞蛋白提取单因素试验
1.2.3.1 不同pH值的缓冲溶液对黑果枸杞蛋白提取率的影响
准确称量5 g黑果枸杞粉于试管中,按照液料比15∶1(mL/g)向每个试管加入 pH 值为 6、7、8、9 的缓冲溶液,在4℃下浸提18 h,浸提2次,过滤,离心30 min,取上清液测定蛋白含量,计算提取率,确定浸提溶液的pH值。
1.2.3.2 不同浸提时间对黑果枸杞蛋白提取率的影响
准确称量5 g黑果枸杞粉于试管中,按照液料比15∶1(mL/g)向各试管加入pH值为7的缓冲溶液,在4 ℃下浸提 2 次,每次浸提 6、12、18、24 h,过滤,离心30 min,取上清液测定蛋白含量,计算提取率,确定浸提时间。
1.2.3.3 不同液料比对黑果枸杞蛋白提取率的影响
准确称量5 g黑果枸杞粉于试管中,按照液料比5∶1、10∶1、15∶1、20∶1(mL/g)向各试管加入 pH 值为 7 的缓冲溶液,在4℃下浸提2次,浸提18 h,过滤,离心30 min,取上清液测定蛋白含量,计算提取率,确定浸提液料比。
1.2.3.4 不同浸提次数对黑果枸杞蛋白提取率的影响
准确称量5 g黑果枸杞粉于试管中,按照液料比15∶1(mL/g)向各试管加入pH值为7的缓冲溶液,在4 ℃下浸提 18 h,提取次数分别为 1、2、3、4 次,过滤,离心30 min,取上清液测定蛋白含量,计算提取率,确定浸提次数。
1.2.4 黑果枸杞蛋白提取工艺优化试验
在单因素试验的基础上,根据响应面法中Box-Behnken设计原理[22-25],以浸提时间、浸提次数、液料比为自变量,蛋白提取率为因变量,进行三因素三水平的响应面法分析试验,确定黑果枸杞色素提取的最佳工艺。响应面试验设计见表1。
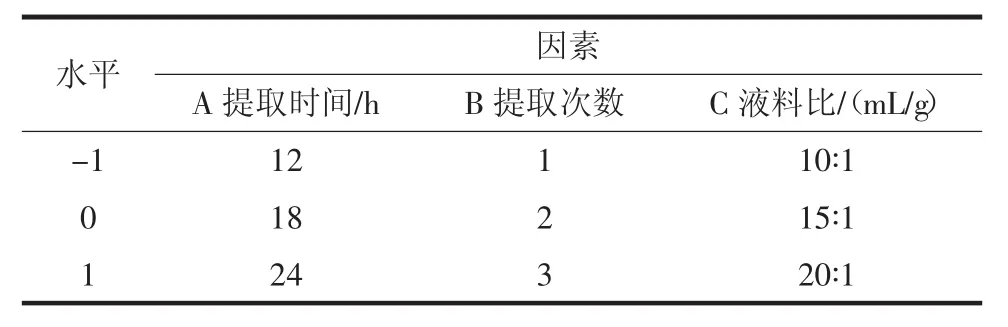
表1 响应面试验因素水平Table 1 Factors and levels of response surface methodology
1.2.5 验证试验
对响应面优化试验得到的黑果枸杞蛋白提取工艺结果进行重复试验,以验证提取工艺的可靠性。
1.2.6 实验动物分组和给药剂量
昆明种清洁级小鼠,雌雄各半,体重18 g~22 g。动物质量合格编号:SCXK-2012-0002,由吉林大学基础医学院实验动物中心提供。小鼠自由摄食和饮水,试验开始前让小鼠先适应1周,检查合格后开始进入正式试验。取50只昆明种小鼠,按体重随机分成5组,每组雌鼠5只,雄鼠5只。5组分别为空白对照组(control),老年模型组(aging model,AM),黑果枸杞蛋白低剂量组(LRP-LG),黑果枸杞蛋白中剂量组(LRP-MG)和黑果枸杞蛋白高剂量组(LRP-HG)。空白对照组每天灌胃等体积的蒸馏水,其他实验组颈背部皮下注射浓度为1 000 mg/(kg·d)的D-半乳糖,连续注射30 d后,老年模型组灌胃蒸馏水[10 mL/(kg·d)],低中高剂量组分别灌胃浓度为125、250、500 mg/(kg·d)的黑果枸杞蛋白样品,连续灌胃30 d。
1.2.7 生化指标的测定
禁食12 h以后,处死小鼠,立即眼球取血,收集血清利用试剂盒提供的方法测定SOD、GSH-Px、CAT的活力以及MDA的含量。
2 试验结果
2.1 黑果枸杞蛋白的含量测定
采用考马斯亮蓝法(Bradford法)测蛋白含量,标准曲线如图 1所示,y=13.107x+0.009 6,R2=0.999 4。

图1 蛋白标准曲线Fig.1 Protein standard curve
2.2 单因素试验结果
2.2.1 缓冲溶液的pH值对黑果枸杞蛋白提取率的影响缓冲溶液的pH值对黑果枸杞蛋白提取率的影响见图2。

图2 pH值对黑果枸杞蛋白提取率的影响Fig.2 Effect of pH value on the protein extraction rate of Lycium ruthenicum
缓冲液的pH值对蛋白提取率具有重要影响,由图2可见,缓冲溶液pH值为7时蛋白提取率最高,pH值为6、8和9时蛋白提取率均急剧下降,故确定缓冲溶液最优pH值为7。
2.2.2 浸提时间对黑果枸杞蛋白提取率的影响
浸提时间对黑果枸杞蛋白提取率的影响见图3。

图3 浸提时间对黑果枸杞蛋白提取率的影响Fig.3 Effect of extraction time on the protein extraction rate of Lycium ruthenicum
由图3可见,随着浸提时间的增加,蛋白提取率随之增加。浸提6 h到浸提12 h蛋白提取率升高较快,浸提12 h到浸提24 h蛋白提取率升高放缓,考虑到浸提时间过短可能导致蛋白提取不充分,故确定最优值应存在于 12 h~24 h。
2.2.3 液料比对黑果枸杞蛋白提取率的影响
液料比对黑果枸杞蛋白提取率的影响见图4。
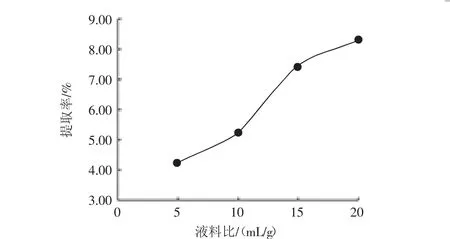
图4 液料比对黑果枸杞蛋白提取率的影响Fig.4 Effect of liquid/solid ratio on the protein extraction rate of Lycium ruthenicum
液料比对蛋白提取率有着重要影响,由图4可见,液料比 5∶1(mL/g)~15∶1(mL/g)区间蛋白提取率升高较快,液料比 20∶1(mL/g)时提取率增长放缓,说明在此比例下蛋白溶出趋于饱和,故确定最优值存在于10∶1(mL/g)~20∶1(mL/g)之间。
2.2.4 浸提次数对黑果枸杞蛋白提取率的影响
浸提次数对黑果枸杞蛋白提取率的影响见图5。
图5可见,浸提3次与浸提4次蛋白提取率几乎相同,浸提次数过多不仅浪费成本还可能导致提取蛋白中杂质增多,故确定最优值存在于1次~3次之间。
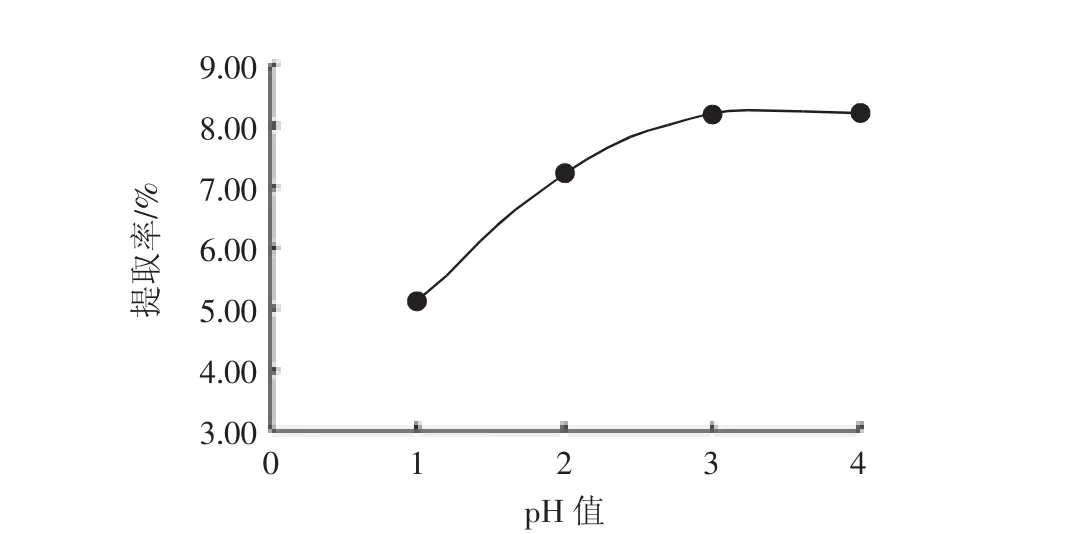
图5 浸提次数对黑果枸杞蛋白提取率的影响Fig.5 Effect of extraction times on the protein extraction rate of Lycium ruthenicum
2.3 响应面试验结果与分析
2.3.1 响应模型的建立与分析
根据单因素试验结果,由于存在明显的缓冲溶液最优pH值,故而在响应面试验中不再考察此项。选取响应面试验因素为A提取时间、B提取次数、C液料比,提取率为响应值,采用Design-expert 8.0.6.1软件按照Box-Benhnken试验设计了17组试验,12组为析因点试验,5组为重复零点试验,结果见表2。

表2 响应面试验方案及结果Table 2 Response surface experimental results
运用Design Expert8.0.6.1软件对表3的数据进行二次多元回归分析,得到黑果枸杞蛋白提取率预测值(Y)对自变量A、B和C的二次多项回归方程模型:
Y=-13.15+0.83A+5.76B+0.84C+0.01AB+0.01AC-0.01BC-0.02A2-1.35B2-0.03C2

表3 响应面试验方差分析Table 3 Variance analysis of regression model
从方差分析结果可知(见表3),模型回归项p<0.05,说明所选择模型显著。各因素的影响大小为A提取时间>C液料比>B提取次数,表中的A、B、C、AB、AC、BC、A2、B2、C2的 p 值均小于 0.05,说明这些均是较显著的模型项。模型失拟项p>0.05,不显著,表示试验误差小,操作可行,模型对试验拟合情况较好。回归方程能够拟合因素与响应值之间的函数关系。可以通过回归方程的分析来寻求最优工艺参数。模型的的绝对系数R2=0.999 6,说明响应值的变化有99.96%来自于所选变量优化,因此回归方程可以很好地描述各因素与响应值之间的关系。
2.3.2 响应面交互作用分析与优化
各因素的响应面图和等高线图见图6~图7。
该图组可直观地反映各因素及其交互作用对蛋白得率大小的影响程度。其中等高线的形状可以反映两因素间交互作用的强弱,圆形表示两因素间交互作用较弱,椭圆表示两因素间交互作用较强。

图6 提取时间与提取次数交互作用的响应面图和等高线图Fig.6 The response surface and contour map of extraction time and extraction times

图7 提取时间与液料比交互作用的响应面图和等高线图Fig.7 The response surface and contour map of extraction time and liquid/solid ratio
由图6~图8可以看出,随着各个因素值的增加,提取率均呈现先增大后减小的趋势且响应面存在最高点,说明所筛选范围存在极值。由图6可以看出提取次数曲面比提取时间曲面坡度陡峭,说明提取次数对蛋白提取率的影响比提取时间的影响大。由图7可以看出提取时间比液料比对蛋白提取率的影响大,图8中提取次数与料液比的曲面坡度陡峭程度一致,说明两因素对蛋白提取率影响一致。以上结果分析均与二元回归方程系数相符合。

图8 提取次数与液料比交互作用的响应面图和等高线图Fig.8 The response surface and contour map of extraction times and liquid/solid ratio
通过软件Design-Expert 8.0.6.1求解方程,得出了最优提取工艺条件:提取时间20.82 h,提取次数2.11次,液料比 16.59∶1(mL/g),提取率预测值 8.53%。为了便于进行试验,对该条件进行修正:提取时间21 h,提取次数 2 次,液料比 17∶1(mL/g)。
2.3.3 验证试验结果
按照修正试验条件重复试验3次,取平均值,最终蛋白提取率为8.62%,与预测值相差0.01%。结果说明模型与试验拟合程度良好,由模型优化得出的最佳工艺具有实际应用价值。
2.4 小鼠体征和行为结果
造模前各组小鼠皮毛光亮、行动活泼、饮食正常。造模1周后,与空白对照组相比,模型组小鼠食欲减退、形体消瘦、体重减轻、毛色灰暗、竖毛、活动减少,呈现明显的衰老体征。给药黑果枸杞蛋白后,与衰老模型组对比,给药30 d后,黑果枸杞蛋白各剂量组小鼠皮毛较光亮、活泼、纳食正常,与空白对照组小鼠相比,行为体征无明显差异。
2.5 小鼠血清生化指标结果
黑果枸杞蛋白对小鼠GPX、SOD、CAT和MDA的影响见表4。
衰老模型组与空白对照组相比,血清中GSH-Px、SOD活性显著下降(p<0.01),CAT活性明显下降(p<0.05),MDA含量显著上升(p<0.01),证明小鼠衰老模型成立。
在本次试验结果中不难看出,与老年模型组相比,黑果枸杞蛋白高剂量组可显著提升GSH-Px、SOD和 CAT 活性(p<0.01)并降低 MDA 含量(p<0.01);黑果枸杞蛋白中剂量组能显著提高GSH-Px活性(p<0.01),显著降低MDA含量(p<0.01);黑果枸杞低剂量组能够显著提升 GSH-Px活性(p<0.01),SOD 和 CAT活性升高明显(p<0.05),结果表明黑果枸杞蛋白高剂量组缓解衰老的效果较好,可提升GSH-Px、SOD以及CAT活性,且使细胞中MDA含量下降到正常水平从而达到延缓衰老的作用。

表4 黑果枸杞蛋白对小鼠GPX、SOD、CAT和MDA的影响Table 4 Effects of LRP on GPX,SOD,CAT and MDA in mice
3 结论与讨论
本研究通过单因素试验得出响应面优化条件,得出黑果枸杞蛋白提取最佳条件为pH值为7,提取时间21 h,提取次数 2 次,液料比 17∶1(mL/g),在最优条件下,蛋白提取率为8.62%,为后续研究打下基础。
老化是调节机制失调的结果,代谢失调会导致多种心脑血管疾病,以及其他器官的疾病,而这些都与体内氧化应激损伤有关。自由基学说是具有代表性的衰老学说之一,该理论认为,随着年龄的增长,体内自由基平衡体系逐渐被破坏,造成自由基过剩。过量自由基可通过过氧化作用攻击细胞膜及核酸、蛋白质和酶类等生物大分子,引起细胞膜上的不饱和脂肪酸产生脂质过氧化反应,核酸及蛋白质分子交联,DNA基因突变或复制异常及生物酶活力下降,最终导致细胞功能严重受损以致衰老,甚至死亡。过量的D-半乳糖破坏并消耗机体抗氧化防御系统,造成机体自由基过剩,此时,GSH-Px、SOD及CAT活性高低的变化可以反映机体抗氧化能力的大小,活性越高表示抗氧化能力越强,而MDA含量的高低则可以反映机体自由基累积及脂质过氧化损伤的程度[26-27]。本试验中,我们建立了小鼠的衰老模型,所采用的皮下注射D-半乳糖方法是目前我国建立衰老模型最常用的方法之一。本研究通过小鼠体内的GPX、SOD、CAT和MDA水平的变化来测定黑果枸杞蛋白对小鼠抗氧化应激损伤的保护作用,试验结果显示:LRP能显著降低MDA含量并提高SOD、GSH-Px和CAT活力,提示黑果枸杞蛋白可通过提高机体抗氧化能力和直接清除自由基等发挥其延缓衰老的作用,但其作用机理还有待于进一步研究。本试验为黑果枸杞的滋补功能和抗衰老的研究提供了一定理论依据。
