阳荷根乙醇提取物的生物活性研究
2019-03-23白雅竹陈良华许传俊童庆宣林河通明艳林
白雅竹,梁 诗,陈良华,黄 雯,许传俊,童庆宣,,林河通,明艳林
(1.福建农林大学食品科学学院,福建 福州 350002;2.厦门华侨亚热带植物引种园/厦门市植物引种检疫与植物源产物重点实验室,福建 厦门 361002;3.福建省亚热带植物研究所/福建省亚热带植物生理生化重点实验室,福建 厦门361006)
阳荷Zingiber striolatum为姜科Zingiberaceae姜属植物,是我国特有的药食两用植物资源[1—2]。民间最常食用的部位是其根部和花苞。阳荷在我国南方有悠久的种植和食用历史。近年来,众多研究者研究其花苞的生物活性成分及药理药性[3—5],如降血糖[6]、抗氧化[7]、抗炎抑菌[8]等。但是对阳荷根的生物活性研究较少。俞永琼等[9]根据《安徽中草药》[10]中提到的“鲜阳荷(根)捣烂外敷,干则更换,治皮肤风疹”对阳荷根进行成分及药理活性研究,采用TLC法提出阳荷根中多种成分,但并未对这些成分进行结构分析和生物活性研究;马佶等[11]用TLC法对其成分预判为酚类、皂苷、生物碱、氨基酸类物质。王丽娜等[12]对阳荷根进行小鼠体内急性毒理实验,发现其具有较高的药用价值。
机体在进行新陈代谢时,不可避免地会产生一些多余的自由基或者接触到亚硝酸盐和亚硝胺。这些物质随着血液循环到达机体的各个部位,会使机体结构受到破坏,造成细胞功能丧失,基因突变,甚至演变成癌症或者坏死[13—14]。因此,本文以抗氧化、抑硝化、抗肝癌细胞为活性初筛平台,以体系内自由基残余量、亚硝酸盐和亚硝胺合成量,以及肝癌细胞的相对存活率为指标判断阳荷根乙醇提取物的生物活性,进而得出活性较好的部位。
1 材料与方法
1.1 材料
阳荷根于2019年3月采自湖北宜昌五峰县,由厦门华侨亚热带植物引种园梁诗助理研究员鉴定。采摘后清洗,经60 ℃烘干至恒重,过40目筛,室温避光密封保存。
主要试剂:DPPH、ABTS(分析纯,美国Sigma-Aldrich公司);Vᴄ、过硫酸钾、盐酸、α-萘胺(分析纯,国药集团化学试剂有限公司);磷酸二氢钠、磷酸氢二钠、亚硝酸钠、对氨基苯磺酸、盐酸奈乙二胺、碳酸钠(分析纯,西陇化工股份有限公司);MTT(上海生工生物工程技术服务有限公司)。
主要仪器:旋转蒸发仪(型号2100,东京EYELA理化器械株式会所);循环水式真空泵(型号SHBIII,郑州长城科工贸有限公司);真空冷冻干燥机(型号A联培ha-4LDplus,德国Christ公司);三用紫外分析仪(型号ZF-20D,上海越众仪器设备有限公司);酶标仪(型号Multiskan MK3,美国Thermo Fisher Scientific公司);倒置显微镜(型号DiapHot300,Olympus株式协会)。
1.2 方法
1.2.1 样品制备 称取恒温干燥后的阳荷根粉末,以75%乙醇为提取剂,45 ℃超声辅助提取3次(1:7、1:7、1:6),合并提取液,旋蒸浓缩,冷冻干燥,得到粗提物(ZC)。将ZC采用湿法上样,装入经处理的大孔树脂HP-20。采用梯度洗脱:将流动相乙醇/水按0%、25%、50%、75%、95%梯度连续洗脱,每梯度冲洗3个柱体积,分别收集梯度样品液,旋蒸冻干,得到5个样品分别记为ZC-Ⅰ、ZC-Ⅱ、ZC-Ⅲ、ZC-Ⅳ、ZC-Ⅴ,分别配置适宜质量浓度溶液作为供试样品。
1.2.2 不同浓度乙醇梯度洗脱物抗氧化活性测定
1.2.2.1 DPPH自由基清除能力测定 方法参照Sonklin等[13]并稍作修改。取0.2 mmol·L-1DPPH乙醇溶液2 mL于5 mL离心管中,加入供试样品2 mL。静置15 min,在517 nm下检测其吸光度,记为AS;用蒸馏水代替供试样品作为空白对照,记为A0;用无水乙醇代替DPPH溶液作为本底对照,记为A1。用抗坏血酸作为阳性对照。不同梯度洗脱物作用下体系中DPPH自由基的残余量按下式计算:

1.2.2.2 ABTS自由基清除能力测定 试验方法参照Jiao等[15]和赵玉静等[16]并稍作修改。取ABTS供试液2 mL于5 mL离心管中,再加入供试样品2 mL。静置15 min,在734 nm下检测其吸光度,记为AS;用蒸馏水代替供试样品作为空白对照,记为A0;用蒸馏水代替ABTS供试液作为本底对照,记为A1。用抗坏血酸作为阳性对照。不同梯度洗脱物作用下体系中ABTS自由基的残余量按下式计算:

1.2.3 不同浓度乙醇梯度洗脱物抑硝化活性测定
1.2.3.1 清除亚硝酸盐能力测定 参照黄晓冬等[17]和 Choi等[18]方法并稍作修改。在玻璃试管中依次加入磷酸缓冲液(PBS,pH 3) 0.5 mL、25 μg·mL-1NaNO21 mL、供试样品1 mL,充分震荡后,37 ℃水浴。1 h后取出,静置至室温,后加入0.1%对氨基苯磺酸钠1 mL,摇晃均匀。5 min 后加入0.01%盐酸萘乙二胺1 mL。静置15 min,在540 nm波长下检测其吸光度,记为AS;用蒸馏水代替供试样品作为空白对照,记为A0;用蒸馏水代替NaNO2溶液作为本底对照,记为A1。用不同浓度梯度的VC溶液作为阳性对照。不同梯度洗脱物作用下体系中亚硝酸盐的含量按下式计算:
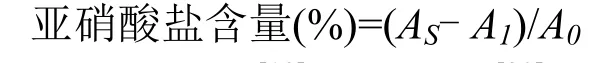
1.2.3.2 阻断亚硝胺合成能力测定 参照傅茂润等[19]和Liao等[20]方法并稍作修改。在玻璃试管中依次加入PBS(pH 3) 0.8 mL、50 μg·mL-1NaNO20.2 mL、二甲胺0.2 mL、供试样品0.4 mL,充分震荡后,37 ℃水浴。1 h后取出,加入0.5% Na2CO30.8 mL,静置至室温,置于365 nm紫外暗箱分析仪中照射15 min,加入1%对氨基苯磺酸钠0.8 mL,摇晃均匀,5 min后加入0.1%盐酸奈乙二胺0.8 mL,静置15 min。在525 nm下检测其吸光度,记为AS;用蒸馏水代替供试样品作为空白对照,记为A0;用蒸馏水代替NaNO2溶液作为本底对照,记为A1。用不同浓度梯度抗坏血酸溶液作为阳性对照。不同梯度洗脱物作用下体系中亚硝胺合成阻断率按下式计算:
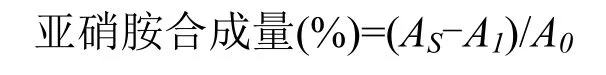
1.2.4 不同浓度乙醇梯度洗脱物抗肿瘤活性测定
1.2.4.1 细胞培养 肝癌细胞株 HepG2和 SMMC7721分别用含有 10%热灭活胎牛血清(FBS)、100 U·mL-1青霉素、100 U·mL-1链霉素的高糖培养基和RPMI1640培养基,置于37 ℃、5% CO2及饱和湿度下恒温培养。每隔1~2 d更换一次培养液。
1.2.4.2 MTT法测定细胞存活率 取处于对数生长期的HepG2和SMMC7721细胞,将细胞浓度调至每毫升3.5×104个,分别接种于96孔板上,每孔100 μL。贴壁24 h 后,每孔加入含有不同浓度的药物培养基100 μL,同时设细胞对照组和平行试验组。24 h后避光加入5 mg·mL-1MTT 20 μL,37 ℃继续孵育6 h,吸弃含MTT培养基,加入二甲基亚砜100 μL,充分震荡并溶解生成的甲臜后在570 nm下用酶标仪测定吸光度,并记录数据。每种细胞株重复3次。用统计软件GraphPad Prism计算药物对细胞的半抑制率(IC50),数据以平均值±标准差表示。不同梯度洗脱物对肝癌细胞的相对存活率按下式计算:相对存活率(%)=[1-(A对照-A加药)/(A对照-A空白)]×100
2 结果与分析
2.1 不同浓度乙醇梯度洗脱物抗氧化能力
通过体外清除自由基能力分析阳荷根乙醇提取物抗氧化能力。图1表示阳性对照Vᴄ在该体系中所示浓度梯度下对两种自由基清除残余量的大小。图2显示,在一定质量浓度范围内,DPPH、ABTS两种自由基残余量都与供试样品浓度呈正相关。在最大浓度 5 mg·mL-1时,75%乙醇粗提物(ZC)体系下DPPH自由基的残余量为6.88%(图2:A),75%乙醇粗提物经蒸馏水洗脱部分(ZC-Ⅰ)体系下,DPPH自由基的残余量为11.42%,对DPPH的清除效果略低于ZC(图2:B);50%乙醇洗脱部分(ZC-Ⅲ)在质量浓度为1 mg·mL-1时,DPPH自由基的残存量为4.7%(图2:D);25%乙醇洗脱部分(ZC-Ⅱ)(图2:C)、75%乙醇洗脱部分(ZC-Ⅳ)(图2:E)、95%乙醇洗脱部分(ZC-Ⅴ)(图2:F)在质量浓度为3 mg·mL-1时,DPPH自由基的残存量分别仅为3.85%、9.23%、5.82%。
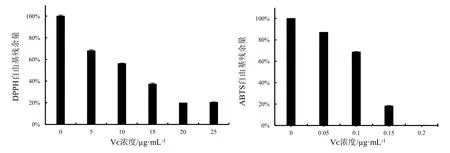
图1 Vᴄ对DPPH、ABTS自由基的清除能力Fig.1 Scavenging effects of Vᴄ on DPPH and ABTS
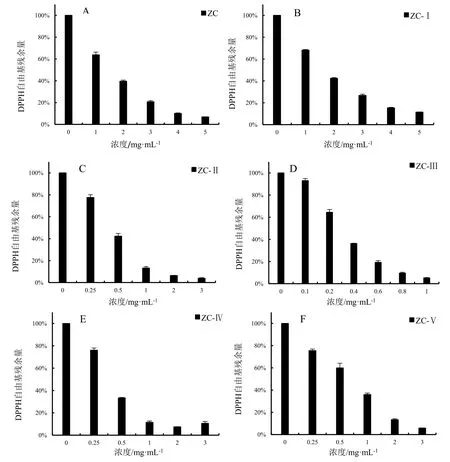
图2 阳荷根乙醇粗提物及其不同浓度乙醇洗脱物的DPPH自由基清除能力Fig.2 Scavenging effects of crude extract with ethanol and its gradient elution from Zingiber striolatum root on DPPH
由图3可得,不同浓度乙醇洗脱物对ABTS的清除效果均优于ZC。在质量浓度为0.8 mg·mL-1体系中,ZC清除ABTS的残余量仅为27.14%,ZC-Ⅰ、ZC-Ⅴ对ABTS的残余量分别为24.12%、8.14%;质量浓度为0.4 mg·mL-1体系中,ZC-Ⅱ、ZC-Ⅲ、ZC-Ⅳ清除ABTS的残余量分别为5.10%、0.30%、6.00%。
6种供试样品及阳性对照Vᴄ对DPPH、ABTS清除率达50%时的浓度(IC50)见表1。在试验体系下,阳性对照Vᴄ对DPPH、ABTS的IC50值分别为0.012 mg·mL-1、0.001 mg·mL-1;在所有测试浓度下,阳荷根75%乙醇粗提物经50%乙醇洗脱部分(ZC-Ⅲ)对DPPH、ABTS的IC50值最低,分别为0.292 mg·mL-1、0.070 mg·mL-1。
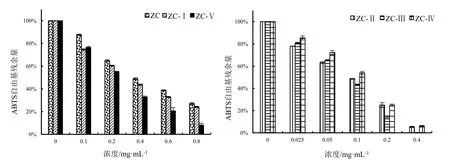
图3 阳荷根乙醇粗提物及不同浓度乙醇洗脱物的ABTS自由基清除能力Fig.3 Scavenging effects of crude extract with ethanol and its gradient elution from Zingiber striolatum root on ABTS
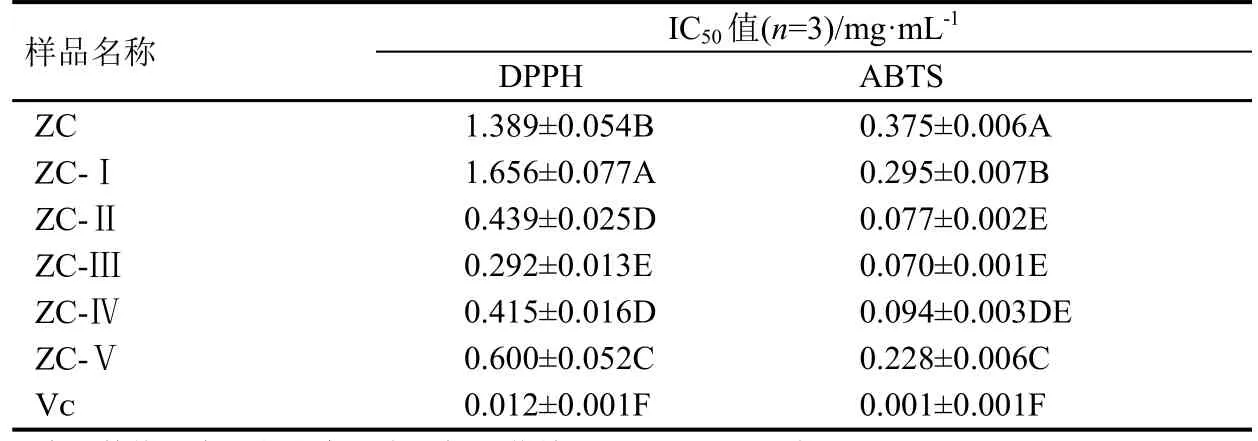
表1 阳荷根乙醇提取物及Vᴄ清除DPPH和ABTS的IC50值Table 1 IC50 values of ethanol extracts from Zingiber striolatum root and Vᴄto remove DPPH and ABTS
2.2 不同浓度乙醇梯度洗脱物抑硝化能力
图4为阳性对照不同浓度Vᴄ的亚硝酸盐含量和亚硝胺合成量大小。根据体系和样品的溶解性,选择 75%乙醇粗提物(ZC)及其蒸馏水洗脱部分(ZC-Ⅰ)、25%乙醇洗脱部分(ZC-Ⅱ)和 50%乙醇洗脱部分(ZC-Ⅲ)分析其对亚硝酸盐的残余量和对亚硝胺合成量的影响。如图5所示,随着药物浓度增加,其对亚硝酸盐的清除率和亚硝胺合成的阻断率逐渐增大。与ZC相比,ZC-Ⅱ清除亚硝酸盐的能力明显增强,最大浓度20 mg·mL-1时体系中二者亚硝酸盐含量分别为31.26%、16.14%;ZC-Ⅰ和ZC-Ⅲ体系下,清除亚硝酸盐的能力相对较弱,亚硝酸盐含量分别为53.24%、40.6%(图5:A)。ZC-Ⅰ对亚硝胺的合成影响不大,亚硝胺含量为77.41%,另三种供试样品ZC、ZC-Ⅱ、ZC-Ⅲ体系下的亚硝胺合成量分别为30.29%、11.06%、13.76%(图5:B)。由表2中的IC50值可得,在所示试验体系下,阳性对照Vᴄ的IC50值分别为0.391 mg·mL-1、0.0248 mg·mL-1。在所示浓度下,ZC-Ⅱ对亚硝酸盐的清除能力显著高于其他三种供试样品(P<0.01)。四种供试样品对亚硝酸盐的清除能力大小顺序为:ZC-Ⅱ>ZC>ZC-Ⅲ>ZC-Ⅰ;对亚硝胺合成的阻断能力大小顺序为:ZC-Ⅱ>ZC-Ⅲ>ZC>ZC-Ⅰ。
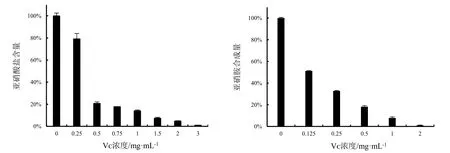
图4 Vᴄ抑硝化能力Fig.4 Scavenging effects of Vᴄ on nitrite and the ability to block the synthesis of nitrosamine
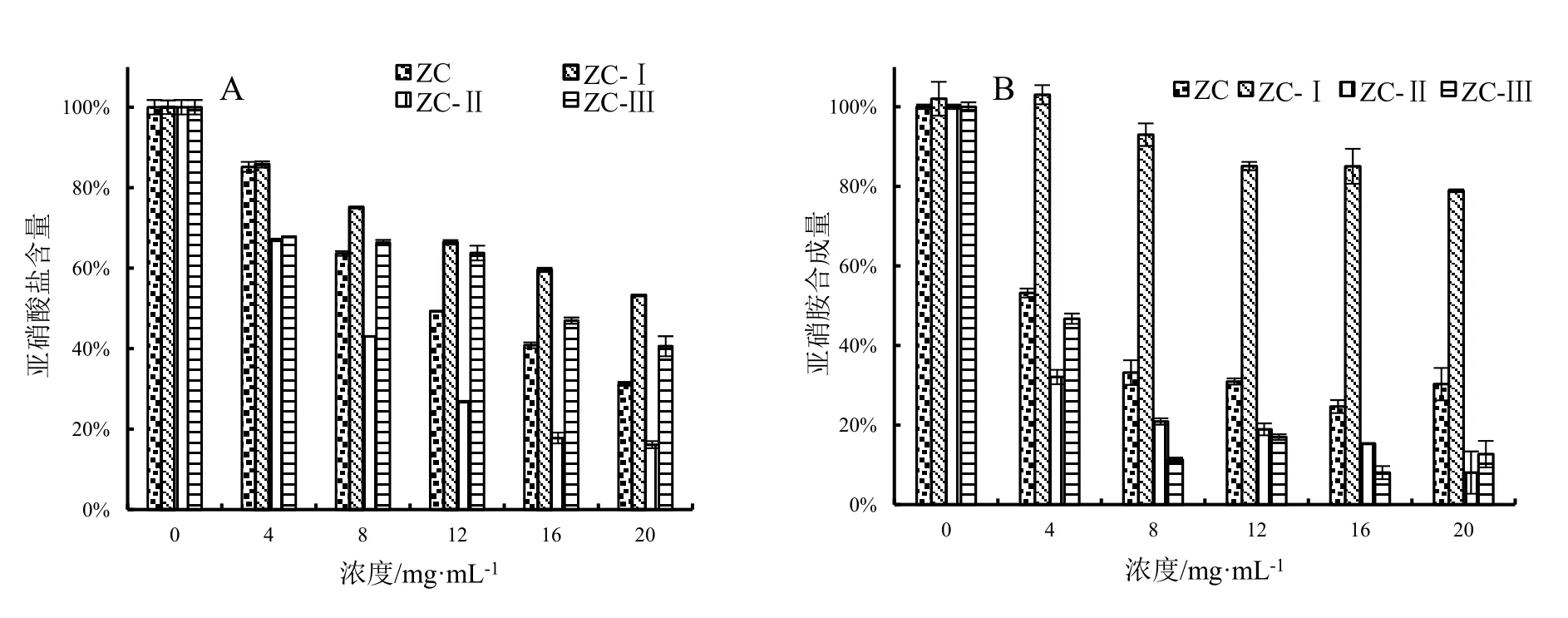
图5 阳荷根乙醇提取物硝化能力比较Fig.5 Scavenging effects of extracts with ethanol from Zingiber striolatum root on nitrite and the ability to block the synthesis of nitrosamine

表2 阳荷根乙醇提取物及Vᴄ清除亚硝酸盐和阻断亚硝胺合成的IC50值Table 2 IC50 values of nitrite scavenging ability and synthetic nitrosamine blocking ability of extracts with ethanol from Zingiber striolatum root and Vᴄ
2.3 不同浓度乙醇梯度洗脱物对肝癌细胞株生长的影响
2.3.1 MTT形态学观察 两株肝癌细胞在阳荷根乙醇粗提物及不同浓度乙醇洗脱物处理24 h后呈现出不同的细胞状态。空白对照组(0 μg·mL-1)的两株细胞HepG2和SMMC7721单层贴壁,长势较好,细胞数量多且大小均匀。经乙醇粗提物及0%、25%、50%、75%乙醇洗脱物在其浓度0~200 μg·mL-1范围内处理的细胞并无明显变化。但经95%乙醇洗脱物(ZC-Ⅴ)处理的细胞表现出细胞数量减少、体积缩小、从内涨裂而死亡的现象,并呈现出明显的浓度依赖现象(图6)。

图6 阳荷根乙醇提取物95%乙醇洗脱部分(ZC-Ⅴ)处理的肝癌细胞HepG2和SMMC7721形态学变化Fig.6 Morphological changes of liver cancer cell HepG2 and SMMC7721 treated with ethanol crude extract washed with 95% ethanol (ZC-Ⅴ) from Zingiber striolatum root
2.3.2 MTT结果分析 通过分析HepG2细胞株和SMMC7721细胞株的相对存活率评价阳荷根不同乙醇提取物的抗肝癌能力。与空白对照组(提取物浓度为0)相比,在图示质量浓度下,不同供试样品对两种细胞株的相对存活率均有一定程度的抑制,除95%乙醇洗脱物(ZC-Ⅴ)样品外,其他样品的细胞毒性不明显,其中 ZC-Ⅴ对 HepG2 和 SMMC7721 细胞株的 IC50值分别为 57.84 μg·mL-1、56.78 μg·mL-1(图 7:A~D)。供试样品对两种细胞株的相对存活率效果一致。
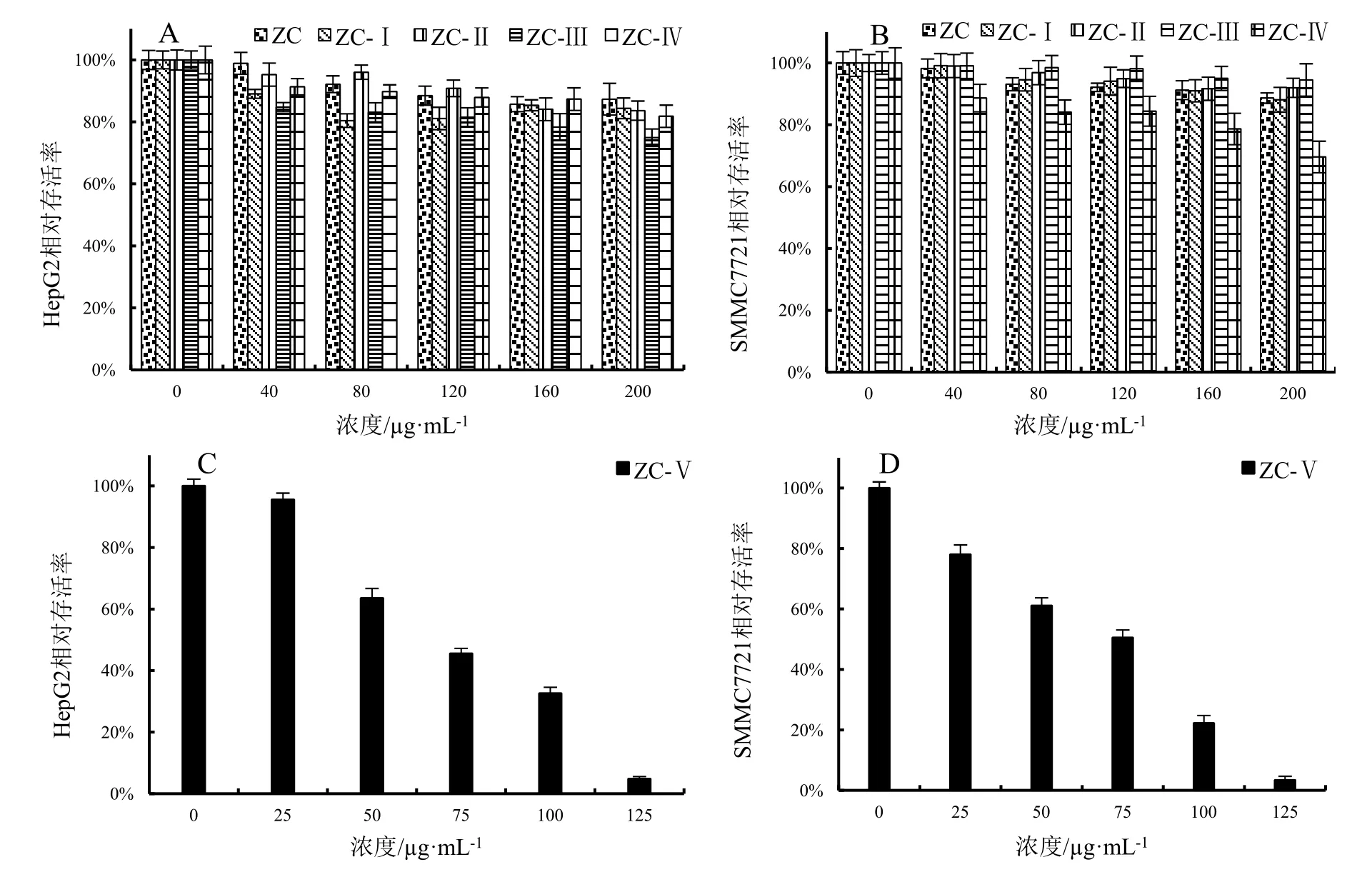
图7 阳荷根乙醇提取物对HepG2和SMMC7721两种细胞株细胞存活率的比较Fig.7 Comparisons of cell viability of HepG2 and SMMC7721 cell lines treated with ethanol extracts from Zingiber striolatum root
3 讨论
应用“相似相溶”原理,利用不同乙醇浓度(即极性不同)的洗脱溶剂将阳荷根不同极性成分分离开,然后将各部分富集,得到不同的供试样品。含有不同成分的供试样品具有不同的生物活性,体外模型实验结果显示,阳荷根 75%乙醇粗提取物(ZC)及其通过大孔树脂不同浓度乙醇洗脱产物的生物活性具有显著差异。和ZC相比,乙醇洗脱的部位抗氧化和抑硝化活性较高,从IC50值可知,粗提物50%乙醇洗脱部分(ZC-Ⅲ)对体外自由基 DPPH的清除效果和 25%乙醇洗脱部分(ZC-Ⅱ)的清除亚硝酸盐能力虽仅为Vᴄ的1/20,就其作为日常蔬菜或者煲汤的常用材料而言,有较大的应用前景,可在预防肿瘤方面大力推广。据MTT实验,95%乙醇洗脱物(ZC-Ⅴ) (IC50=56.7~57.8 μg·mL-1)具有显著的抗肝癌细胞株生长活性,即当样品质量浓度分别仅为57.84、56.78 μg·mL-1时,两种肝癌细胞的相对存活率达到50%,与姜科植物生物活性成分大多集中在弱极性或中极性部位的结果一致[21—22],并且在ZC-Ⅴ部位浓度达125 μg·mL-1时,其对肝癌细胞的抑制率能达95%以上,这为其抗肝癌药理活性提供理论支撑。
