甲氧香螨酯亚致死浓度对截形叶螨Tetranychus truncates解毒酶活性变化的影响
2019-03-22杨磊高娟桃白映禄尚素琴陈斌
杨磊,高娟桃,白映禄,尚素琴,陈斌
(1.云南农业大学植物保护学院,云南 昆明 650201;2.甘肃农业大学植物保护学院,甘肃省农作物病虫害生物防治工程实验室,甘肃 兰州 730070)
截形叶螨(Tetranychustruncatus)是我国棉花、玉米、大豆等大田作物、蔬菜及多种果树上的主要害螨之一[1].该螨体小、繁殖快、适应性强,往往引起作物落叶、落花、落果,造成长势削弱、减产,甚至失收或整株死亡[2].近年来,甘肃河西玉米杂交制种迅速发展,成为我国最大的杂交玉米种子的生产基地,但截形叶螨危害严重,影响了制种玉米的产量和品质,给甘肃制种业造成很大的损失[3-4],同时在我国北方玉米产区,其危害也是日趋加重,已成为制约玉米生产的主要因素之一[5].一般对该螨的防治大多依赖化学农药,除了造成对环境的不良影响外,其抗药性日益严重[6-7].因此,明确其抗性机制,延长农药的使用寿命显得尤为重要.
杀虫、杀螨剂施于田间后,除了直接杀死靶标害虫外,在环境中的毒力会逐渐稀释,递减到亚致死浓度(剂量),从而造成昆虫生态行为的变化,包括生殖力和发育历期的改变、产生抗药性等,即亚致死效应.因此,了解药剂的亚致死效应是评价其药效和评估农药风险管理的关键[8].一般认为谷胱甘-S-转移酶(GST)、羧酸酯酶(CarEs)、多功能氧化酶(MFOs)是螨类体内重要的解毒酶[8],亚致死浓度的杀螨剂或植物次生物质会对叶螨体内的多种酶系产生诱导或抑制作用,从而为害虫抗药性进化提供持续的选择压力[10].
甲氧香螨酯又称东莨菪内酯,是一种新型植物次生代谢物质,属于香豆素类化合物,具有良好的杀虫、抗菌杀菌、杀螨、化感等农用生物活性[11].作为新型植物源农药,目前的研究仅有对朱砂叶螨种群生长和繁殖的影响,而对其解毒酶影响的研究还未见报道.本研究采用LC10和LC30的甲氧香螨酯处理截形叶螨,在2、4、6、12、24、36、48、60、72 h共9个时间点测定了其体内谷胱甘-S-转移酶(GST)、羧酸酯酶(CarEs)、多功能氧化酶(MFOs)活性随时间的变化情况,旨在为截形叶螨的综合防治及甲氧香螨酯的合理使用提供科学依据.
1 材料与方法
1.1 供试虫源
截形叶螨:2008年采自甘肃农业大学未接触过任何农药的玉米试验田,以四季豆在T=(25±1)℃,RH(60±5)%,光周期16 h∶8 h条件下继代饲养.期间未接触任何药剂.
1.2 供试药剂和仪器
1.2.1 供试药剂 甲氧香螨酯scopoletin,含量≥99%,(成都德思特生物科技有限公司);GSTs活性测定试剂盒(北京索莱宝科技有限公司);CarEs活性测定试剂盒(北京索莱宝科技有限公司);MFOs活性测定试剂盒(上海江莱生物科技有限公司).
1.2.2 供试仪器 H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司),ELX800UV酶标仪(Bio-Tek Instruments).
1.3 亚致死浓度的测定
采用叶片浸渍法[13],选取直径为9.5 cm,高为1.0 cm的培养皿,将海绵剪成直径为9.0 cm的圆放入培养皿,加水至饱和,再加上滤纸后备用;根据预试验设置甲氧香螨酯质量浓度为1.0、0.5、0.25、0.125、0.062 5 mg/L 5个梯度,剪取新鲜的菜豆叶片,分别浸入事先配好的药液中5 s,取出后晾干,背面朝上放入准备好的培养皿,用吸水的脱脂棉包裹叶片边缘和叶柄,挑取截形叶螨雌成螨,每个质量浓度梯度3个重复,对照用27.5%丙酮水 ,每个重复30头雌成螨,挑完之后放入光照培养箱,培养条件为温度(25±1)℃,相对湿度(65±5)%,光周期16L/8D;24、48、72 h后检查死亡率,计算48 h时的LC10和LC30值及置信区间.用毛笔轻触螨体,若能活动都视作存活,反之记作死亡.
1.4 酶活性测定
用LC10和LC30的甲氧香螨酯和对照(27.5%丙酮水)处理含有大量截形叶螨成螨的菜豆叶5 s后计时,期间未转移叶螨,仍用带药叶片,待2、4、6、12、24、36、48、60、72 h后,每个处理分别挑取200头存活雌成螨至1.5 mL离心管,3次生物学重复,挑完后用液氮处理存至-80 ℃备用.谷胱甘肽-S-转移酶测定参照试剂盒(货号:BC0355),粗酶液提取:按照组织质量(g):试剂一体积(mL)为1∶5~10的比例进行冰浴匀浆.8 000g,4 ℃离心10 min,取上清置冰上待测.空白管:取96孔板,加入20 μL试剂一,180 μL试剂二和20 μL试剂三,迅速混匀后于340 nm测定吸光度变化,记录10 s和310 s吸光度为A1和A2.测定管:取96孔板,加入20 μL上清液,180 μL试剂二和20 μL试剂三,迅速混匀后于340 nm测定吸光度变化,记录10 s和310 s吸光度为A3和A4.酶活性按样本质量计算活性:
GST(U/g)=[(A4-A3)-(A2-A1)]÷ε÷d×106×V反总÷(W×V样÷V样总)÷T=0.46×[(A4-A3)-(A2-A1)]÷W
羧酸酯酶测定参照试剂盒(货号:BC0845),粗酶液提取:按照组织质量(g):试剂一体积 (mL)为 1∶5~10的比例进行冰浴匀浆,然后12 000g,4 ℃离心 30 min,取上清,置冰上待测.试剂二置于37 ℃水浴中预热30 min以上.空白管:取96孔板依次加入5 μL蒸馏水和200 μL试剂二,迅速混匀后于 450 nm处测定3 min内的吸光值变化,第10秒吸光值记为A1,第190秒的吸光值记为A2.ΔA空白管=A2-A1.测定管:取96孔板依次加入5 μL上清液和200 μL试剂二,迅速混匀后于450 nm处测定3 min内的吸光值变化,第10秒吸光值记为A3,第190秒的吸光值记为A4.ΔA测定管=A4-A3.酶活性按样本鲜质量计算CarE活性:
CarE酶活(U/g鲜质量)=(ΔA测定管-ΔA空白管)×V反总×(V样总÷V样)÷W÷T=13.67×(ΔA测定管-ΔA空白管)÷W
多功能氧化酶测定参照试剂盒,粗酶液提取:用预冷的 PBS (0.01 mol/L,pH=7.4)冲洗组织,称质量后将组织剪碎.将剪碎的组织与对应体积的PBS(一般按1∶9的体积比)加入玻璃匀浆器中,于冰上充分研磨.为了进一步裂解组织细胞,可以对匀浆液进行超声破碎,或反复冻融.最后将匀浆液于5 000×g离心5~10 min,取上清检测.从室温平衡 20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4 ℃;设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;样本孔中加入待测样本50 μL;空白孔不加;除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃水浴锅或恒温箱温育60 min;弃去液体,吸水纸上拍干,每孔加满洗涤液(350 μL),静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次(也可用洗板机洗板);每孔加入底物A、B各50 μL,37 ℃避光孵育15 min;每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值.以标准品浓度对应OD值绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值,酶单位U/L.
1.5 数据统计与分析
数据统计使用Excel 2016和SPSS 24.0,差异性检验使用Duncan氏新复极差法.
2 结果与分析
2.1 甲氧香螨酯亚致死浓度的测定
如表1所示,甲氧香螨酯对截形叶螨的亚致死浓度LC30和LC10分别为0.227、0.029 mg/L.
2.2 甲氧香螨酯亚致死浓度对截形叶螨GSTs的影响
从图1可以看出,LC30的甲氧香螨酯处理截形叶螨后,其体内GSTs活性在2 h就已经上升到31.57 U/g,显著高于LC10和对照组,48 h显著低于2 h酶活性,但仍高于LC10和显著高于对照组,在60 h达到最大值,72 h降至31.65 U/g仍高于LC10组和对照组;LC10组GSTs的活性在2~12 h间与对照组无明显差异,之后其GSTs活性逐渐升高,24~60 h显著高于对照组,至60 h达到最大,72 h降至21.99 U/g.其中除48 h外,均显著低于LC30组;说明LC10和LC30的甲氧香螨酯对截形叶螨体内的GSTs有诱导作用,LC10组在72 h降至对照组水平,LC30组对GSTs的诱导更持久.
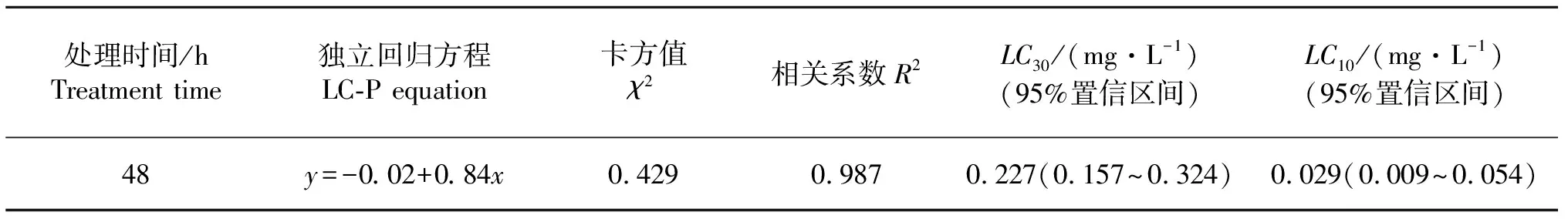
表1 甲氧香螨酯对截形叶螨的毒力测定
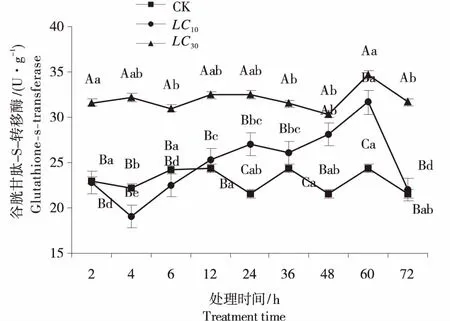
图中小写字母为同一处理下不同时间解毒活性差异显著性,大写字母为同一时间不同处理的解毒酶活性差异显著性(P<0.05).Lowercases indicated significantly difference in the same group (P<0.05),capital indicated significantly difference in the same time.(P<0.05).图1 甲氧香螨酯亚致死浓度对截形叶螨GSTs的影响Figure 1 Effect of sublethal concentration of scopoletin on GSTs activity of Tetranychus truncates
2.3 甲氧香螨酯亚致死浓度对截形叶螨CarEs的影响
从图2来看,LC30甲氧香螨酯处理截形叶螨后,其体内CarEs酶活性在2~6 h缓慢上升,6~12 h又降低,12~48 h再次迅速上升,至48 h达到最大值589.74 U/g,之后又降低;LC10组的CarEs在2 h时显著高于对照,之后上升又降低,至60 h达到最大,在2~72 h内均显著高于对照;说明LC10和LC30的甲氧香螨酯对CarEs有诱导作用,二者差异不显著但均显著高于对照.

图中小写字母为同一处理下不同时间解毒活性差异显著性,大写字母为同一时间不同处理的解毒酶活性差异显著性(P<0.05).Lowercases indicated significantly difference in the same group (P<0.05),capital indicated significantly difference in the same time.(P<0.05).图2 甲氧香螨酯亚致死浓度对截形叶螨CarEs的影响Figure 2 Effect of sublethal concentration of Scopoletin on CarEs activity of Tetranychus truncates
2.4 甲氧香螨酯亚致死浓度对截形叶螨MFOs的影响
由图3可知,LC30甲氧香螨酯处理截形叶螨后,其体内MFOs活性在2 h时显著高于对照而低于LC10组,之后降低,至24 h达到最低,36 h时达到最大值324.34 U/L,之后降低,但72 h仍显著高于对照;LC10组在2 h最大,显著高于LC30和对照组,在24 h时达到最大值,之后降低,但仍高于对照;说明LC10和LC30的甲氧香螨酯都能诱导MFOs活性,且浓度越低,诱导作用越明显;随着时间的推移,在4~12 h截形叶螨体内的甲氧香螨酯量增加,浓度越大,抑制作用越明显;随着截形叶螨体内的甲氧香螨酯被代谢,12 h后,LC10组MFOs活性便开始上升,而LC30在24 h对MFOs的抑制作用最强,36 h后,LC10和LC30的MFOs活性逐渐恢复至对照水平.

图中小写字母为同一处理下不同时间解毒活性差异显著性,大写字母为同一时间不同处理的解毒酶活性差异显著性(P<0.05).Lowercases indicated significantly difference in the same group (P<0.05),capital indicated significantly difference in the same time.(P<0.05).图3 甲氧香螨酯亚致死浓度对截形叶螨MFOs的影响Figure 3 Effect of sublethal concentration Scopoletin on MFOs activity of Tetranychus truncates
3 讨论
蜱螨与昆虫外源化合物(药物、杀螨剂、致癌物等)的代谢及抗药性的产生与体内解毒酶密切相关[11].昆虫的解毒酶系活性能被各种外源化合物诱导,这使昆虫在受到非常严重的化学环境压力作用下能迅速作出反应,从而存活下来[12],在对药剂亚致死效应研究中,解毒酶常被作为研究的重点[13].本研究中,LC30浓度的甲氧香螨酯处理截形叶螨后,GSTs酶活性在2~72 h内显著高于对照,除48 h外显著高于LC10处理;LC10的阿维菌素处理截形叶螨后,GSTs酶活性在24~60 h内显著高于对照,其他时间点与对照差异不明显,表明GSTs酶活性与处理甲氧香螨酯浓度和时间有关,浓度越大,酶活性越高,与谷清义[14]用LC10和LC20的阿维菌素处理土耳其斯坦叶螨24 h后的结论一致.LC10的阿维菌素处理截形叶螨后,处理时间越长,GSTs酶活性越高.尹显慧等[15]研究表明多杀菌素具有明显的诱导作用,亚致死浓度处理后比活力呈上升趋势,且具有一定的时间效应.但也有研究指出,亚致死浓度或者一定剂量的药剂处理并不能使GSTs酶活性显著升高或者无明显差异[13].
LC30浓度的甲氧香螨酯处理截形叶螨后,CarEs酶活性2~72 h内显著高于对照,在24~48 h内显著高于LC10处理,其他时间点差异不显著;LC10浓度的甲氧香螨酯处理截形叶螨后,CarEs酶活性在2~72 h内显著高于对照,表明CarEs酶活性与处理甲氧香螨酯浓度和时间有关,浓度越大,酶活性越高,与夏冰等[16]用阿维菌素亚致死剂量阿维菌素处理小菜蛾敏感品系的结果一致,LC30的甲氧香螨酯处理截形叶螨后,处理时间越长,CarEs酶活性越高.但也有研究指出,CarEs酶活性在用亚致死浓度的阿维菌素处理土耳其斯坦叶螨后显著降低,并且处理浓度越大,降低越明显[13].
LC30浓度的阿维菌素处理截形叶螨后,MFOs酶活性在2、36~48和72 h显著高于对照,在6、24 h显著低于对照,4、12、60 h与对照无明显差异,在2、6、24 h显著低于LC10处理,其他时间点与LC10处理无明显差异;LC10浓度的甲氧香螨酯处理截形叶螨后,MFOs酶活性在2、24、48、72 h显著高于对照,6 h显著低于对照,其他时间点与对照无明显差异,表明MFOs酶活性与处理浓度和时间有关,初期,截形叶螨体内摄入的甲氧香螨酯量有限,浓度越低诱导作用越明显,随着时间的增加,甲氧香螨酯的摄入量增加,MFOs酶活性表现为被抑制,且浓度越大,抑制作用越明显,截形叶螨体内的甲氧香螨酯被代谢至较低量时,MFOs酶活性表现为诱导,与谷清义[14]用亚致死剂量的阿维菌素处理土耳其斯坦叶螨后MFOs升高一致,但也有研究指出MFOs活性会被抑制[13].
亚致死浓度或者剂量的药剂对害虫,害螨的解毒酶系影响不尽相同.这可能与药剂种类、浓度或者剂量和供试害虫的品系有关[16-17].本研究中,LC10和LC30的甲氧香螨酯对GSTs和CarEs有显著的诱导作用,较低浓度的甲氧香螨酯可以诱导MFOs,而较高浓度的甲氧香螨酯对MFOs具有抑制作用,表明:GSTs、CarEs可能参与了甲氧香螨酯的代谢,MFOs的作用还需进一步研究.本试验仅以室内种群F0代为研究对象,对于田间种群或者用甲氧香螨酯处理后的F1代甚至更多代的影响还需进一步研究.
