CTA观察右半结肠缺血性结肠炎与肠系膜上动脉钙化斑块的关系
2019-03-22,*,,,,
, *, ,,,
(1.暨南大学附属广州市红十字会医院放射科,广东 广州 510220;2.广州市妇女儿童医疗中心放射科,广东 广州 510623)
缺血性结肠炎(ischemic colitis, IC)是结肠供血动脉急性中断或慢性下降所致不同程度结肠缺血或坏死性病变[1],多见于60岁以上老年人,早期临床表现不典型,进展快,误诊率高。高血压、高脂血症等引起的血管粥样硬化、斑块形成,导致管腔狭窄、血流量减低、结肠血供不足,是IC最常见病因。结肠主要由肠系膜上动脉(superior mesenteric artery, SMA)和肠系膜下动脉的结肠分支供血,动脉管壁钙化斑块是内脏器官缺血的重要危险因素[2],当SMA出现钙化斑块并发生狭窄时,其所供血的右半结肠可能因血供不足而发生不同程度的缺血或坏死。CTA采用多种后处理技术,可以明确显示SMA钙化斑块的数目、形态、部位和管腔狭窄程度[3]。本研究分析SMA钙化斑块的CTA特征,探讨右半结肠IC与SMA钙化斑块的关系,旨在为临床早期诊断IC提供客观依据。
1 资料与方法
1.1 一般资料 收集2012年1月—2017年12月于暨南大学附属广州市红十字会医院接受SMA CTA检查的605例患者,男190例,女415例,年龄54~91岁,平均(76.2±5.6)岁;首发症状均为腹痛,部分患者伴血便、腹泻等症状。其中81例经肠镜诊断为IC,且缺血部位累及升结肠、横结肠(IC组),病变仅累及升结肠43例、仅累及横结肠12例、累及升结肠及横结肠19例、累及全结肠7例,排除因腹主动脉、肠系膜动脉或肠系膜静脉血栓栓塞、单纯性狭窄、夹层、瘤样扩张,以及肠扭转、肠梗阻、结肠肿瘤、腹部血管手术后等因素所致结肠缺血;524例未诊断为IC(非IC组),其中165例接受肠镜检查,359例为临床综合诊断。
1.2 仪器与方法 采用Philips Brilliance 64 CT扫描仪,检查范围自膈肌至耻骨联合水平。CTA扫描管电压120 kV,管电流250 mA,采用螺旋扫描,螺距0.609。经右上肢静脉注射对比剂碘佛醇(370 mgI/ml),流率4 ml/s,剂量3 ml/kg体质量。采用智能追踪技术,于腹主动脉近双肾动脉开口处设置ROI,阈值150 HU,达到阈值后延迟5 s触发扫描。
1.3 图像分析 采用Philips Extended BrillianceTMWorkspace工作站,以VR、MIP、血管探针(vessel probe, VP)等技术重建图像。由2名副主任医师独立以盲法阅片,评价结果不同时经协商达成一致。评估SMA起始至回结肠动脉开口范围内最大钙化斑块情况,包括数目、形态、部位,评估SMA最窄处狭窄程度和开口处狭窄程度。钙化斑块诊断标准[4]:平扫血管壁CT值>130 HU,且体积>1 mm3。
钙化斑块形态分为:点状,钙化斑块长度≤5 mm且宽度≤3 mm(图1);条状,钙化斑块长度>5 mm或宽度>3 mm(图2);环状,轴位CT显示钙化斑块呈C型,钙化部分≥1/2圆周且多于1个层面(图3)[5]。
钙化斑块部位分为:SMA近段,距离SMA腹主动脉开口处≤1 cm;SMA中段,SMA腹主动脉开口1 cm以远至中结肠动脉开口处;SMA远段,中结肠动脉开口至右结肠动脉开口处;SMA末段,右结肠动脉开口至回结肠动脉开口处。
分别测量SMA最窄处和开口处的管腔直径并分级,计算狭窄程度:狭窄程度=(1-狭窄处管腔直径/正常管腔直径)×100%;将血管狭窄程度分为1~4级,分别为狭窄程度<25%、25%~49%、50%~75%、>75%[6]。
1.4 统计学分析 采用SPSS 13.0统计分析软件。符合正态分布的计量资料以±s表示,采用独立样本t检验比较IC组与非IC组;2组间计数资料的比较采用χ2检验。SMA最窄处和开口处狭窄程度2组间比较采用Mann-WhitneyU检验。绘制ROC曲线,评价狭窄程度诊断IC的效能。P<0.05为差异有统计学意义。
2 结果
IC组与非IC组患者年龄、性别及基础疾病差异均无统计学意义(P均>0.05,表1)。
2.1 钙化斑块特点 IC组检出SMA钙化斑块13例(13/81,16.05%;图4),非IC组检出钙化斑块33例(33/524,6.30%),2组间钙化斑块的发生率差异有统计学意义(χ2=9.496,P=0.002)。IC组患者钙化斑块数目多于非IC组(P=0.043)。2组间钙化斑块部位比较差异有统计学意义(P<0.001),IC组中,SMA钙化斑块多位于远段,非IC组多位于近段或中段。2组间钙化斑块形态差异无统计学意义(P=0.421)。见表2。
2.2 血管狭窄程度 IC组与非IC组SMA开口处狭窄程度差异无统计学意义(Z=1.306,P=0.191),SMA最窄处狭窄程度比较差异有统计学意义(Z=4.354,P<0.001),见表3。ROC曲线结果显示,SMA最窄处狭窄程度诊断IC的AUC为0.838(P<0.001,图5),临界值为2级(狭窄程度25%~49%),其诊断IC的敏感度为76.92%(10/13),特异度为87.88%(29/33),准确率84.78%(39/46),阳性预测值71.43%(10/14),阴性预测值90.62%(29/32)。
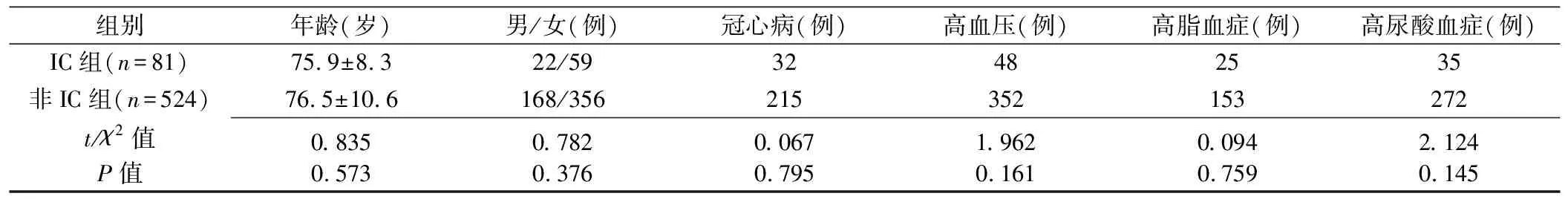
表1 IC组与非IC组患者一般资料及基础疾病比较
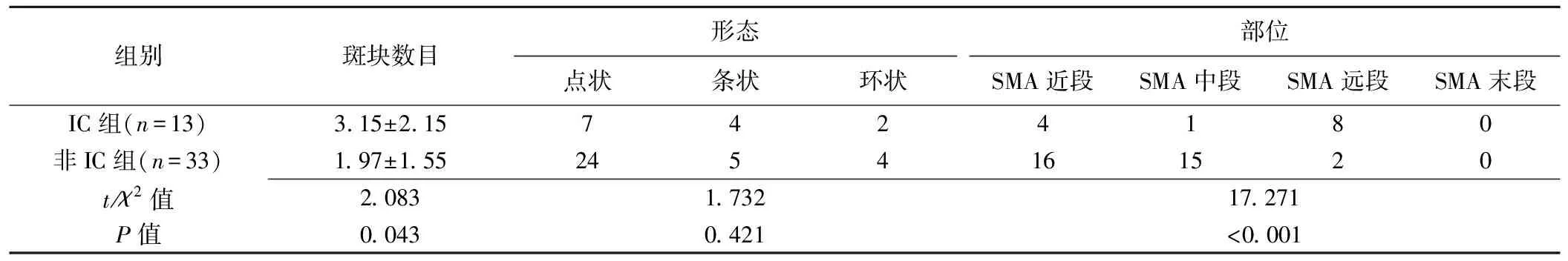
表2 IC组与非IC组SMA钙化斑块特征比较(个)
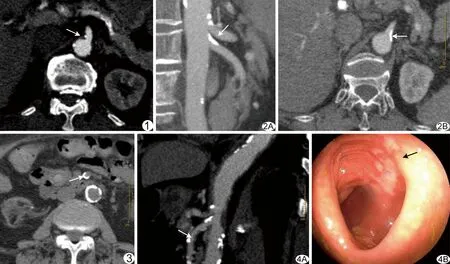
图1 CT示SMA近段点状钙化斑块(箭),狭窄程度<25% 图2 CT示SMA近段条状钙化斑块(箭),狭窄程度为25%~49% A.矢状位; B.轴位 图3 CT示SMA中段环状钙化斑块(箭),狭窄程度为25%~49% 图4 患者女,71岁,上腹部疼痛1天,IC A.矢状位CT示SMA多发钙化斑块,最大斑块位于SMA远段(箭),为点状钙化,管腔狭窄程度为50%~75%; B.内镜示结肠黏膜肿胀,多处长条或片状充血糜烂(箭)

组别开口处狭窄程度1级2级3级4级最窄处狭窄程度1级2级3级4级IC组(n=13)92113424非IC组(n=33)2841029220
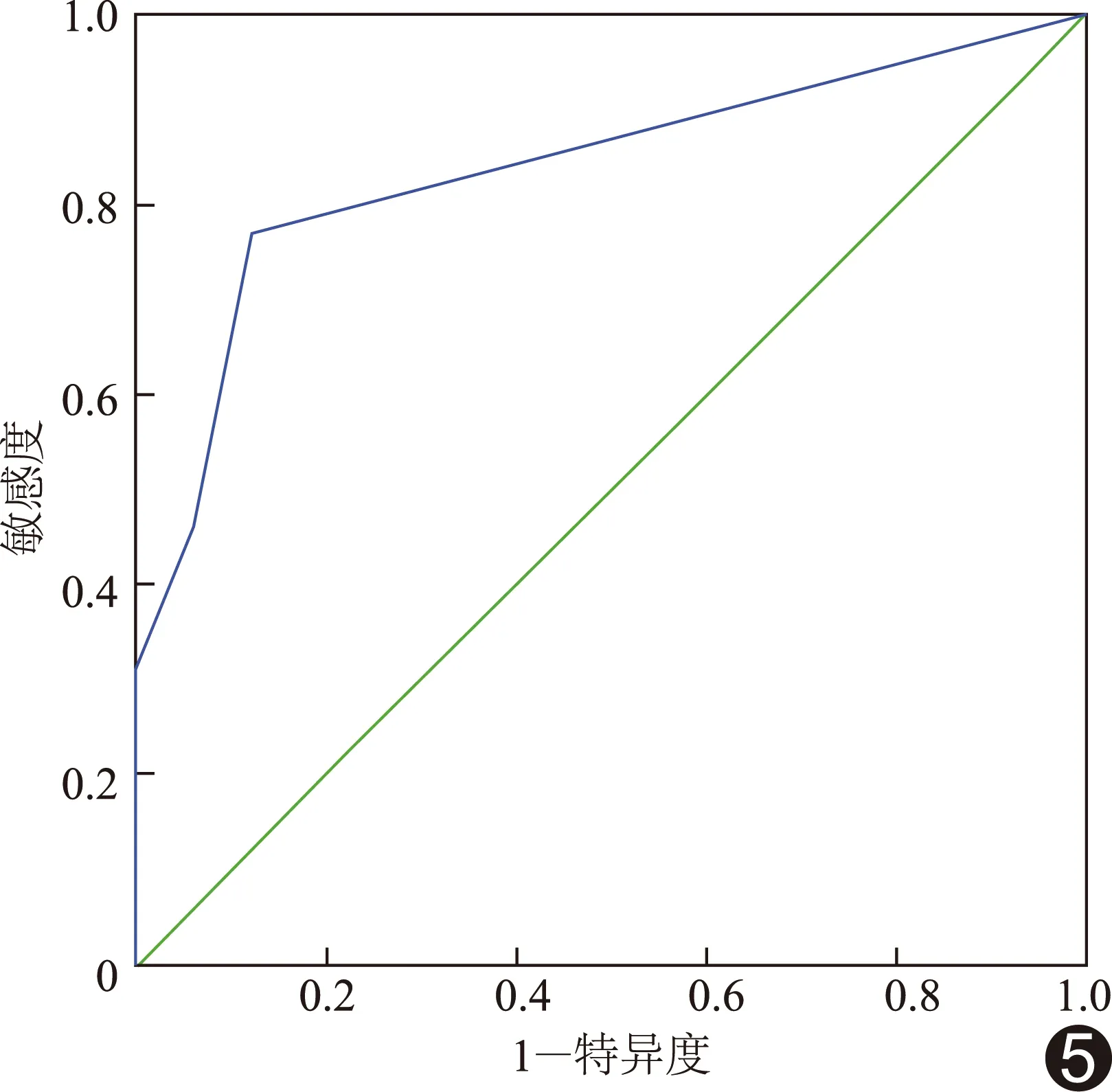
图5 SMA最窄处狭窄程度诊断IC的ROC曲线
3 讨论
IC是缺血性肠病最常见的类型,对于结肠坏死患者需进行急诊手术治疗[7],因此早期准确诊断IC具有临床重要意义。结肠镜和影像学检查是IC的主要检查方法。CT是诊断IC的最有效影像学方法之一,IC表现为结肠肠壁均匀性、节段性增厚,可见晕征、拇纹征,周围脂肪间隙模糊。CT可排除导致急性腹痛的其他原因,确定结肠缺血的部位及程度。此外,借助VP、VR、MIP等后处理技术,CT还可清晰显示肠系膜动脉主干及其二级分支情况,排除肠系膜动脉夹层、肠系膜血管血栓栓塞等原因引起的急性肠系膜缺血。SMA动脉粥样硬化导致管腔狭窄,血流减少,可能引起相应供血区域结肠的缺血或坏死,从而导致IC。
升结肠和横结肠右半节段由SMA供血,横结肠左半节段、降结肠和乙状结肠由肠系膜下动脉供血。钙化斑块是动脉粥样硬化进展的标志之一[8],冠状动脉钙化程度可直接预测心血管事件[9],肠系膜血管粥样硬化是IC远期死亡的独立预测因素[10]。因此,评估SMA钙化斑块对早期诊断IC具有重要意义。
本研究显示IC组SMA钙化斑块的发生率高于非IC组,差异有统计学意义(χ2=9.496,P=0.002),与邹循锋等[11]研究结果一致。IC组的SMA钙化斑块多分布在远段,非IC组多分布在近、中段,可能是由于SMA从开口处至远段逐渐变窄,远段出现斑块时更易阻塞管腔,使肠道血供减少;当肠壁供血动脉血压低于40 mmHg时,易发生结肠缺血[12]。
Menke[13]对多排螺旋CT诊断有症状的原发性急性肠系膜栓塞的效能进行Meta分析,结果显示其具有较高的敏感度和特异度,分别为93.3%和95.9%。本研究结果显示IC组SMA最窄处狭窄程度高于非IC组,差异有统计学意义(Z=4.354,P<0.001);ROC曲线结果显示SMA最窄处狭窄程度可作为诊断IC的依据,其诊断IC的AUC为0.838(P<0.001),敏感度为76.92%(10/13),特异度为87.88%(29/33),具有一定诊断价值。因此,笔者认为对疑似IC患者,如CTA检出SMA钙化斑块,且其最窄处狭窄程度≥25%,提示发生IC可能性大。
本研究的局限性:①存在钙化斑块的样本量较小;②部分患者根据临床及治疗反应诊断为非IC,缺乏内镜证实;③对腹主动脉、肠系膜下动脉钙化斑块、累及多条血管的钙化斑块与IC的关系还需进一步研究。
综上所述,右半结肠IC与SMA钙化斑块的数目、部位、最窄处狭窄程度均有关,当钙化斑块发生于SMA远段,且其最窄处狭窄程度≥25%时,提示IC可能性较大。CTA对辅助临床早期诊断IC有重要价值。
