聚乙烯亚胺负载四氧化三铁对刚果红的吸附性能
2019-03-22韩润平房丽燕李小钰韩旻媛
韩润平,房丽燕,李小钰,韩旻媛,张 征
(郑州大学 化学与分子工程学院,河南 郑州450001)
0 引言
染料在纺织、造纸、橡胶、化妆品、食品等领域广泛使用,通过“跑冒滴漏”等无组织排放进入水体,严重威胁生态环境和人类健康.染料废水具有难降解、色度高、品种多、水质变化大等特点,不易处理.为有效控制染料废水,国内外已研究许多种方法和水处理技术,吸附法为处理染料废水的优良方法之一[1-2].吸附剂主要有活性炭[3]、天然矿物[4]、生物质材料[5]、微生物吸附剂[6]等.研究表明,磁性吸附剂具有制备简单、分离快速、易回收和再生循环利用、吸附性能好、毒性低的优势,是一种绿色环保吸附剂[7].磁性 Fe3O4吸附剂被广泛应用于水污染控制领域.聚乙烯亚胺(polyethyleneimine,PEI)是一种典型水溶性聚胺,在高分子染料[8]、造 纸[9]、催 化[10]、絮 凝 剂[11]、纤 维 改性[12]、基因传递[13]、生物医学[14]等领域有广泛的应用,具有生物相容性,使用过程中不会对环境造成二次污染.PEI在水溶液中以游离分子态形式存在,直接作为吸附剂不易分离回收、易流失,制约了PEI作为吸附剂在实际中的应用.因此需要将PEI固载在基质材料上,或进行接枝和交联改性形成更适应环境污染治理的形貌和材质.Fe3O4粒径小、比表面积大、超顺磁性,很容易发生团聚或氧化,影响吸附剂的吸附性能,PEI@Fe3O4磁性复合材料不仅增强了Fe3O4在水溶液中的分散性和稳定性,同时克服PEI易流失的缺点,表面修饰基团的引入进一步增强了吸附性能.因此通过物理或化学方法对其进行表面功能化修饰十分必要.刚果红是一种典型的联苯胺类直接偶氮阴离子型染料,厌氧条件下它会生成毒性更大的芳香胺类物质.基于PEI功能化磁性纳米复合材料同时具有磁分离特性和PEI对污染物吸附性能优异的特点,笔者通过戊二醛化学交联反应制备PEI功能化磁性吸附剂(PEI@Fe3O4),以刚果红染料为目标吸附物,研究初始pH值、吸附时间、染料初始浓度等因素对刚果红在PEI@Fe3O4上吸附性能的影响,进一步探讨PEI@Fe3O4对刚果红的吸附去除机制.
1 材料与方法
1.1 实验材料和仪器
PEI(分子量约为1 800 g/mol),CR[二苯基-4,4'-二(偶氮 2)1-氨基萘-4-磺酸钠,分子式为C32H22N6Na2O6S2,分子量为 696.68],盐酸、氯化铁、氢氧化钠、硫酸亚铁、戊二醛等均为分析纯.
752型紫外分光光度计;SHZ-82型恒温气浴振荡器;DHG-9 055 A型鼓风干燥箱;90-1型恒温磁力搅拌器;Su8020扫描电镜(SEM);S4 PIONEER X射线荧光光谱仪.
1.2 吸附剂制备
1.2.1 共沉淀法制备四氧化三铁
称取一定量 FeCl3·6H2O和 FeSO4·7H2O于1 L烧杯中,室温,在转速850 rad/min磁力搅拌下溶于0.5 mol/L HCl,然后逐滴滴加 1.25 mol/L NaOH溶液300 mL,生成黑色Fe3O4沉淀,继续搅拌0.5 h,混合液的pH用25%HCl调节至中性,反应结束后利用磁铁通过外加磁场收集烧杯中的固体材料,用蒸馏水将所得固体材料洗涤数次,置于60℃鼓风干燥箱内烘干备用.
1.2.2 制备磁性复合材料PEI@Fe3O4
单因素实验确定最佳反应条件:配置5 g/L PEI溶液300 mL,然后等质量比例加入 Fe3O4,恒温水浴30℃磁力搅拌6 h,静置1 h磁铁分离后,于60℃鼓风干燥箱内烘干.然后加入300 mL质量百分数0.05%的戊二醛溶液,恒温水浴30℃磁力搅拌2 h,磁铁分离,用蒸馏水将所得固体材料洗涤数次,于60℃鼓风干燥箱内烘干.
1.3 实验方法
采用静态法进行实验,将0.010 g吸附剂放入10 mL锥形瓶中,加入一定质量浓度的刚果红溶液10 mL,在恒温振荡器进行吸附.一定时间后(按分计)取上清液用分光光度法测定刚果红的质量浓度,计算单位质量的吸附剂对刚果红的吸附量.吸附温度分别控制在293、303和313 K.
1.4 刚果红测定
采用可见分光光度法,在 pH为6.7左右,473 nm处测量吸光度,根据吸光度与CR的质量浓度在一定范围内呈线性关系进行测定.
2 结果和讨论
2.1 复合磁性材料的表征
2.1.1 扫描电镜
图1为Fe3O4和 PEI@Fe3O4的SEM图.由图1看出,磁性材料处于纳米范围,负载PEI后粒径变化不大,材料表面较为粗糙,适合作吸附剂.
2.1.2 元素分析
对两种材料进行基本元素分析,Fe3O4中C为0.075%、H为0.34%、N为0.012%,说明制备过程或保存过程中Fe3O4表面吸附或夹有少量有机杂质;PEI@Fe3O4中C为3.95%、H为0.88%、N为1.22%.PEI@Fe3O4中 N、H、C 3种元素含量明显提高,说明PEI负载到磁性材料Fe3O4.

图1 扫描电镜图Fig.1 SEM image
2.1.3 PEI@Fe3O4XRD分析
图2为XRD图谱.对比标准图谱,相应的衍射峰为Fe3O4的峰,PEI负载到表面对Fe3O4的晶格结构没有影响.
2.2 吸附性能
2.2.1 pH值对刚果红吸附的影响
酸度改变吸附剂表面的官能团,也影响到吸附质的存在状态.不同溶液pH的影响如图3所示.pH在2~12时,随 pH升高,吸附量不断降低,当pH为2时,单位吸附量达到最大.
pH为2~7内,pH<pHpzc(6.9)时,PEI分子由于氨基质子化而显正电.同时水中刚果红分子磺酸基团(—SO3Na)会水解为带负电荷的离子,CR分子中—SO3-(pKa<0)即使强酸环境仍然能以—SO3-的形式稳定存在.在酸性条件下,CR分子中—SO3-与质子化 PEI分子之间的静电吸引是主要吸附机理.随 pH值升高,吸附剂表面PEI分子质子化程度减弱,同时溶液中出现大量 OH-与 CR发生竞争吸附,导致吸附性能降低.后续实验中CR水溶液不调节pH(溶液pH=6.7).

图2 PEI@Fe3O4XRD图谱Fig.2 XRD of PEI@Fe3O4
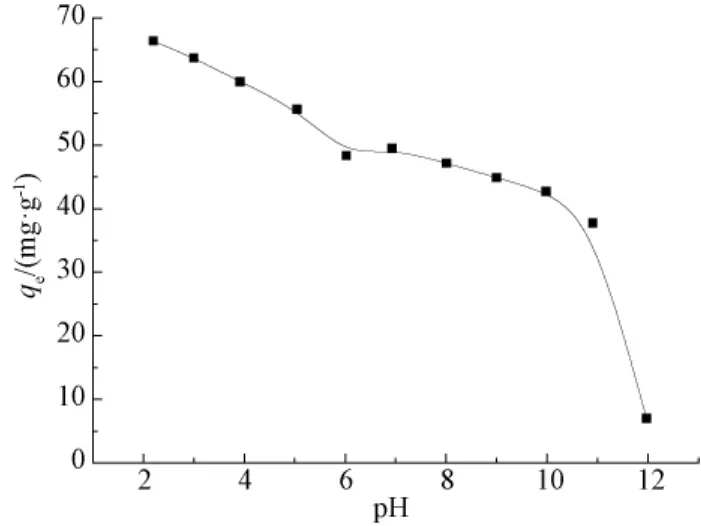
图3 pH值对刚果红吸附的影响Fig.3 Effect of initial pH on CR adsorption
2.2.2 盐浓度对刚果红吸附的影响
染料废水中存在着无机盐,探讨盐度对吸附量的影响很有必要.图4为不同盐浓度对CR吸附量的影响.

图4 盐浓度对刚果红吸附的影响(T=303 K,C0=100 mg/L)Fig.4 Effect of salt concentration on CR adsorption
由图4看出,盐的存在有利于CR的吸附,盐浓度增加,吸附量变大,然后趋于稳定.原因可能是盐度升高引起溶液中CR染料分子的二聚反应,盐离子迫使CR分子聚集并增强其吸附到PEI@Fe3O4的程度.另一原因可能是加入无机盐会降低双电层厚度,溶液中的电解质减小了染料和PEI@Fe3O4表面官能团之间的排斥力,减小 CR分子扩散到 PEI@Fe3O4吸附剂表面的阻力.
由图4还可看出,NaCl的影响大于Na2SO4.原因是无机盐的加入使溶液离子强度增加,活度系数减小,CR和吸附剂表面活性位点的活度下降.在相同浓度下,Na2SO4溶液的离子强度大于NaCl溶液的离子强度,因此导致CR与活性位点间的作用力下降.
2.2.3 刚果红的吸附等温线
在刚果红初始质量浓度为10~120 mg/L的吸附液中(pH为6.67),加入0.01 g吸附剂,分别在293、303和313 K条件下吸附10 h,吸附等温线如图5所示.

图5 PEI@Fe3O4对CR的吸附等温线Fig.5 Adsorption isotherms of CR
从图5得出,随刚果红浓度增加,吸附量变大;当浓度超过20 mg/L时,刚果红单位吸附量增幅减缓.温度从293 K升至313 K,吸附剂对刚果红单位吸附量增大.在303 K时,实验得到的最大吸附量为58.3 mg/g.
等温吸附模型常用于拟合所得等温线.选择Langmuir、Freundlich、Redlich-peterson 和 Temkin方程,其表达式如下.
Langmuir吸附等温式为[15]

Temkin吸附等温式为

Redlich-peterson吸附等温式为:
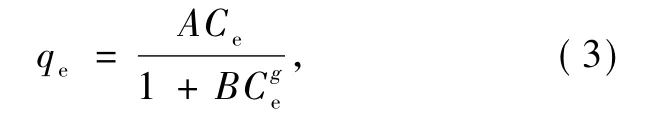
式中:qe为平衡吸附量;KL为Langmuir常数;KF和1/n为Freundlich方程常数;A、B与g为 Redlichpeterson参数;Ce为吸附平衡后CR的浓度.
采用非线性回归分析,以差方和最小得到相应模型的参数和可决系数R2和差方和SSE,结果列于表1.对于Langmuir模型,单位吸附量qm在293、303、313 K 3个温度随温度升高单位吸附量增大,说明PEI@Fe3O4吸附CR是一个吸热过程.

表1 PEI改性磁性四氧化三铁对水中刚果红等温吸附模型参数Tab.1 Isotherm parameters for Congo red adsorption onto surfactant-modified magnetite Fe3O4composite
对于Temkin模型,R2在0.970以上,但SSE值较大.说明不适合描述PEI@Fe3O4对刚果红的吸附过程.比较相关系数R2和SSE,在不同温度下,Redlich-peterson方程模型拟合效果好,Redlich-peterson方程是 Langmuir和 Freundlich的结合,0<g<1且接近 1,说明接近 Langmuir方程.吸附为不均匀表面单分子层吸附.
2.2.4 接触时间的影响及吸附动力学研究
在303 K时,不同质量浓度刚果红接触时间对吸附的影响如图6所示.PEI@Fe3O4对刚果红的吸附过程分为3个阶段:初期是快速过程;40 min以后,吸附速率明显减慢,进入中速过程;160 min后进入慢速阶段,吸附10 h后基本达到平衡.刚果红达到吸附平衡所需时间在很大程度上与初始质量浓度有关,质量浓度为40、60和90 mg/L的刚果红溶液,分别在100、300和400 min后刚果红吸附量增加缓慢,基本达到动态平衡.采用 Pseudo-second-order equation、Double Constant equation、Elovich equation、Particle diffusion reaction方程非线性拟合.
Pseudo-second-order方程:

Elovich方程:

Double constant方程:

Intra-particle diffusion方程:
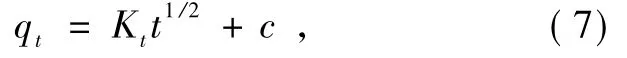
式中:k2为速率常数,g/(mg·min);α为初始吸附速率常数,g/(mg·min);β为吸附常数,g/mg;A和ks为模型参数;Kt为扩散速率常数,mg/(g·min);c为边界层厚度有关的常数,mg/g.
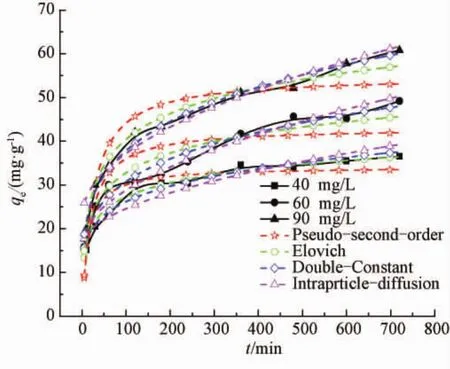
图6 不同刚果红质量浓度下接触时间对吸附非线性拟合Fig.6 Effect of contact time on congo red adsorption at various initial concentrations
拟合结果见表2,拟合曲线如图6所示.
由表2可知,3种不同初始质量浓度刚果红溶液,双常数和Elovich动力学模型的相关系数均大于0.942且SSE小.Pseudo-second-order equation和 Particle diffusion reaction得到的R2较小,SSE较大,说明两方程不能有效地预测动力学过程.依据R2和SSE值,Double Constant equation和Elovich方程可以更好地预测时间对吸附的影响.Elovich方程最好,说明吸附是非均相吸附.
2.2.5 PEI@Fe3O4对CR吸附热力学分析
吸附热力学主要是对吸附作用模式与平衡吸附数学模型的研究,依据平衡试验可以求得不同温度时的分配系数.PEI@Fe3O4吸附水中刚果红吉布斯自由能变(ΔG0)、焓变(ΔH0)和熵变(ΔS0)等热力学参数通过以下公式加以计算:

式中:Kd(=qe/Ce)为吸附平衡系数,mL/g;T为反应温度,K;R为理想气体常数,8.314(J·mol-1·K-1).

表2 PEI@Fe3O4对CR的吸附动力学曲线非线性模型拟合结果(T=303 K)Tab.2 Parameters of kinetic models at various conditions
根据公式(8)、公式(9),分别计算不同温度下ΔG0,用 ΔG0对T作图,通过直线的斜率和截距可以计算出 ΔHo与 ΔSo.PEI@Fe3O4吸附水中刚果红热力学参数值如表3所示.

表3 PEI@Fe3O4对CR吸附热力学参数Tab.3 Thermodynamic parameters for CR adsorption onto PEI@Fe3O4
计算不同温度条件吉布斯自由能变均为负值,说明PEI@Fe3O4对水中刚果红吸附属于自发过程.焓变 ΔH为正值,说明 PEI@Fe3O4吸附水中刚果红是吸热反应.吸附剂对刚果红吸附容量随着温度升高而增大,与实验结果相符.熵变ΔS为正值,表明吸附过程总熵增加,说明 PEI@Fe3O4吸附刚果红后增加了固-液界面上无序程度.
2.2.6 解吸再生研究
PEI@Fe3O4对 CR吸附达到平衡(303 K,C0=100 mg/L,t=600 min),计算吸附量.然后用不同方法进行解吸,对解吸后的吸附剂进行再次吸附研究,计算解吸率和再生吸附剂的吸附量.
结合CR的PEI@Fe3O4进行再生及重复使用性研究,再生结果如图7所示.用水、乙醇等解吸率低,说明CR与吸附剂作用力大,但有较好的一次再生率,说明在该浓度下吸附剂表面的活性点位未被占满,仍有一定的吸附量.采用0.1 mol/L的NaOH溶液可实现CR有效解吸附.对吸附饱和后磁性材料PEI@Fe3O4连续3次吸附/解吸附循环操作后,吸附量分别为初始的74.5%、58.7%、55.8%,表明PEI@Fe3O4对CR吸附性能有所下降,但仍有较大的吸附量,说明 PEI@Fe3O4作为吸附剂具有良好稳定性、再生性和重复利用性,PEI@Fe3O4有望用于废水中 CR的吸附去除.
2.2.7 刚果红吸附机理探讨
由于在CR分子结构中存在—SO3-和—NH2基团,当pH降低时,吸附剂表面 PEI及CR分子上的—NH2都被质子化为—NH3+,两者间的静电引力减弱,导致吸附量减小.综上,本实验无机盐离子共存利于CR染料吸附,盐度影响的结果表明PEI@Fe3O4吸附CR主要机理不是静电作用力.如图8所示.在适宜pH条件下,部分CR分子絮凝在吸附剂表面,说明吸附的同时发生一定的絮凝作用,吸附过程可能包含一定的吸附架桥作用,刚果红分子之间形成分子间作用力.

图7 不同解吸剂的解吸效率和再生性能比较Fig.7 Efficiency of desorption and regeneration about spent adsorbents by various agents

图8 PEI@Fe3O4和CR的吸附机理图Fig.8 Mechanism of CR adsorption
3 结论
研究结果表明,PEI@Fe3O4对水中阴离子染料刚果红具有好的去除效果.pH为6.67和反应温度为303 K条件PEI@Fe3O4对刚果红的吸附量为58.3 mg/g,且随温度升高吸附量增大.吸附等温线符合Redlich-Peterson方程,吸附动力学符合Elovich动力学模型和双常数模型,随CR溶液浓度增大,温度升高及盐浓度增加,吸附量增大.PEI@Fe3O4对水中刚果红吸附属于自发和吸热过程,作用机制可能包括静电吸引、氢键和分子间作用力等.吸附刚果红后吸附剂可以很容易地通过外加磁场的作用快速地从水溶液中分离出来.
