阻断STAT3信号通路对恶性淋巴瘤细胞凋亡的影响
2019-03-20姚金晓杨如玉马海龙李超魏旭东
姚金晓,杨如玉#,马海龙,李超,魏旭东
1南阳市中心医院血液内科,河南 南阳 473000
2郑州大学附属肿瘤医院血液科,郑州 4500080
恶性淋巴瘤主要表现为淋巴结肿大,是一种起源于淋巴造血系统的常见恶性肿瘤,由于淋巴系统分布较广,淋巴瘤几乎可以作为一种全身性疾病危害全身的组织和器官[1]。放射治疗、化学药物治疗、造血干细胞治疗、手术治疗是目前常用的治疗淋巴瘤的手段,但这些传统的治疗手段仍然不能满足需求,因此,研究淋巴瘤的发病机制,寻找治疗淋巴瘤的有效手段十分重要[2]。信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)是STAT家族的成员之一,能够调控细胞的分化、增殖、凋亡等过程,是细胞因子/生长因子信号通路传递过程中的重要转录因子[3-4]。STAT3不仅在细胞正常的生长过程中具有调控作用,还参与糖尿病、肿瘤等疾病的发生过程[5-6]。本研究主要以恶性淋巴瘤细胞为研究对象,通过用JSI-124阻断STAT3信号通路,探讨STAT3信号通路在恶性淋巴瘤细胞凋亡中的作用。
1 材料与方法
1.1 材料
恶性淋巴瘤细胞株Raji购自中国科学院细胞库,JSI-124购自美国Sigma公司,细胞蛋白提取试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒均购自天根生化科技(北京)有限公司,膜联蛋白V-异硫氰酸荧光素(Annexin V-fluorescein isothiocyanate,Annexin V-FITC)/碘化丙啶(propidium iodide,PI)细胞凋亡检测试剂盒购自美国Thermo公司,细胞周期蛋白D1(cyclin D1)多克隆抗体、STAT3多克隆抗体、磷酸化的STAT3(p-STAT3)多克隆抗体、活化的半胱氨酸天冬氨酸蛋白水解酶3(cleaved cysteine aspartic acid protease 3,cleaved caspase 3)多克隆抗体均购自美国Abcam公司。
1.2 细胞培养
用含有2 mmol/L的左旋谷酰胺、10%胎牛血清、100 μg/ml青霉素、100 U/L链霉素的RPMI1640培养液培养恶性淋巴瘤细胞Raji。培养3天后,1000 r/min离心10 min,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次使细胞沉淀,用新鲜细胞培养液悬浮后,接种到培养瓶中继续培养。
1.3 噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)法检测细胞增殖
取培养至对数生长期的Raji细胞种植到96孔细胞培养板中,每孔5000个细胞。在培养液中加入 JSI-124,使其终浓度分别为:0、200、400、800、1600 nmol/L,每个浓度梯度设置6个复孔,培养48 h后,每孔加入 10 μl的MTT,孵育 4 h。弃上清,加入150 μl的二甲基亚砜溶液,测定490 nm处各组的吸光度(absorbance,A)值,计算细胞存活率。细胞存活率=(JSI-124作用组A 值÷0 nmol/L JSI-124作用组A值)×100%,采用Compusyn软件计算半数抑制浓度。实验重复3次,取均值。
1.4 流式细胞仪检测细胞凋亡
取0、600 nmol/L的JSI-124作用48 h后的Raji细胞,用冰预冷的PBS洗涤2次后,将细胞浓度调整为1×106/ml,加入结合缓冲液悬浮细胞后,依次加入 5 μl的 Annexin V-FITC和 PI。采用流式细胞仪检测细胞凋亡水平,分析凋亡率。实验重复3次,取均值。
1.5 流式细胞仪检测细胞周期
取0、600 nmol/L的JSI-124作用48 h后的Raji细胞,离心,收集细胞沉淀,用-20℃预冷的70%乙醇固定,加入PI,避光染色30 min。采用流式细胞仪分析细胞周期。实验重复3次,取均值。
1.6 Western blot法检测cyclin D1、STAT3、p-STAT3、cleaved caspase 3蛋白表达
取0、600 nmol/L的JSI-124作用48 h后的Raji细胞,提取细胞蛋白,BCA法检测蛋白浓度。取蛋白样品与等体积的上样缓冲液混合,100℃煮沸5 min。移液枪吸取50 μl的变性样品至加样孔中,用12%分离胶(120 V电压)、5%浓缩胶(90 V电压)电泳。4℃转膜60 min,400 mA转膜电流。用封闭液(5%牛血清白蛋白)室温孵育1 h后,与一抗(1∶1000稀释,4℃过夜)和二抗(1∶2000稀释,室温1.5 h)孵育后,显色,AlphaImager成像分析,目的蛋白相对表达水平=目的蛋白光密度值÷GAPDH光密度值。实验重复3次,取均值。
1.7 统计学分析
采用SPSS 22.0统计-软件进行数据分析,计量资料以均数±标准差(±s)表示,两组比较采用两独立样本t检验,多组比较采用单因素方差分析,多组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖情况的比较
随着JSI-124作用浓度的升高,细胞存活率逐渐下降(表1)。计算其半数抑制浓度为(615.62±52.98)nmol/L,故后续选用600 nm/L的 JSI-124作用于恶性淋巴瘤细胞。
表1 不同浓度JSI-124作用后细胞存活率的比较(%,±s)
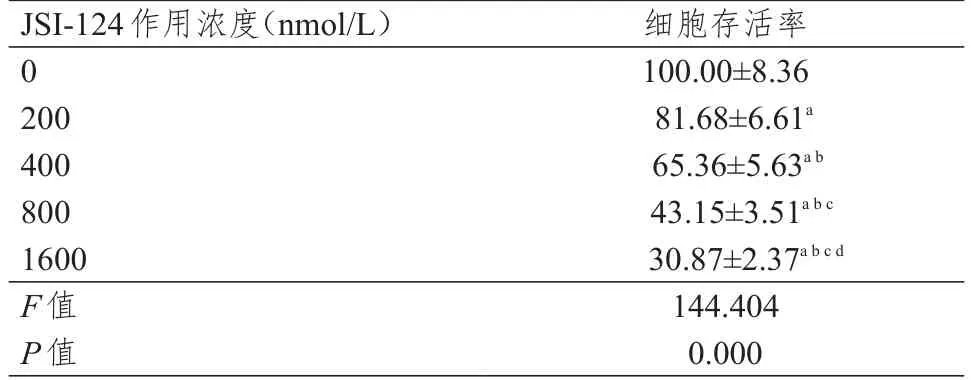
表1 不同浓度JSI-124作用后细胞存活率的比较(%,±s)
注:a与0 nmol/L作用组比较,P<0.05;b与200 nmol/L作用组比较,P<0.05;c与400 nmol/L作用组比较,P<0.05;d与800 nmol/L作用组比较,P<0.05
JSI-124作用浓度(nmol/L)0 200 400 800 1600 F值P值细胞存活率100.00±8.36 81.68±6.61a 65.36±5.63a b 43.15±3.51a b c 30.87±2.37a b c d 144.404 0.000
2.2 细胞凋亡情况的比较
0、600 nm/L的JSI-124作用后的细胞凋亡率分别为(9.51±1.19)%、(57.58±12.02)%。600 nm/L作用组细胞凋亡率明显高于0 nm/L作用组(t=9.748,P<0.01)。(图1)

图1 0、600 nm/L的JSI-124对细胞凋亡的影响
2.3 细胞周期情况的比较
600 nm/L作用组G0/G1期细胞所占比例明显低于0 nm/L作用组,G2/M期细胞所占比例明显高于0 nm/L作用组,差异均有统计学意义(P<0.01);两组S期细胞所占比例比较,差异无统计学意义(P>0.05)。(表 2)
表2 0、600 nm-/L的JSI-124作用后各分期细胞比例的比较(%,±s)
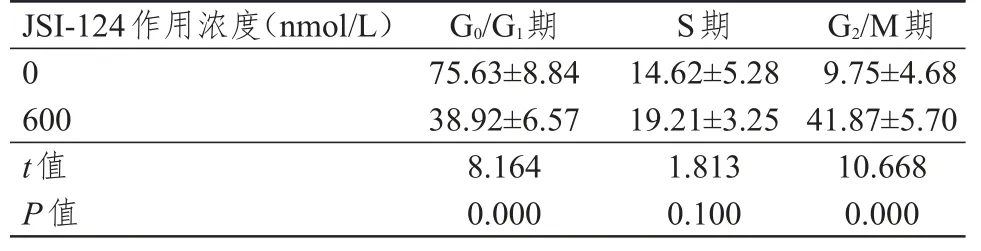
表2 0、600 nm-/L的JSI-124作用后各分期细胞比例的比较(%,±s)
J SI-1 2 4作用浓度(n m o l/L)0 6 0 0 t值P值G 0/G 1期7 5.6 3±8.8 4 3 8.9 2±6.5 7 8.1 6 4 0.0 0 0 S期1 4.6 2±5.2 8 1 9.2 1±3.2 5 1.8 1 3 0.1 0 0 G 2/M期9.7 5±4.6 8 4 1.8 7±5.7 0 1 0.6 6 8 0.0 0 0
2.4 cyclin D1、STAT3、p-STAT3、cleaved caspase 3蛋白相对表达水平的比较
600 nm/L作用组p-STAT3、cyclin D1蛋白相对表达水平明显低于0 nm/L作用组,cleaved caspase 3蛋白相对表达水平明显高于0 nm/L作用组,差异均有统计学意义(P<0.01)。(图2、表3)
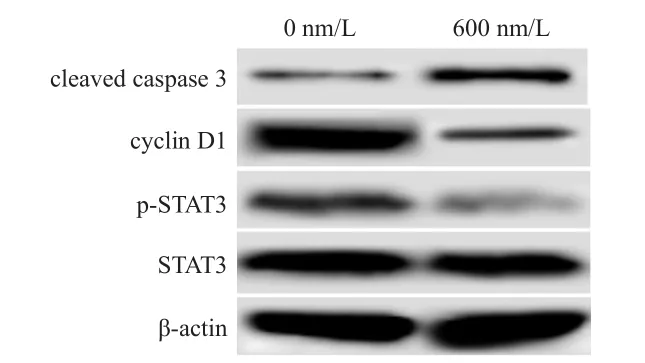
图2 0、600 nm/L的JSI-124作用后cyclin D1、STAT3、p-STAT3、cleaved caspase 3蛋白的表达情况
表3 0、600nm/L的JSI-124作用后cyclinD1、STAT3、p--STAT3、cleaved caspase 3蛋白相对表达水平的比较(±s)

表3 0、600nm/L的JSI-124作用后cyclinD1、STAT3、p--STAT3、cleaved caspase 3蛋白相对表达水平的比较(±s)
JSI-124作用浓度(nmol/L)p-STAT3STAT3cyclin D1cleavedcaspase 3
3 讨论
STAT3是研究较多的转录因子,其活跃性较高,在肿瘤中异常激活,与肿瘤细胞的生长、转移、分化、凋亡等有关[7]。STAT3蛋白具有多种功能,这是由于其含有多个功能结构区域,主要包括DNA结构域、保护性氨基端、SH2结构域和STAT二聚化羧基端[8-10]。有研究表明,STAT3异常活化后,会导致细胞的恶性增殖,减少细胞凋亡,促进肿瘤的发生[11]。JSI-124是一种三萜类化合物,能够特异性抑制STAT3信号通路的激活,且目前无论是体外还是体内的研究均未发现其毒性作用[12]。250~1000 nm/L的JSI-124作用后的胆囊癌细胞的增殖能力下降,凋亡率升高[13]。后续的研究报道称,JSI-124还能够抑制肝癌细胞生长,并且对白血病细胞的生长也具有抑制作用[14-15]。本研究采用Raji细胞作为研究对象,用不同浓度的JSI-124作用后,细胞的存活率呈浓度依赖性下降,细胞凋亡率明显增高,G0/G1期细胞减少,G2/M期细胞增多。JSI-124能够抑制恶性淋巴瘤细胞增殖,促进细胞凋亡,将细胞周期阻滞在G2/M期。
cyclin D1是STAT3的靶基因,定位于染色体11q13,是细胞周期蛋白成员之一,也是目前研究较为深入的细胞周期蛋白[16]。cyclin D1可以与细胞中周期蛋白依赖激酶特异性结合,并使之激活进而调控级联信号分子在G1~S转换期间发生磷酸化,影响基因的转录和表达[17]。cyclin D1能够促使细胞从G1期进入S期,是细胞周期的正调控蛋白。cyclin D1在正常的细胞中表达量较为恒定,当其过表达后,会导致细胞G1期缩短,细胞增殖速度加快[18]。在脑胶质瘤、淋巴瘤、鼻咽癌等多种肿瘤中均发现cyclin D1高表达[19]。
caspase蛋白家族参与肿瘤细胞的凋亡,是与细胞凋亡密切相关的蛋白家族[20]。caspase 3是凋亡执行因子,在正常情况下以酶原形式存在,当受到外界信号刺激后被活化成cleaved caspase 3,促进细胞凋亡发生[21]。本研究结果显示,JSI-124作用后的恶性淋巴瘤细胞中cleaved caspase 3水平升高,cyclin D1水平下降,这与细胞周期和凋亡检测结果一致。
综上所述,阻断STAT3信号通路能够降低恶性淋巴瘤细胞增殖能力,促进恶性淋巴瘤细胞凋亡,将细胞周期阻滞在G2/M期,促进caspase 3活化,降低cyclin D1表达水平。STAT3作为重要的转录因子信号通路,在肿瘤中的作用日益受到关注,靶向抑制其激活可能是治疗肿瘤的有效方法。
