镁矿渣酸溶释出镁离子的特征及影响因素研究
2019-03-20,
,
(1.长江科学院 流域水环境研究所,武汉 430010; 2. 长江科学院 流域水资源与生态环境科学湖北省重点实验室,武汉 430010)
1 研究背景

污水中镁含量一般较低,寻找廉价高效的镁源是提高磷酸铵镁磷回收工艺经济性的必然选择。国外常用的磷酸铵镁生成镁源包括Mg(OH)2、MgCl2·6H2O、MgSO4、MgO、MgCO3、盐卤、海水以及菱镁矿冶炼副产物等。研究表明,MgCl2·6H2O的Mg2+供给效率高于Mg(OH)2,可达到95%[5]。同等实验条件下,盐卤、MgCl2、海水的磷去除效率分别为76%,75%,81%[6]。添加粒径<0.04 mm的菱镁矿煅烧渣可生成高达450 mg/L的磷酸铵镁,且沉淀量分别随着粒径减小和表面粗糙度增加而增加[5,7]。为削减磷回收成本,Etter 等[8]在人尿中投入菱镁矿副产物MgCO3,通过尼龙过滤袋(孔径160±50 μm)成功回收90%的磷。Lind等[9]在人尿中投入MgO、沸石和钙硅石,结果绝大部分N,P,K等营养元素生成了磷酸铵镁、斜磷铝硅石、镁磷石和氢氧镁石,通过磷酸铵镁沉淀和氨氮吸附的方式去除和回收了尿液中6%~80%的氮。Tang等[10]研究表明盐酸改性后的镁矿渣具有氮、磷回收利用的潜在价值,其对磷的回收率可达40%以上。由此可见,镁矿工艺废弃产物能够用作磷酸铵镁生成的潜在镁源。
人工湿地因构造简单、基建投资小、污染去除效果好、维护方便等优点,被广泛用于污水磷去除[11]。填料吸附、沉淀、滞留是湿地除磷主要机制[12]。然而,湿地填料磷的吸附容量有限,随着运行时间增加,填料磷渐近吸附饱和,除磷效率通常在2~3 a后出现显著下降[13]。为实现湿地系统长期有效除磷,通常需要对磷吸附饱和的湿地休作或更换新填料[14],但更换出的磷吸附饱和填料因含磷量较低,无法用作肥料而以固体废物处理,造成二次污染。延长湿地填料除磷使用寿命和磷吸附饱和填料的资源化利用已成为制约该工艺应用的技术瓶颈。
镁矿在开采过程中会有大量的低品位镁矿渣被废弃,若含镁废弃物直接排放不仅会占用大量土地,污染环境,同时资源也未能得到充分利用,造成资源浪费。鉴于此,不少研究主要针对含镁矿石进行深入的脱镁与综合利用,所采用的主要方法为浮选或者浸出工艺[15-17]。但这些研究主要关注浮选(浸出)药剂的选择及工艺流程的优化,而较少关注低品位镁矿渣作为湿地填料回收利用问题。本文主要针对不同浸提条件下镁离子的溶出特征进行研究,探讨镁矿渣作为湿地填料在磷回收中的潜在利用价值,以期为利用矿渣中镁源回收污水中氮磷的技术提供参考。
2 材料与方法
2.1 实验材料
实验所用镁矿渣主要化学组成为:SiO2占 25.24%、Al2O3占 0.67%、Fe2O3占1.06%、CaO占 18.91%、MgO占 23.37%,LOI(烧失量)占30.75%[10]。实验时将矿渣在105 ℃烘干至恒重,然后根据实验要求,将矿渣研磨过筛后放入玻璃瓶中保存。
2.2 实验方法
镁形态分析:取1.000 g镁矿渣样品加入100 mL离心管中,采用如表1所示的方法对镁矿渣进行连续浸提[18],浸提后离心过滤,测定溶液中镁离子的含量。
镁矿渣中镁离子的浸出动力学:取0.500 g镁矿渣样品加入100 mL离心管中,然后加入50 mL浓度为1 mol/L的HCl,于25 ℃条件下连续震荡,按照0.25,0.5,1,1.5,2,3,5,8,12,20 h取样分析。
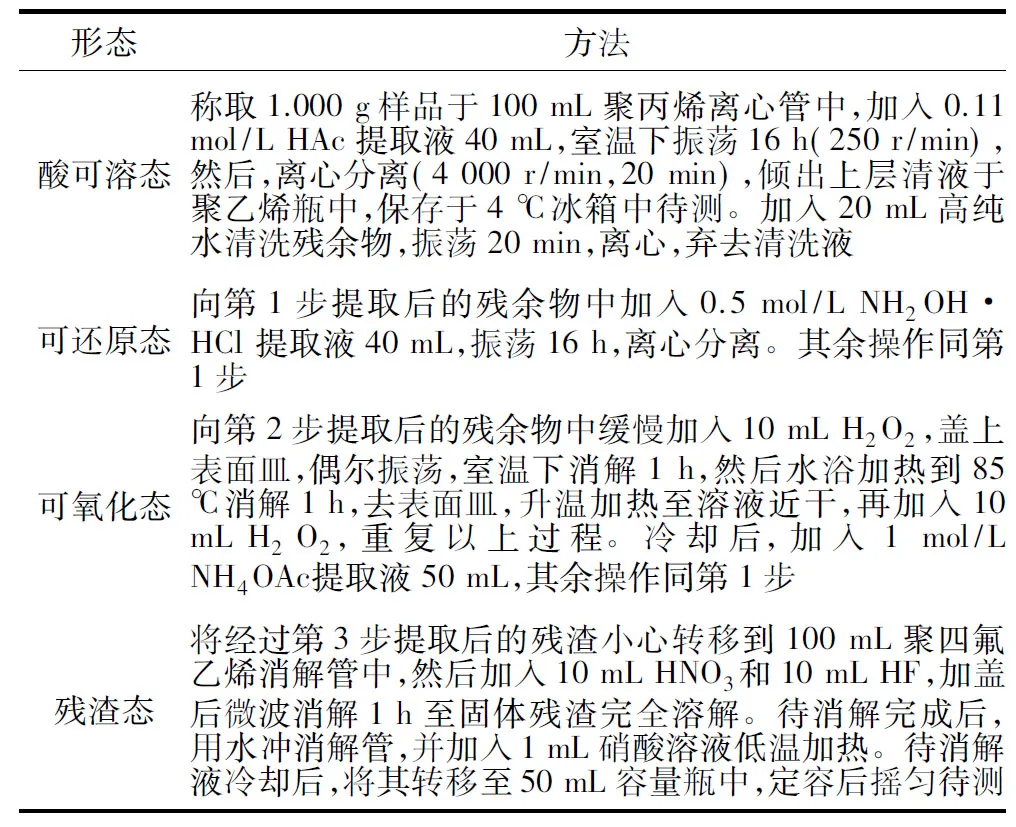
表1 镁形态分级提取方法Table 1 Sequential extraction procedures for the determination of Magnesium forms in mineral residue
不同固体浓度(3~200 g/L)条件下矿渣中镁离子的溶出特征:分别向50 mL离心管中加入不同质量的镁矿渣,然后加入25 mL浓度为1 mol/L的HCl,于25 ℃条件下连续震荡8 h,离心过滤测定滤液中镁离子含量。
不同盐酸浓度(0.001~1 mol/L)条件下矿渣中镁离子的溶出特征:取0.500 g镁矿渣样品加入50 mL离心管中,分别加入不同浓度的盐酸溶液25 mL,于25 ℃条件下连续震荡8 h,离心过滤测定滤液中镁离子含量。
2.3 样品分析与数据处理
浸提液中金属离子浓度采用微波等离子体原子吸收光谱仪(MP-AES,Agilent 4200)测定[19]。采用Bruker D8 advance 对矿物结构粉末样品进行分析,分析时将样品研磨过200目(75 μm)筛,管电压为40 kV,管电流40 mA,扫描速率4°/min,步长0.02°。镁矿渣粒径分布采用马尔文激光粒度仪(Mastersizer 3000)分析。
每组实验均做3个平行样,平行样之间误差<5%,实验结果以3个平行样的平均值表示。采用Origin 9.0进行绘图及数据拟合。
3 结果与讨论
3.1 酸溶镁矿渣镁离子释放动力学特征
浸出时间对镁离子浸出的影响较显著,整个浸出动力学曲线呈S型(图1)。在反应的初始阶段(t<1 h时),盐酸与镁矿渣的反应速率较低,这主要是因为H+与镁矿渣进行反应时还有一个混合扩散的过程。当浸出时间逐渐增加到5 h时,反应速率加快,镁离子浸出量显著增长,由78 mg/kg增加到117 mg/kg。超过5 h后,随着浸出时间的增加,镁离子浸出量基本保持不变。为了缩短浸出时间,确保最佳的浸出时效,实验采用浸出时间为5 h。
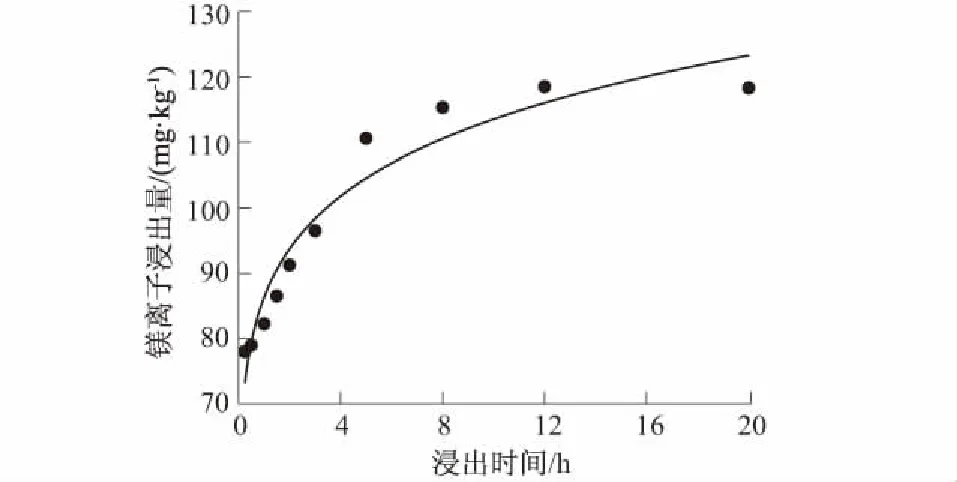
图1 浸出时间对镁离子释出的影响Fig.1 Effect of leaching time on Mg2+ release
表2 为不同模型拟合下的镁离子浸出动力学方程,其中双常数速率模型、准一级动力学模型和Logistic曲线模型拟合较好。这表明盐酸浸提镁矿渣中的镁离子属于准一级动力学过程,H+在镁矿渣颗粒表面的扩散是控制浸出反应的主要因素。

表2 不同模型拟合动力学方程参数Table 2 Estimated parameter values for differentkinetic models
3.2 颗粒浓度对镁矿渣中镁离子释出的影响
由图2可以看出,随着颗粒浓度的增加,镁离子浸出量逐渐减少。

图2 颗粒浓度对镁离子浸出量的影响Fig.2 Effect of particle concentration on Mg2+ release
当颗粒浓度≤5 g/L时镁离子浸出量基本保持不变且达到最大,约为120 mg/kg,而当颗粒浓度为40 g/L时镁离子浸出量为85 mg/kg,继续增加镁矿渣用量,镁离子浸出量略有减小。因此,当浸出盐酸的浓度为1 mol/L时,适宜的浸出固体颗粒浓度为5 g/L。镁浸出率不高的原因可能在于矿物的晶体结构较为紧密,盐酸很难将镁离子淋洗掉,当浸出体系中固体浓度较高时杂质会消耗较多的H+,而使得与镁离子有效作用的H+减少。
3.3 盐酸浓度对镁矿渣中镁离子释出的影响
图3为不同浓度盐酸溶液对镁离子浸出的影响。盐酸浓度为0.001 mol/L时,镁离子浸出量仅为69.92 mg/kg,随着盐酸浓度的升高,镁离子浸出量不断增加。盐酸浓度为0.1 mol/L时,镁离子浸出量为106.20 mg/kg,约为低浓度条件下(盐酸浓度为0.001 mol/L时)的1.5倍。当盐酸浓度>0.1 mol/L时,镁离子浸出量增加幅度逐渐减小,镁离子浸出量最高可达117.71 mg/kg。在图3的实验条件下,镁离子浸出量的提高与盐酸的初始浓度值成正比,这表明H+浓度对镁矿渣的溶解过程影响非常显著,可以推断H+通过液膜的扩散反应是影响镁矿渣中镁离子浸出速率的关键步骤。为保持H+足够的扩散潜力,同时获得最佳的镁离子溶出量,实验选择浸出盐酸浓度为1 mol/L。

图3 盐酸溶液浓度对镁离子浸出量的影响Fig.3 Effect of HCl concentration on Mg2+ release
3.4 颗粒粒径对镁矿渣中镁离子释出特征的影响
图4为不同粒径镁矿渣在1 mol/L盐酸浸提下镁离子的浸出量。由图4可以看出镁矿渣颗粒大小对镁离子浸出量有一定影响。当矿渣颗粒粒径>150 μm(100目)时,随着颗粒粒径的增加,镁离子浸出量逐渐减小。当镁矿渣颗粒粒径<150 μm时,在此实验条件下镁离子浸出量保持恒定,不再随颗粒粒径发生变化。其中当镁矿渣粒径为495 μm(32目)时,镁离子浸出量约为110.61 mg/kg,当镁矿渣粒径为150 μm时,镁离子浸出量达117.70 mg/kg,相对增加了6.4%。这主要是因为较大的颗粒比表面积相对较小,与H+的扩散接触面积相对较小,从而影响了镁离子的浸出。因此,确定最佳的颗粒物粒径为150 μm。
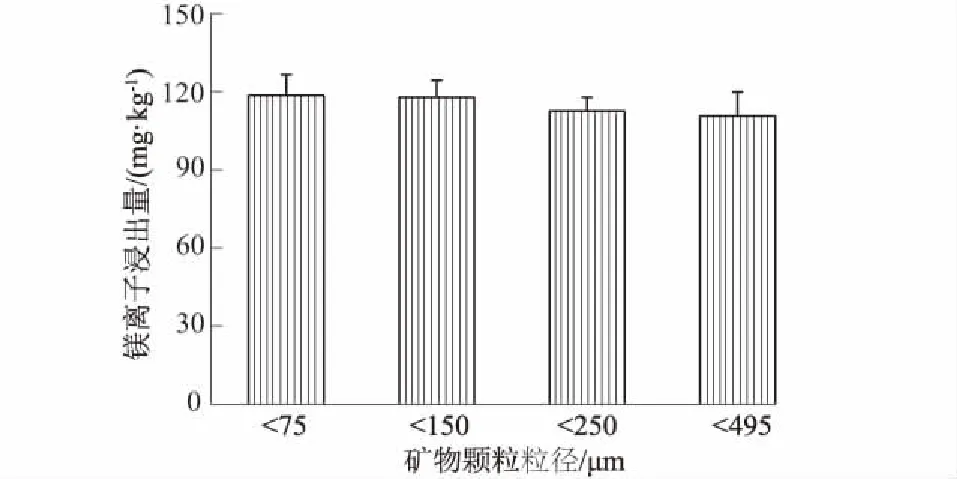
图4 镁矿渣粒径对镁离子浸出量的影响Fig.4 Effect of particle size on Mg2+ release
3.5 镁矿渣中镁的形态分布特征
盐酸浸提前后酸可溶态镁含量发生了显著变化,其余形态镁则相对恒定(表3)。原样中酸可溶态镁含量由128.00 mg/kg降至浸提后的15.60 mg/kg,浸提前后的差值约同镁离子的浸出量相当。镁离子浸出率仅为0.19%,可浸出镁约占酸可溶态镁的92%(表3),这表明,盐酸浸提主要对矿渣中能与酸发生反应的部分发生作用,浸提液中的镁主要来自于酸可溶态镁。
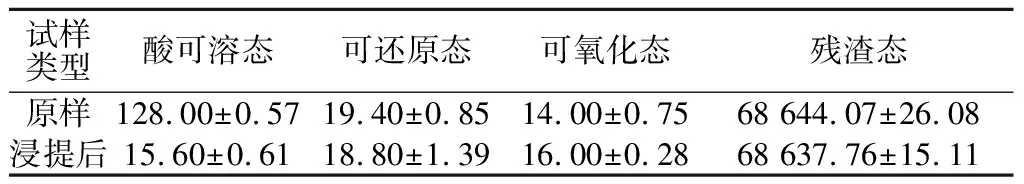
表3 盐酸浸提前后不同形态镁的含量Table 3 Magnesium fractions of magnesium mineralresidue before and after being soaked in HCl solution mg/kg
3.6 酸溶对矿渣结构的影响
图5为在相同分析条件下,浸提前后镁矿渣的XRD粉末衍射图谱。
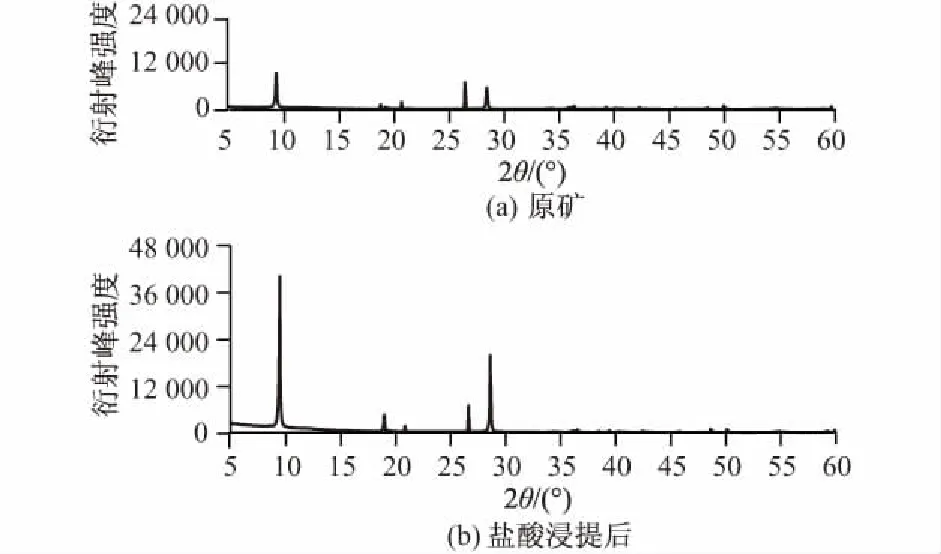
图5 盐酸浸提前后镁矿渣的XRD图谱Fig.5 XRD patterns of magnesium mineral residue before and after being soaked in HCl solution
由图5可知原矿中主要含有滑石和石英。通过XRD对比分析浸提前后镁矿渣的结构特征可以发现,在2θ=19.7°处衍射峰消失,2θ=26.2°处衍射峰强度急剧降低,浸提后衍射图谱基线更加平滑。这表明浸提能有效去除矿渣晶体表面的杂质颗粒及碳酸盐矿物,浸提后矿渣的结晶程度更高。天然滑石矿中常存在一种或以上菱镁矿、白云石等杂质[20],盐酸浸提过程中碳酸盐充分反应,并伴有微小气泡,表明浸出液中的镁离子可能有部分来自于含碳酸盐镁矿的溶解。
图6为浸提前后镁矿渣颗粒粒径分布变化曲线。浸提后镁矿渣粒径分布曲线和粒径累积分布曲线明显左移,即盐酸浸提后镁矿渣粒径变小。镁矿渣的d10,d50,d90分别由浸提前的3.21,14.2,71.7 μm减小到浸提后的3.08,12.1,70.7 μm。其比表面积则由浸提前的840.3 m2/kg增加至浸提后的902.7 m2/kg。这表明盐酸溶液能够溶蚀部分镁矿渣颗粒,同时改善镁矿渣颗粒的表面性能,浸提后比表面积增加,有助于镁矿渣颗粒与溶液接触。
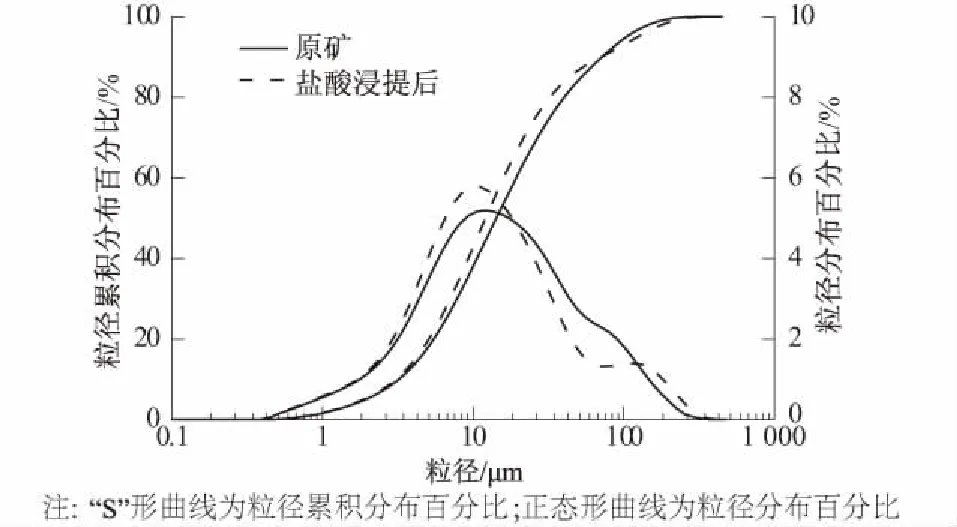
图6 盐酸浸提前后镁矿渣粒径分布曲线Fig.6 Particle size distribution curves of magnesium mineral residue before and after being soaked in HCl solution
3.7 镁矿渣作为固体镁源回收污水中磷的潜力分析
加入晶种可使磷酸铵镁晶体的成核时间(即诱导期)进一步缩短,从而加快反应速度,同时还可使磷酸铵镁附载在晶种上,增强磷回收率[22-24]。镁矿渣作为一种天然的含镁矿物,其结构是由两层硅氧四面体夹一层水镁石八面体组成,没有剩余的表面电荷,也没有层间阳离子,不同层间仅由弱的范德华力结合在一起,较易发生层间置换[25]。投加的晶种表面含有的与磷酸铵镁类似的成分越多,越易使介稳区宽度变小从而使诱导期缩短,从而使溶液中的镁离子、氨根离子、磷酸根离子不断在晶种表面聚集并生长[26]。
水体pH值是影响人工湿地污染物去除率的重要因素[27]。通常人工湿地填料能够缓冲因有机物的厌氧降解产酸导致的pH值降低[28],但对酸性废水的缓冲能力较为有限。同时较低的pH值使得硝化细菌等微生物难以生存,在这种环境中以镁矿渣为填料不仅具有一定的酸碱缓冲能力和磷酸盐吸附绑定能力,提供更为廉价的镁源,供磷酸铵镁沉淀反应,其固体残渣还能够作为晶种,加速磷酸铵镁沉淀反应速率,因此镁矿渣是一种极具潜力的湿地磷回收填料。
为破解污水废水人工湿地修复填料饱和且氮磷难以回收的困境,提高湿地填料磷回收利用率,对现有人工湿地填料进行优化,提出一种以镁矿渣为湿地填料的酸性废水磷回收技术(图7),包括酸性废水预处理、填料吸附饱和及填料回收等环节。

图7 基于镁矿渣的人工湿地填料磷回收利用示意图Fig.7 Schematic diagram of phosphorus recovery from constructed wetland by using magnesium slag
如图7所示,含氮磷的废水首先在前处理池与镁矿渣混合反应,一方面使镁矿渣释出部分钙镁离子直接与氮磷废水反应沉淀,另一方面镁矿渣得到表面改性,吸附能力提高。随后将改性的镁矿渣置于人工湿地填料床,使之与污水中氮磷发生吸附沉淀反应并逐步饱和。当监测到人工湿地发生大量堵塞、填料氮磷去除能力达到饱和时取出湿地中的填料,分离出结晶的磷酸铵镁,经过分选处理后的晶体可用于非直接食用作物的肥料来源。
4 结 论
(1)随着浸提时间的增长,浸提液中镁离子的浓度逐渐增加,当浸提时间达到5 h后浸提液中镁离子浓度不再增加;在一定范围内减小矿渣颗粒尺寸、提高盐酸浓度、减小浸出时颗粒浓度均有利于镁离子释出。
(2)针对本实验所用原料最佳浸出工艺为:镁矿渣颗粒为150 μm(100目)、浸提盐酸浓度为1 mol/L、浸出最佳固体颗粒浓度为5 g/L,浸提时间为5 h,镁离子浸出量约为117.70 mg/kg。
(3)酸溶后镁矿渣粒径减小,比表面积略有增加,理论上对污水中磷的去除能力可达810 mg/kg,是一种极具潜力的磷回收材料。
