戊糖片球菌P36胞外多糖体外抗氧化能力的研究*
2019-03-20,,,
,,,
(1.陕西广播电视大学 旅游与酒店管理学院,陕西 西安 710119;2.陕西广播电视大学 会计学院,陕西 西安 710119; 3.陕西广播电视大学 图书馆,陕西 西安 710119;4.陕西师范大学 食品工程与营养科学学院,陕西 西安 710119)
正常状态下,人体中自由基的产生和清除处于动态平衡状态,但由于种种原因导致机体自由基产量升高或者机体清除自由基的能力下降时,机体就会出现氧化应激,这种状态会使机体受到一定的损伤,引发机体功能障碍[1-3]。机体抗氧化和抗衰老等能力的强弱主要取决于清除自由基的能力,所以人们对于抗氧化剂的需求非常迫切。但是人工合成的抗氧化剂因为其成本较高,且伴随有较多的副作用,因此寻求无毒副作用的天然抗氧化剂成为当务之急。
有研究表明,乳酸菌胞外多糖具有良好的益生活性[4]。本研究所用的戊糖片球菌P36是项目团队从陕南泡菜中筛选出的一株高产胞外多糖的乳酸菌株,因有研究表明乳酸菌胞外多糖在体内外都具有一定的抗氧化活性[5-6],故本研究评价了戊糖片球菌P36胞外多糖体外抗氧化的能力。
一、材料与方法
(一)材料与仪器
二苯基苦基苯肼自由基(DPPH)、ABTS 美国sigma公司;邻苯三酚、30%的过氧化氢、硫酸亚铁、1,10-邻菲罗啉、氯化铁 中国医药集团上海化学试剂公司。
恒温培养箱 上海一恒科技有限公司; SW-CJ-1CV超净台 苏州安泰空气技术有限公司;5415R 冷冻离心机 德国Eppendorf; UV-2450紫外可见分光光度计 日本岛津。
(二)实验方法
1.乳酸菌菌种。试验用戊糖片球菌P36分离自传统发酵食品。将冻存于-80℃的乳酸菌接入MRS液体培养基中,37℃培养18 h,连续活化三代后用于后续试验。
2. 戊糖片球菌P36胞外多糖制备。菌株P36接种于100 ml 培养基中,42℃下培养24 h,用超高速低温冷冻离心机将发酵液于4℃,12000 r/min冷冻离心15 min,弃沉淀,重复离心两次。发酵滤液加入75%乙醇在4℃下沉淀24 h,再次冷冻离心,重复离心两次,取沉淀以蒸馏水复溶,透析过夜,定容,即得粗多糖溶液。粗多糖经DEAE-Cellulose-52柱纯化后得纯多糖,以纯多糖配制1 mg/mL、2 mg/mL、3 mg/mL、4 mg/mL、5 mg/mL不同浓度的多糖溶液。
3.戊糖片球菌P36胞外多糖对DPPH自由基的清除作用。依据Zhang等[7]的方法,反应体系中加入1 mL不同浓度的多糖溶液,再加入1 mL 0.2 mmol/L DPPH的无水乙醇,震荡充分混匀,在室温下避光反应30 min,再于6000 rpm离心10 min,取其上清,517 nm波长处测定样品吸光度(OD值)。用等体积的生理盐水代替样品溶液作为对照组,并以等体积的生理盐水和无水乙醇的混合液作为空白调零。按照以下公式计算DPPH自由基的清除率:
DPPH自由基清除率(%)=[1-A样品/A空白]×100
4. 戊糖片球菌P36胞外多糖对超氧阴离子的清除作用。参照文献[5]的方法,取50 mmol/L pH 8.2的缓冲液3 mL,加入25 mmol/L 邻苯三酚10μL,迅速混匀,置于石英比色杯中,在325 nm处每隔30 s测定一次吸光值,反应4.5 min结束,以吸光值对时间作图,斜率即为邻苯三酚自氧化速率A0。在3 mL 缓冲液中加入不同浓度的胞外多糖,同法测定样品的自氧化速率As,按照以下公式计算超氧阴离子自由基清除率:
超氧阴离子自由基清除率(%)=(A0-As)/ A0×100
5. 戊糖片球菌P36胞外多糖对羟自由基的清除作用。参照文献[7]的方法,1 mL 2.5 mmol/L的1,10-邻菲罗啉,1 mL pH 7.4的 PBS和1 mL蒸馏水充分混匀后,再加入1 mL 2.5 mmol/L的FeSO4,充分混匀后,加入1 mL 20 mmol/L的H2O2,37℃中水浴1.5 h,在536 nm处测定其OD值为A空白。把1mL水替换为1 mL 不同浓度的胞外多糖记为A样品,将1 mL的H2O2替换为1 mL的水记为A对照。按照如下公式计算乳酸菌清除羟自由基的能力:
清除羟自由基能力(%)= [A样品-A空白)]/[ A对照-A空白] ×100
6. 戊糖片球菌P36胞外多糖对ABTS+的清除作用。参照文献[8]的方法。将7 mmol/L ABTS和2.45 mmol/L的过硫酸钾(终浓度)混合,在室温避光条件下静置过夜,将生成的ABTS+溶液用水稀释,使其在30℃,734 nm 波长下的吸光度为0.6至0.8之间,即得到ABTS+工作液。取不同浓度胞外多糖溶液1 mL,加入试管中,再分别加入1.5 mL的ABTS+溶液,空白管用蒸馏水代替样品溶液,对照管用蒸馏水代替ABTS+工作液,室温避光放置 6 min,于波长734 nm下测定其吸光度。计算公式为:
ABTS+的清除率(%)=[ A空白-(A样品-A对照)]/A空白×100
(三)数据分析
数据统计采用SPSS 16.0进行one-way ANOVA, Tukey’s多重检验(P < 0.05),数值以均值±标准差表示。
二、结果与讨论
(一)戊糖片球菌P36胞外多糖对DPPH自由基的清除率

图1 胞外多糖对DPPH自由基清除率 注:不同字母代表差异显著, P<0.05.
本研究对戊糖片球菌P36不同浓度的胞外多糖清除DPPH的能力进行测定,由图1可知,戊糖片球菌P36胞外多糖具有一定的抗氧化性,其对DPPH自由基清除能力均高于10%,并且随多糖浓度的升高而增加。多糖浓度为5 mg/mL对DPPH自由的清除率显著高于浓度为3 mg/mL时的清除率(P<0.05)。
(二)戊糖片球菌P36胞外多糖对超氧阴离子的清除率
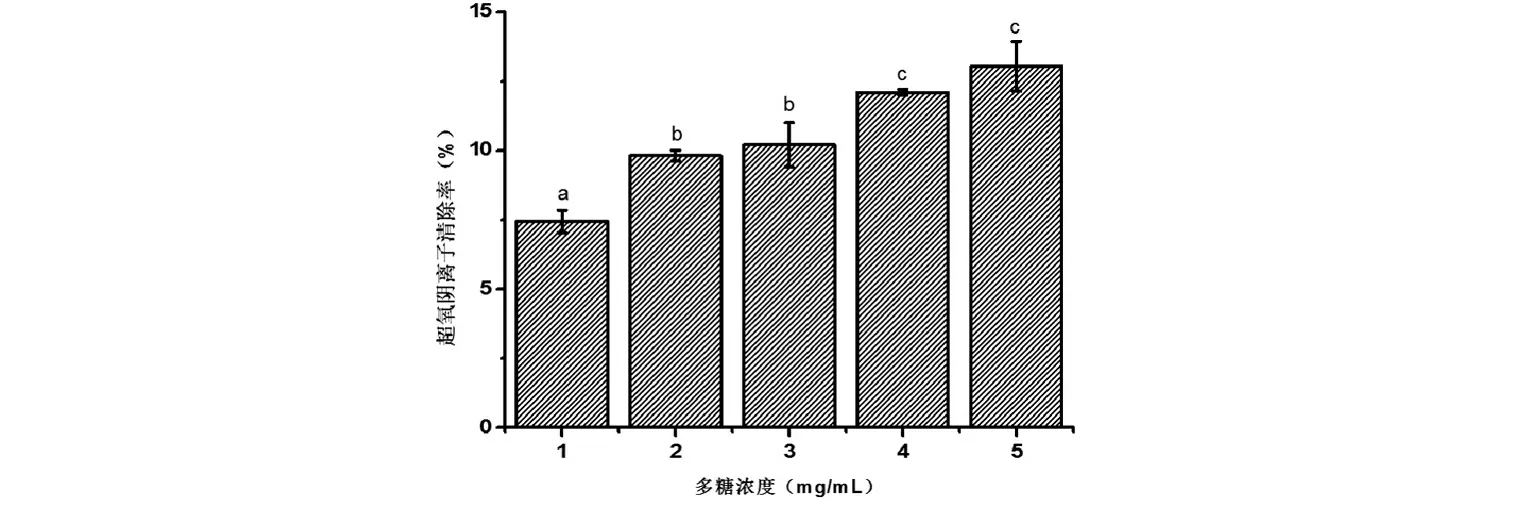
图2 菌株P36胞外多糖对超氧阴离子清除率 注:不同字母代表差异显著, P<0.05.
目前,国内主要通过邻苯三酚自氧化法来测定抗氧化物对超氧阴离子的清除率。本研究测定了戊糖片球菌P36胞外多糖对超氧阴离子的清除率。如图2所示,戊糖片球菌P36胞外多糖对超氧阴离子的清除能力随胞外多糖浓度的升高而增加。当胞外多糖浓度为5 mg/mL时,其清除率可达到13.04%。
(三)多糖对羟自由基的清除作用研究

图3 菌株P36胞外多糖对羟自由基的清除率 注:不同字母代表差异显著, P<0.05.
邻二氮菲-Fe2+是一种氧化还原指示剂,Fe2+与H2O2反应后产生羟自由基,其具有很强的氧化能力。邻二氮菲-Fe2+被羟自由基氧化后生成邻二氮菲-Fe3+,导致其在536 nm波长处的最大吸收值减少。加入抗氧化剂之后,羟自由基的浓度减少,所以体系中的吸光值随之升高。因此羟自由基的变化量可以根据加入样品前后吸光值的大小变化来评价,以此来判定胞外多糖清除羟自由基的能力。本文研究表明,戊糖片球菌P36胞外多糖对羟基自由基的清除能力随多糖浓度的升高而增加,多糖浓度为5 mg/mL对DPPH自由的清除率显著高于浓度为4 mg/mL时的清除率(P<0.05)。
(四)多糖对ABTS+的清除作用研究
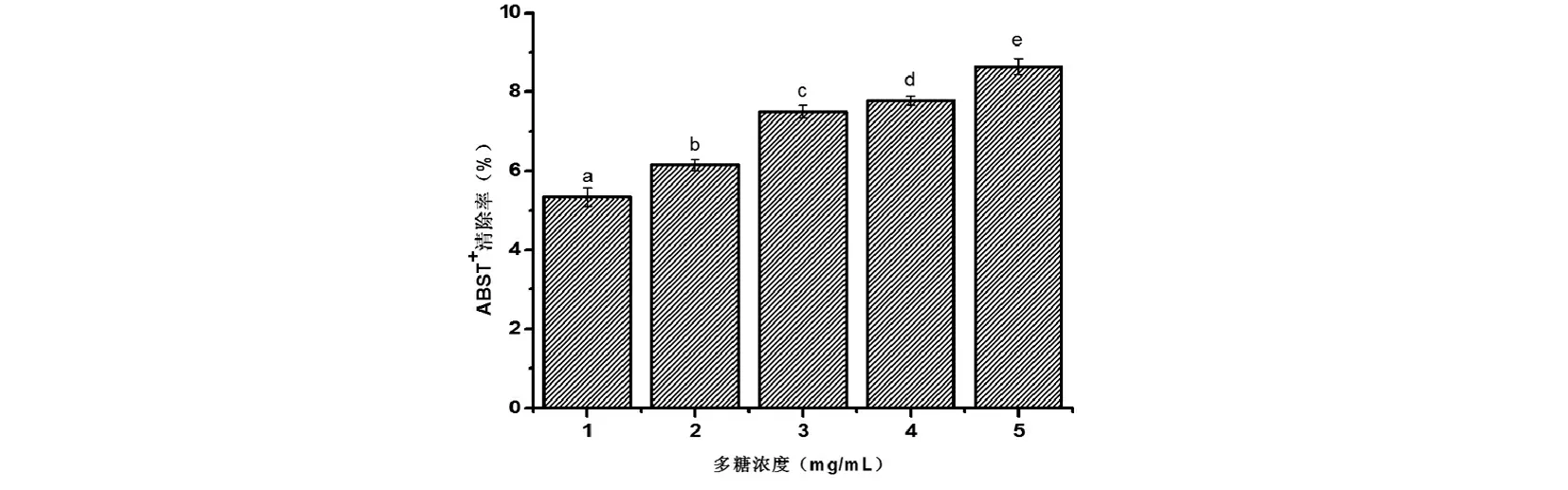
图4 菌株P36胞外多糖对ABTS+自由基的清除率 注:不同字母代表差异显著, P<0.05.
ABTS+清除实验是测定化合物抗氧化能力的重要方法[9]。ABTS+自由基的产生是通过 ABTS原液与过硫酸钾在室温黑暗中反应12-16 h 完成,在供氢抗氧化剂存在的情况下,ABTS+自由基将会减少。如图4所示,戊糖片球菌P36胞外多糖对ABTS+自由基的清除能力随多糖浓度的升高而显著增加。多糖浓度为5 mg/mL时对ABTS+自由基的清除率比浓度为4 mg/mL时显著提高了11%(P<0.05)。
三、结论
本研究对戊糖片球菌P36的胞外多糖进行了体外抗氧化能力的测定。随着胞外多糖浓度的升高,其体外抗氧化的能力随之升高,当胞外多糖浓度为5 mg/mL时,其对DPPH的清除率达到了30%以上。结果表明,戊糖片球菌P36的胞外多糖在体外具有一定的抗氧化作用。因此,可进一步在动物体内评价戊糖片球菌P36胞外多糖的抗氧化能力,为以后的工业化应用奠定基础。
