非小细胞肺癌化疗敏感性与EML4-ALK、EGFR、KRAS、c-MET基因状态的关系
2019-03-19黄晖李丽华万敏娜万琳邹怀宇万洁华
黄晖,李丽华,万敏娜,万琳,邹怀宇,万洁华
(宜春市人民医院 全科医学科,江西 宜春 336000)
肺癌是中国最常见的恶性肿瘤之一[1],我国女性非吸烟患者中以腺癌为主,吸烟患者则多见鳞状细胞癌。化疗使得中晚期非小细胞肺癌患者受益,能延长患者的疾病无进展时间和总生存时间。近年培美曲塞单药或联合铂类成为肺腺癌的一线治疗;紫杉醇类或吉西他滨联合铂类用于肺鳞癌的一线治疗。但有效率不容乐观,化疗的总有效率不足35%。如何预判患者的化疗反应成为临床研究的热点。基因检测揭示癌细胞的基因特点。最早引起关注的是表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变,该突变使得癌细胞加速增殖、分化和侵袭,而该基因改变在亚洲非吸烟女性的肺腺癌患者中更易被发现[2]。针对突变患者,使用EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)治疗,较传统治疗比较,患者的无病生存期和总生存期均延长[3-5]。随着研究的进展,人们发现EGFR-TKI的耐药基因和新的靶点,比如间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)基因突变预示着EGFR-TKI治疗效果差[6],KRAS基因(K-ras,p21)和c-MET靶点有潜在的治疗价值等[7-8]。但是靶向治疗虽然在晚期肿瘤患者中研究众多,且多数研究结果显示患者受益,靶向治疗如何与传统治疗包括化疗、放疗等治疗方法协同,靶点基因改变是否与传统治疗效果存在相关性等问题仍未明确。循环肿瘤 DNA(circulating tumor DNA,ctDNA)主要是由单链或双链DNA以及单链与双链DNA的混合物组成,以DNA蛋白质复合物或游离DNA两种形式存在。ctDNA来自肿瘤细胞基因组突变,检测准确性高、很少出现假阳性。ctDNA是一种特征性的肿瘤生物标志物,来自肿瘤细胞的体细胞突变[9-12],不同于遗传突变的是其存在于体内每个细胞。
1 资料与方法
1.1 研究对象
选取2015年1月—2018年1月在江西省宜春市人民医院就诊的肺癌患者,经活检证实为非小细胞肺癌,参照CT、MRI、B超等检查结果明确局部淋巴结转移情况,参照第8版肺癌TNM分期,入组Ⅲ期b至Ⅳ期患者96例。患者接受化疗至少2个周期后评判治疗效果,化疗方案为:腺癌采用培美曲塞+顺铂;鳞状细胞癌采用紫杉醇+顺铂。参照实体瘤的疗效评价标准(RECIST 1.1)[13],将效果分为:①完全缓解,指靶病灶消失,病理淋巴结直径小于1 mm,持续>4周;②部分缓解,指病灶直径之和减少超过30%,持续>4周;③疾病进展,指病灶直径之和超过20%;④疾病稳定,指未达到部分缓解,也未达到疾病进展的程度。参照WHO化疗毒副作用分级,将化疗副作用分成5级[14]。参照Karnofsky功能状态评分标准(KPS评分)评价患者体力状况。
本实验患者平均(64.25±12.46)岁;男∶女为15∶33;患者有吸烟史22例;腺癌64例,鳞状细胞癌32例;Ⅲb期患者42例,Ⅲc期患者38例,Ⅳ期患者16例;治疗前Karnofsky评分均小于60分患者。
1.2 研究方法
1.2.1 收集样本 血液标本均在患者接受治疗前保留。本研究经本院伦理委员会审批同意,所有患者在保留血液标本和检测ctDNA前均签署知情同意书。
1.2.2 血清收集、ctDNA 扩增和基因突变分析 患者于治疗开始前1天清晨收集10 ml静脉血,置于含有 EDTA 的标本管内,于收集2 h内4℃,3 000 r/min离心10 min;血浆在监测分析前置入-80℃冰箱冷冻保存。采用扩增受阻突变系统(amplification refractory mutation system,ARMS)血浆EGFR、ALK、KRAS、c-MET基因突变分析方法,对外周血测ctDNA中目标基因状况进行检测。外周血肿瘤细胞游离DNA的提取方法按照厦门艾德生物医药科技有限公司血浆标本DNA提取试剂盒说明书进行操作。ARMS实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)扩增采用厦门艾德生物医药科技有限公司目的基因检测试剂盒,按照试剂和操作步骤和要求对目的基因突变状态进行监测分析。
1.2.3 化疗方案 腺癌患者 64 例均接受培美曲塞(500 mg/m2,第 1 天)+ 顺铂(75 mg/m2,第 1 天)化疗方案化疗,16例患者接受化疗2周期后手术,48例患者接受4周期化疗后接受评价;鳞状细胞癌患者32例均接受紫杉醇(175~200 mg/m2,第1天)+顺铂(75 mg/m2,第1天)方案化疗,6例患者接受2周期化疗后手术,10例患者接受3周期化疗后手术或更改治疗方案,16例患者接受4周期化疗后评价。其中接受手术在手术结束1周后进行评估。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计数资料以例(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义
2 结果
2.1 血清基因变化、化疗效果及化疗副作用情况
EGFR基因突变包括EGFR酪氨酸激酶编码区18、19、20、21外显子的突变为点,共检测50例突变患者,检测率为52.08%。其中18外显子突变者8例,19外显子缺失突变者24例,21外显子突变者26例;其中6例合并有19外显子缺失突变,2例合并18外显子突变。AML4-ALK基因融合突变者4例,检测率为4.17%。KRAS基因突变者8例,检出率为8.33%。c-MET基因突变者16例,检测率为16.67%。本试验化疗总有效率为29.17%(28例/96例),其中腺癌患者总有效率为31.25(20例/64例);鳞状细胞癌患者总有效率为25.00%(8例/32例)。消化道副作用包括恶心、呕吐、腹泻、便秘等48例,严重消化道反应需补液治疗者10例;骨髓抑制60例,严重骨髓抑制、需集落刺激因子注射治疗的8例;不同程度脱发者30例,严重者4例;其他未见明显毒副反应。见表1。

表1 患者的化疗效果情况
2.2 不同EGFR基因状态患者的化疗效果及化疗副作用情况
50例EGFR突变患者中包括48例肺腺癌患者和2例肺鳞癌患者,化疗有效12例,有效率为24.00%;46例EGFR野生型患者中包括16例肺腺癌患者和30例肺鳞癌患者,化疗有效21例,有效率为45.65%。两组化疗有效率差异有统计学意义(P<0.05)。两组化疗严重化疗毒副作用的差异无统计学意义(P>0.05)。见表2。
2.3 不同ALK基因状态患者的化疗效果及化疗副作用情况
5例ALK突变者中有4例为棘皮动物微管相关蛋白样4与间变淋巴瘤激酶融合基因(echinoderm microtubule-associated protein-like 4-anaplastic lymphoma kinase,EML4-ALK)融合突变患者,他们均为肺腺癌患者,这4例化疗均有效,有效率100%;92例无AML4-ALK融合突变患者中包括60例肺腺癌患者和32例肺鳞癌患者,化疗有效28例,有效率30.77%。两组化疗有效率比较差异有统计学意义(P<0.05)。两组化疗严重化疗毒副作用的差异无统计学意义(P>0.05)。见表3。
2.4 不同KRAS基因状态患者的化疗效果及化疗副作用情况
8例KRAS突变患者均为肺腺癌患者,化疗总有效例数为6例,有效率75%(6例/8例);88例KRAS无突变患者中包括56例肺腺癌患者和32例肺鳞癌患者,化疗总有效例数为27例,有效率30.68%。两组化疗有效率差异有统计学意义(P<0.05)。两组化疗严重化疗毒副作用的差异无统计学意义(P>0.05)。见表4。
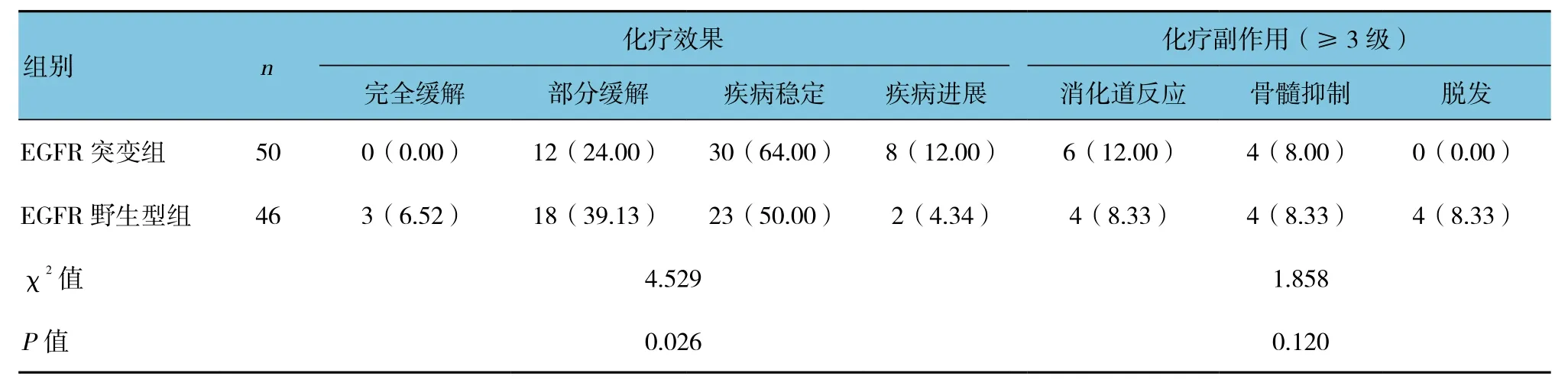
表2 不同EGFR基因状态患者的化疗效果及化疗副作用情况 例(%)

表3 不同ALK基因状态患者的化疗效果及化疗副作用情况 例(%)
2.5 不同c-MET基因状态患者的化疗效果及化疗副作用情况
16例c-MET突变患者中包括14例肺腺癌患者和2例肺鳞癌患者,化疗有效为2例,有效率12.50%(2/16);80例c-MET无突变患者中包括50例肺腺癌患者和30例肺鳞癌患者,化疗有效为31例,有效率38.75%。两组化疗有效率差异有统计学意义(P<0.05)。两组化疗严重化疗毒副作用的差异无统计学意义(P>0.05)。见表5。

表4 不同KRAS基因状态患者的化疗效果及化疗副作用情况 例(%)
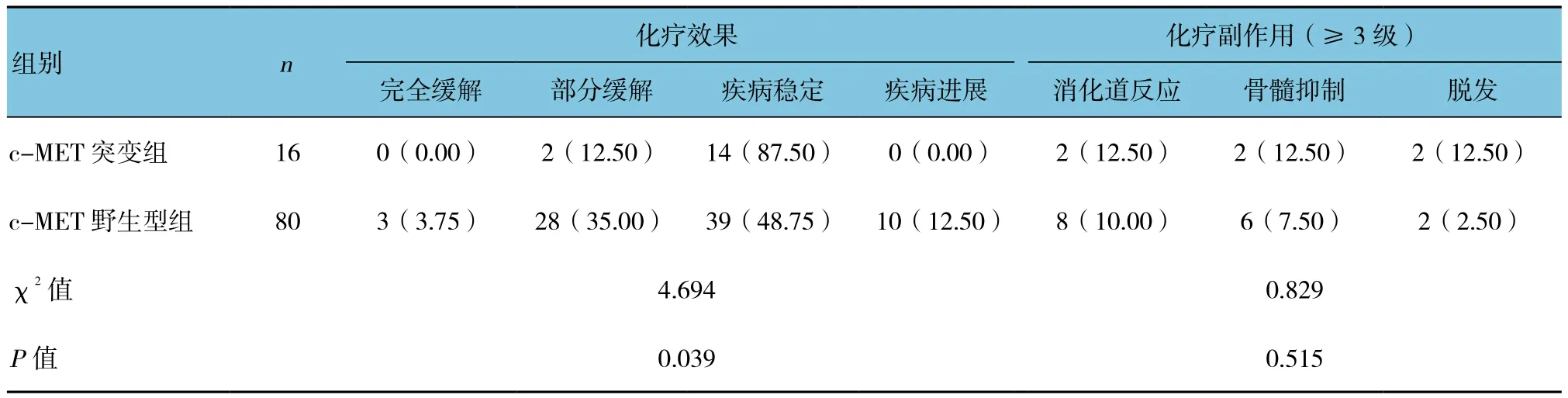
表5 不同c-MET基因状态患者的化疗效果及化疗副作用情况 例(%)
3 讨论
最新的统计数据显示,我国每年有约28万例新确诊的肺癌患者,其中很大部分为晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。针对晚期NSCLC治疗手段多选择含铂类药物的化疗,但化疗只有约20%的反应率和8~10个月的中位生存期。虽然研究众多,但是如何在治疗之前判断化疗受益的患者仍然是个难题。
分子遗传学研究进展让人们认识并尝试识别导致NSCLC的关键基因突变,也因此诞生了各种特异性的分子靶向药物。肺癌的组织亚型不同,治疗的方法也不同。非鳞状NSCLC患者使用培美曲塞+铂类效果优于吉西他滨+铂类。以肺腺癌为例,可以根据相关驱动基因突变进一步细分成亚群。常见的肺腺癌驱动基因包括EGFR、KRAS、人类表皮生长因子受体 2(human epidermal growth factor receptor-2,HER2)及MET基因突变和ALK等基因重排。驱动基因的表达存在组织学差异,相比腺癌,鳞状细胞癌中,EGFR基因突变非常罕见,多见成纤维细胞生长因子受体1的基因扩增,盘状结构域受体2基因突变和PI3KCA基因的扩增和突变。
在NSCLC的研究中,EGFR一直是一个热点。回顾性研究显示[15],亚裔女性的腺癌患者、既往少量/无吸烟史,EFGR突变率可达60%,使用EGFR TKI治疗的敏感率也高。18~21号外显子突变可编码出大量EGFR酪氨酸激酶,对初发的敏感性EGFR突变的NSCLC患者,应用TKI治疗在客观反应率(objective response rate,ORR)、无进展生存期(progression-free survival,PFS)和生活质量均优于化疗。因此,晚期NSCLC患者常规进行EGFR基因检测,可根据突变情况选择是否行EGFR TKI一线治疗。但随着临床观察的积累,人们发现,所有接受TKI治疗的患者最终会出现耐药,并导致肿瘤进展和死亡[16]。靶向治疗的进展开始围绕着解决耐药和寻找新的靶点展开。
EML4与ALK是分别位于人类2号染色体的p21和p23上的基因片段[6]。EML4与ALK是新发现的肺腺癌驱动基因。这2个基因片段的倒位融合能够使得组织表达新的融合蛋白EML4与ALK,这种融合基因能通过PI3K-AKT,丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)和 JAK-STAT 途径导致肿瘤的发生。这种突变仅占非小细胞肺癌的4%~7%。它更容易出现在既往少量/无吸烟史和年轻的腺癌患者身上。ALK抑制剂在临床Ⅲ期研究中[17],与化疗比较,对晚期NSCLC患者更受益,其可达56%。
MET是一种络氨酸激酶受体,它的过度激活与肿瘤发生、发展、预后与转归密切相关[7]。大约7%的NSCLC患者可出现MET的过表达。在一项克唑替尼治疗晚期非小细胞肺癌的研究表明,克唑替尼治疗MET高度过表达的患者,反应率可高达67%[18]。
KRAS是RAS家族的一员。KRAS基因突变能持续刺激细胞生长,阻止细胞死亡,从而导致肿瘤的发生。伴有KRAS基因突变的NSCLC患者会有更高的复发和转移概率。研究显示KRAS突变的概率在NSCLC患者为15%~25%,腺癌、吸烟史及白色人种是KRAS突变的危险因素[8]。虽然目前并未治疗KRAS基因突变的晚期非小细胞肺癌药物,但是人们研究重点集中在KRAS的下游通路上,如MEK。在一项临床研究中,口服的MEK抑制剂司美替尼(selumetinib)联合化疗用于经治的KRAS突变非小细胞肺癌患者。与单纯化疗比较,其(37%∶0%)、PFS(5.3个月∶2.1个月)、OS(9.4个月∶5.2个月)均有长足的进步[19]。
化疗可以干扰肿瘤驱动基因的表达状态,因此,在治疗过程中,应用靶向治疗与化疗的先后顺序如何确定成需要迫切解决的问题,以便使患者受益最大化。本研究显示,EGFR野生型患者化疗的反应性好于EGFR突变患者,肿瘤缩小的患者比例较多,虽然有许多报道显示化疗反应率在两组患者无差异,但患者的疾病无进展生存差异明显,说明EGFR突变与否影响化疗反应。笔者的数据进一步印证该现象,而笔者分析两组患者中出现严重化疗毒副作用的差异,统计显示,两组间为体现有差异,说明EGFR基因状态未影响机体对化疗的耐受能力。
从数据显示,EML4-ALK、KRAS、MET等基因的状态均影响患者的化疗效果。研究显示,KRAS的血清水平与胰腺癌的预后呈负相关[20],其机制和KRAS影响化疗反应相关,该结果似乎与笔者的数据不符,其原因可能是以KRAS基因状态为因素分组的例数过少导致结果出现的偏差,KRAS基因状态能否影响NSCLC的化疗反应有待进一步研究。同样的情况在本研究中也出现EML4-ALK组和MET组。
有意思的是,EML4-ALK、KRAS、MET等基因状态不同,其出现严重的化疗副作用的概率也不同,虽然因为例数过少可能导致数据偏移,但这仍需引起关注。分析NSCLC患者的血清基因状态与化疗反应的关系,有利于发现化疗受益的优势人群,以便患者最大受益。
