棉花中GhTFL1a和GhTFL1c基因的表达及启动子分析
2019-03-18张晓红胡根海王寒涛王聪聪魏恒玲付远志喻树迅
张晓红 胡根海 王寒涛 王聪聪 魏恒玲 付远志 喻树迅,*
棉花中和基因的表达及启动子分析
张晓红1胡根海1王寒涛2王聪聪2魏恒玲2付远志1喻树迅2,*
1河南科技学院生命科技学院 / 现代生物育种协同创新中心, 河南新乡 453003;2中国农业科学院棉花研究所 / 棉花生物学国家重点实验室, 河南安阳 455000
从陆地棉中克隆了磷脂酰乙醇胺结合蛋白和基因, 并对该基因进行表达分析、启动子预测和启动子活性研究。利用启动子分析软件PlantCARE预测得出,启动子区域有脱落酸响应元件、干旱诱导的MYB结合位点和顶芽特异表达响应元件等;启动子区域有乙烯响应元件、干旱诱导的MYB结合位点和水杨酸响应元件。因此, 将和分别构建到启动子检测载体pBI121-GUS上形成融合表达载体, 通过烟草瞬时转化检测得出这2个基因的启动子都具有活性。实时荧光定量PCR分析表明,和在光周期处理和不同材料的陆地棉(栽培种和半野生种)中表达模式呈相反趋势。基因受脱落酸(abscisic acid, ABA)、水杨酸(salicylic acid, SA)和盐胁迫诱导, 而可以响应赤霉素(gibberellin, GA)、SA和ABA胁迫研究结果初步表明,和可能参与了植物逆境胁迫脱落酸和水杨酸响应的调控, 为在棉花中进一步阐明其功能奠定了基础。
陆地棉;;; 表达分析; 启动子活性
棉花是我国最重要的经济作物之一, 在我国国民经济中占有举足轻重的地位。目前在棉花种植结构调整, 推进植棉全程机械化进程的大形势下, 早熟作为棉花育种的重要目标性状显得尤为重要[1]。开花是棉花由营养生长向生殖生长过渡的标志, 也是培育早熟棉的一个重要指标, 同时也是决定棉花能否获得丰产的重要农艺性状[2]。通过对花发育相关基因的功能分析, 进行棉花品种熟性分子改良, 对实现棉花机械化直播和采收具有重要意义。
磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine binding protein, PEBP)在原核生物和真核生物中均被发现[3-5],其氨基酸结构均有保守的磷脂酰乙醇胺结合蛋白结构域, 但是在原核生物和真核生物中仍然存在很大差异。TFL1 (TERMINAL FLOWER1)是磷脂酰乙醇胺结合蛋白中的一个亚组, 该亚组基因的功能大部分都集中在开花调控通路。在拟南芥中,()是TFL1亚组中的一个基因, 其功能主要表现在盐胁迫信号途径[6]。和()也是该亚组中的2个基因, 这2个基因在营养生长阶段顶芽中积累较少, 但是在开花之后其表达量急剧升高。拟南芥中通过维持茎顶端分生组织和花序分生组织的无限性, 延长植株的营养生长过程, 从而延迟植株的生殖生长进程[7]。Conti等[8]研究表明TFL1蛋白通过运输到达顶芽, 并且调控拟南芥的植株结构。同时, TFL1蛋白能抑制和基因的表达并且保持花序的无限生长[9]。对基因进行启动子结构的研究发现, 该基因是在营养器官的分生组织中表达来控制开花时间[10]。Liu等[11]在山茱萸中发现过表达转化拟南芥后, 拟南芥开花时间推迟, 植株高度增加, 顶端花芽和次生花序分枝增多。Rantanen等[12]发现在温度和光周期的互作下, 林地草莓中基因能适时调控开花时间。Si等[13]研究发现陆地棉基因与果枝形成发育相关, 但是棉花中该基因的启动子分析还无报道。
本研究依据棉花基因组测序结果[14-15], 克隆到和基因及其启动子, 同时进行光周期、激素和胁迫处理分析其表达模式, 并分析其启动子活性, 旨在摸清和表达调控的分子机制, 从而为棉花分子改良提供理论依据。
1 材料与方法
1.1 试验材料
选用陆地棉栽培种“中棉所36”和半野生种“尖斑棉”。试验所用到的DNA聚合酶、反转录酶、pMD18-T载体、质粒提取试剂盒、胶回收试剂盒和荧光定量试剂盒均购自Takara公司, RNA提取试剂盒购自天根公司, 大肠杆菌感受态DH5a、pBI121载体及农杆菌LBA4404由本实验室制备并保存。
1.2 材料处理及取样
用于光周期处理试验的材料种植于中国农业科学院棉花研究所早熟组人工气候培养室, 栽培种为“中棉所36”和半野生种为“尖斑棉”, 培养条件为长日照, 等到二叶展平时期, 短日照处理一周, 并将处理过后的棉花分两批继续培养, 一批为长日照(14 h/10 h 光照/黑暗, 光照时间为8:00–22:00), 另一批为短日照(10 h/14 h 光照/黑暗, 光照时间为8:00–18:00), 温度都为28℃, 取样时期分别于子叶展平期到五叶展平期, 取样后快速放入液氮中冷冻并存于-80℃冰箱中备用。激素处理所用材料为“中棉所36”水培材料, 室内种植条件为14 h光照/10 h黑暗, 温度为26℃。于三叶期水培液中增加激素和胁迫处理, 以清水为对照。所用SA浓度为200 µmol L–1, ABA和GA浓度为100 µmol L–1, 处理后的1、3、7、12和24 h时间段进行根部取样, 选取10株左右水培苗剪下幼嫩根部, 吸取根部水分后液氮冷冻并置-80℃冰箱备用, 试验重复3次, 利用GraphPad Prism 5软件作图及统计分析。
1.3 GhTFL1a和GhTFL1c的生物信息学分析
研究中所用到的氨基酸序列下载自NCBI网站, 使用ClustalX2软件多重序列比对, 使用MEGA6.06最大似然法构建进化树。利用ExPASy网站上的Compute pI/Mw (http://web.expasy.org/compute_pi/)对其蛋白质的理化性质进行预测和分析, 并用NCBI的CDD (https://www.ncbi. nlm.nih.gov/Structure/cdd/cdd.shtml)数据库对其结构域进行预测。用PlantCARE (http://bioinformatics.psb.ugent.be/ webtools/plantcare/html/)预测启动子区域顺式作用元件。
1.4 基因的定量表达分析
RNA用天根多糖多酚RNA提取试剂盒提取, RNA的质量必须保证OD260/280为1.8~2.1, OD260/230大于1.8。用Takara RR047A试剂盒反转录, 使用gDNA Eraser消化总RNA中残留的基因组DNA后进行15 min的反转录反应合成cDNA。使用Takara RR420A试剂盒及SYBR Green分析荧光定量, 所用仪器为Applied Biosystems Q6实时荧光定量PCR仪。陆地棉中以为内参。所用引物见表1。
1.5 GhTFL1a和GhTFL1c启动子克隆和瞬时表达
利用Perl语言编写的脚本, 从陆地棉基因组中获取和基因上游约2000 bp的序列, 根据启动子顺式作用元件预测结果设计引物(表1), 从翻译起始位点(ATG)上游开始, 以中棉所36基因组为模板, 克隆启动子片段。使用 Infusion 连接酶(宝生物, 大连)与载体pBI121连接启动子片段, 双酶切位点是d III和I, 将和构建到启动子检测载体pBI121-GUS上形成融合表达载体, 将连接后新鲜菌液送金唯智生物科技有限公司测序, 并保存测序正确的单克隆菌液以供后续试验使用。本氏烟草()按照Sparkes等[16]的方法种植和瞬时表达。

表1 本研究所用引物
1.6 GUS染色
取瞬转后的烟草叶片组织, 加入GUS染色液, 37℃培养箱中温育过夜24 h。接着, 依次用体积分数为70%、80%、90%和无水乙醇脱色。最后, 在体式显微镜(SOPTOP, SZN)下观察组织的染色情况并照相。
2 结果与分析
2.1 陆地棉GhTFL1a和GhTFL1c的序列分析
基因位于陆地棉A亚组第11染色体上, 编码框长522 bp, 编码氨基酸长度为173 aa。经ExPASy网站预测知, 其编码蛋白质约为19.3 kDa, 等电点为9.68。基因位于D亚组第4染色体上, 编码框长519 bp, 编码氨基酸长度为172 aa, 编码蛋白质约为19.1 kDa, 等电点为8.09。进化树分析结果表明,和分别与拟南芥中的和亲缘关系相近(图1-A), 根据TAIR网站提供的拟南芥氨基酸序列进行序列比对, 氨基酸序列具有比较保守的磷脂酰乙醇胺结合蛋白结构域(图1-B)。
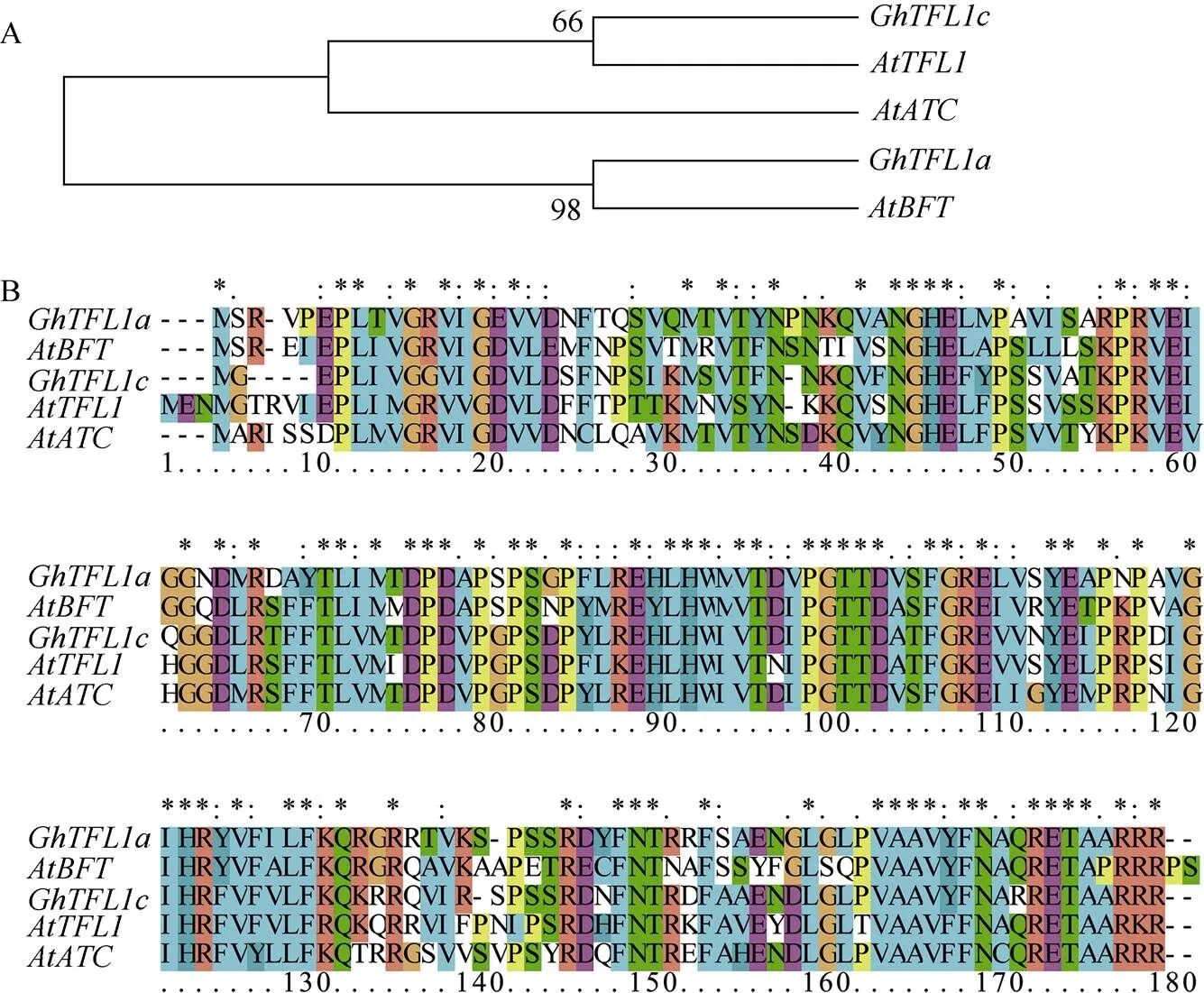
图1 GhTFL1a和GhTFL1c的进化树及氨基酸多重序列比对
A: 进化树分析; B: 氨基酸多重序列比对。*代表氨基酸完全一致,、和序列号分别为NM_125597、U77674和NM_128315,和在陆地棉中序列号分别为Gh_A11G0088和Gh_D04G0971。
A: phylogentic analysis of/and their homologous genes in; B: alignment of amino acid sequences of/and their homologous genes in. * indicates the same amino acid, the ID of,, andis NM_125597, U77674, and NM_128315, respectively, the ID ofandis Gh_A11G0088 and Gh_D04G0971, respectively.
2.2 苗期叶片中GhTFL1a和GhTFL1c基因的表达模式分析
为研究和是否受光周期影响, 利用光周期试验处理半野生种和栽培种材料, 对不同时期幼苗叶片取样分析表明,和在半野生种及栽培种陆地棉中表达趋势一致,表达在长日照下明显高于短日照下(图2-A和图2-C), 而三叶期的表达量在短日照下高于长日照下, 随后表达量逐渐降低并低于长日照下(图2-B和2-D)。同时, 对这2个基因在栽培种棉和半野生棉中的表达模式进行分析发现,在半野生棉中表达量高于栽培棉(图3-A), 而在栽培棉中表达量高于半野生棉(图3-B)。说明从半野生种棉到栽培种棉的进化过程中, 光照条件从短日照促进开花基因的表达向光照不敏感转化, 同时在光周期的影响下,和可能具有相反的生物学功能, 仍需对多个栽培种和半野生种材料进行后续验证。
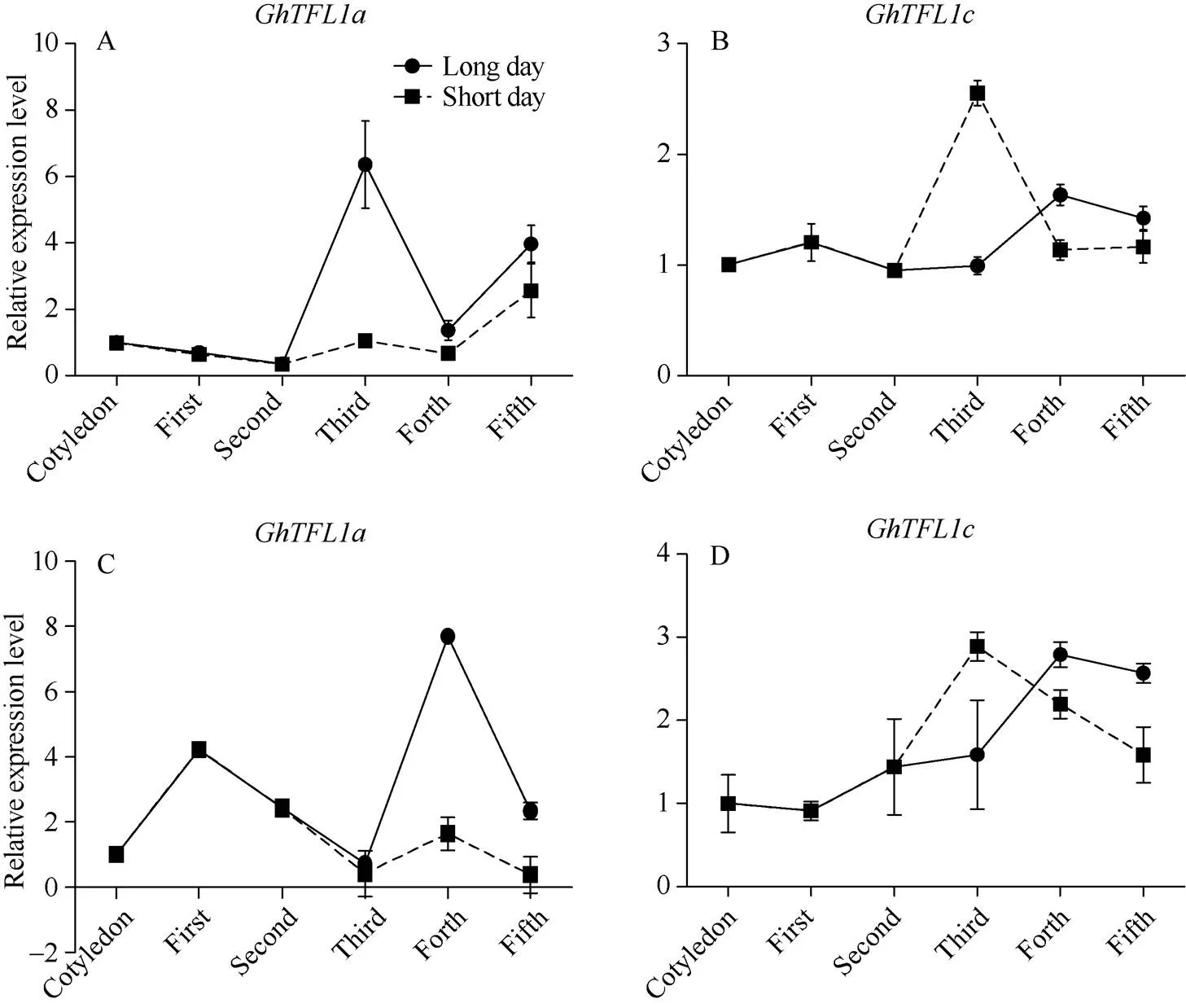
图2 GhTFL1a和GhTFL1c在光周期处理试验中的表达模式分析
A和B为和基因在栽培种“中棉所36” 中的表达; C和D为和基因在半野生种“尖斑棉”中的表达。误差棒为3次重复的标准差。
A and B indicate the expression ofandin cotton cultivar “CCRI 36”; C and D indicate the expression ofandin semi-wild cotton. Error bars indicate the standard deviation (±SD).

图3 GhTFL1a和GhTFL1c在栽培种和半野生种中表达模式分析
横坐标代表取样时期, 分别为长日照子叶、一叶、二叶、三叶、四叶、五叶以及短日照三叶、四叶和五叶。
The abscissa shows period, which from left to right is expanded cotyledon, first, second, third, forth, and fifth leaves in long day, and third, forth and fifth leaves in short day.
2.3 GhTFL1a和GhTFL1c的启动子分析及其对外源激素的应答
该基因拥有磷脂酰乙醇胺结合蛋白的保守结构域, 因此分析启动子的顺式作用元件对于揭示和的功能是非常必要的。从中棉所陆地棉基因组数据库中获取和基因起始密码子上游2000 bp的序列, 并利用PlantCARE数据库对其顺式作用元件进行了预测。结果如表2所示。这2个基因的启动子上主要存在两大类顺式作用元件, 一类是光响应元件和生物钟节律响应元件, 一类是胁迫响应元件, 如与胁迫相关的水杨酸、脱落酸和干旱胁迫等元件。已知GA是一种能促进种子发芽、植物生长和提早开花的生长调节剂, 而ABA、SA和盐胁迫都是与植物逆境和胁迫响应相关的因素。

表2 陆地棉基因GhTFL1a和GhTFL1c启动子顺式作用元件预测
利用棉花水培方法来研究和在激素和胁迫处理下的应答模式。经SA处理3 h后的表达量开始升高, 12 h到达峰值, 表达量约是对照组的32倍(图4-A)。经ABA处理3 h后处理组中的表达量开始升高, 7 h达到最大值, 随后下降(图4-B)。经GA处理后,的表达量与对照相比没有显著的倍数差异(图4-C)。NaCl处理后,的表达量在3 h和12 h出现峰值(图4-D)。以上结果表明, SA、ABA和盐胁迫都可以显著促进陆地棉中的表达, 而GA对的转录无明显作用,可以响应SA、ABA和盐胁迫。经SA处理后,的表达量一直在降低, 到12 h表达量降到最低点, 对照组中表达量约是该基因表达量的26倍(图5-A)。经ABA处理3 h后处理组中的表达量开始下降, 7 h达到最小值, 随后上升(图5-B)。经GA处理后,的表达量开始上升, 3 h后表达开始下降(图5-C)。NaCl处理后,的表达量与对照相比没有明显的倍数差异(图5-D)。SA、ABA和GA处理后,的表达量都比对照低。以上结果表明, SA、ABA和GA都可以抑制陆地棉中的表达, 而盐胁迫对的转录无明显作用,可以响应SA、ABA和GA胁迫。

图4 棉花水培苗经过处理后24 h内GhTFL1a基因表达量变化
A: 水杨酸; B: 脱落酸; C: 赤霉素; D: NaCl。误差棒为3次重复的标准差。
A: salicylic acid; B: gibberellins; C: abscisic acid; D: NaCl. Error bars on the columns indicate the standard deviation (±SD).
2.5 GhTFL1a和GhTFL1c的启动子活性分析
对和的启动子进行克隆, 得到基因启动子全长1558 bp,基因启动子全长1631 bp。以烟草瞬时表达分析启动子活性表明,和基因的启动子都具有启动活性, 与阳性对照pBI121相比, 活性较弱(图6)。

图5 棉花水培苗经过处理后24小时内GhTFL1c基因表达量变化
A: 水杨酸; B: 赤霉素; C: 脱落酸; D: NaCl。误差棒为3次重复的标准差。
A: salicylic acid; B: gibberellins; C: abscisic acid; D: NaCl; Error bars indicate the standard deviation (±SD).

图6 烟草瞬时表达GhTFL1a和GhTFL1c的启动子
A: 阳性对照pBI121; B: pGhTFL1a∷GUS; C: pGhTFL1c∷GUS; D: 阴性对照。
A: positive control pBI121; B: pGhTFL1a∷GUS; C: pGhTFL1c∷GUS; D: negative control.
3 讨论
开花是陆地棉的重要农艺性状之一。花期的早晚影响产量, 也影响品种的区域适应性。虽然开花是一个由多基因控制的数量性状, 经典遗传学研究也表明许多开花相关的基因符合孟德尔遗传定律[17]。陆地棉全基因组测序的完成对深入研究目标性状的遗传控制具有重要的意义和推动作用[14-15]。
近年来, 对棉花开花相关基因的克隆及功能研究较多[18-20], 而针对开花基因的启动子的结构分析和蛋白表达调控等研究较少。本研究从陆地棉基因组数据库中共检 索到4条亚组基因, 并对其中的和进行表达调控、启动子结构和活性分析。启动子顺式作用元件预测出和启动子区域不仅包括基本的调控元件, 还包含许多与光、生物钟、植物激素和逆境响应相关的调控元件。在植物的生长发育过程中, 光周期是一种重要的信号途径来调控开花相关基因的表达[21-22]。本研究利用光周期对不同材料的陆地棉(栽培种和半野生种)处理发现和在半野生种及栽培种陆地棉中表达趋势一致, 这也说明从半野生种棉到栽培种棉的进化过程中, 光照条件从短日照促进开花基因的表达向光照不敏感转化。Zhang等[23]研究表明和在根中优势表达, 我们根据启动子区域的调控元件选择了几种激素和胁迫对棉花的水培苗进行处理, 并对这2个基因表达模式分析表明SA、ABA和盐胁迫都可以促进陆地棉中的表达,与拟南芥中的亲缘关系相近, 在高盐胁迫下,基因通过介导FT-FD模型来提供合适的保护机制适应光周期途径并促使开花[24]。由此推测可能参与盐胁迫响应的调控通路。而陆地棉中与拟南芥中亲缘关系相近, 该基因的表达在SA和GA处理下受到抑制。同时,和基因启动子在烟草瞬时表达中具有活性。上述试验处理都呈现出和在表达分析上是一种相反的表达模式, 这种结果是否可以推测2个基因具有相反的生物学功能, 还需要进一步通过转基因对其进行验证, 并通过对转基因后代植株的胁迫处理来分析; 同时启动子分析试验表明这2个基因的启动子都具有活性, 后期还需在拟南芥中进行表达部位的验证来确定其是专化性抑或是组成性启动子, 这样才能进一步深入掌握和基因及其启动子的功能。
[1] 董承光, 王娟, 周小凤, 马晓梅, 李生秀, 王旭文, 肖光顺, 李保成. 新疆早熟陆地棉早熟性状的遗传分析西北农业学报, 2014, 23(12): 96–101. Dong C G, Wang J, Zhou X F, Ma X M, Li S X, Wang X W, Xiao G S, Li B C. Inheritance of earliness traits in xinjiang early-maturity upland cotton (.L.)., 2014, 13(12): 96–101 (in Chinese with English abstract).
[2] 喻树迅, 王寒涛, 魏恒玲, 宿俊吉. 棉花早熟性研究进展及其应用棉花学报, 2017, 29: 1–10. Yu S X, Wang H T, Wei H L, Su J J. Research progress and application of early maturity in upland cotton., 2017, 29: 1–10 (in Chinese with English abstract).
[3] Chautard H, Jacquet M, Schoentgen F, Bureaud N, Benedetti H. Tfs1p, a member of the PEBP family, inhibits the Ira2p but not the Ira1p Ras GTPase-activating protein in Saccharomyces cerevisiae, 2004, 3: 459–470.
[4] Hengst U, Albrecht H, Hess D, Monard D. The phosphatidylethanolamine-binding protein is the prototype of a novel family of serine protease inhibitors, 2001, 276: 535–540.
[5] Banfield M J, Barker J J, Perry A C, Brady R L. Function from structure? The crystal structure of human phosphatidylethanolamine–binding protein suggests a role in membrane signal transduction, 1998, 6: 1245–1254.
[6] Ryu J Y, Park C M, Seo P J. The floral repressor BROTHER OF FT AND TFL1 (BFT) modulates flowering initiation under high salinity in, 2011, 32: 295–303.
[7] Hanzawa Y, Money T, Bradley D. A single amino acid converts a repressor to an activator of flowering, 2005, 102: 7748–7753.
[8] Conti L, Bradley D. TERMINAL FLOWER1 is a mobile signal controllingarchitecture, 2007, 19: 767–778.
[9] Hanano S, Goto K.TERMINAL FLOWER1 is involved in the regulation of flowering time and inflorescence development through transcriptional repression, 2011, 23: 3172–3184.
[10] Serrano-Mislata A, Fernandez–Nohales P, Domenech M J, Hanzawa Y, Bradley D, Madueno F. Separate elements of the TERMINAL FLOWER 1-regulatory region integrate pathways to control flowering time and shoot meristem identity, 2016, 143: 3315–3327.
[11] Liu X, Zhang J, Abuahmad A, Franks R G, Xie D Y, Xiang Q Y. Analysis of two TFL1 homologs of dogwood species (L.) indicates functional conservation in control of transition to flowering, 2016, 243: 1129–1141.
[12] Rantanen M, Kurokura T, Jiang P, Mouhu K, Hytonen T. Strawberry homologue of terminal flower1 integrates photoperiod and temperature signals to inhibit flowering, 2015, 82: 163–173.
[13] Si Z F, Liu H, Zhu J K, Chen J D, Wang Q, Fang L, Gao F K, Tian Y, Chen Y L, Chang L J, Liu B L, Han Z G, Zhou B L, Hu Y, Huang X Z, Zhang T Z. Mutation of SELF-PRUNING homologs in cotton promotes short-branching plant architecture, 2018, 69: 2543–2553.
[14] Li F G, Fan G Y, Lu C R, Xiao G H, Zou C S, Kohel R J, Ma Z Y, Shang H H, Ma X F, Wu J Y, Liang X M, Huang G, Percy R G, Liu K, Yang W H, Chen W B, Du X M, Shi C C, Yuan Y L, Ye W W, Liu X, Zhang X Y, Liu W Q, Wei H L, Wei S J, Huang G D, Zhang X L, Zhu S J, Zhang H, Sun F M, Wang X F, Liang J, Wang J H, He Q, Huang L H, Wang J, Cui J J, Song G L, Wang K B, Xu X, Yu J Z, Zhu Y X, Yu S X. Genome sequence of cultivated upland cotton (TM-1) provides insights into genome evolution, 2015, 33: 524–530.
[15] Zhang T Z, Hu Y, Jiang W K, Fang L, Guan X Y, Chen J D, Zhang J B, Saski C A, Scheffler B E, Stelly D M, Hulse-Kemp A M, Wan Q, Liu B L, Liu C X, Wang S, Pan M Q, Wang Y K, Wang D W, Ye W X, Chang L J, Zhang W P, Song Q, Kirkbride R C, Chen X Y, Dennis E, Llewellyn D J, Peterson D G, Thaxton P, Jones D C, Wang Q, Xu X Y, Zhang H, Wu H T, Zhou L, Mei G F, Chen S Q, Tian Y, Xiang D, Li X H, Ding J, Zuo Q Y, Tao L N, Liu Y C, Li J, Lin Y, Hui Y Y, Cao Z S, Cai C P, Zhu X F, Jiang Z, Zhou B L, Guo W Z, Li R Q, Chen Z J. Sequencing of allotetraploid cotton (L. acc. TM-1) provides a resource for fiber improvement, 2015, 33: 531–537.
[16] Sparkes I A, Runions J, Kearns A, Hawes C. Rapid, transient expression of fluorescent fusion proteins in tobacco plants and generation of stably transformed plants, 2006, 1: 2019–2025.
[17] Hori K, Matsubara K, Yano M. Genetic control of flowering time in rice: integration of Mendelian genetics and genomics, 2016, 129: 2241–2252.
[18] 东锐, 院海英, 顾超, 郑银英, 黄先忠, 崔百明. 棉花基因的克隆及初步功能分析棉花学报, 2011, 23: 515–521. Dong R, Yuan H Y, Gu C, Zheng Y Y, Huang X Z, Cui B M. Cloning and primary analysis of the function ofgene in cotton (L.)., 2011, 23: 515–521 (in Chinese with English abstract).
[19] 吴嫚, 范术丽, 宋美珍, 庞朝友, 喻树迅. 棉花基因的克隆与表达分析棉花学报, 2010, 22: 387–392. Wu M, Fan S L, Song M Z, Pang C Y, Yu S X. Cloning and expression analysis ofgene inL., 2010, 22: 387–392 (in Chinese with English abstract).
[20] 张文香, 庞朝友, 范术丽, 宋美珍, 魏恒玲, 喻树迅. 棉花基因的克隆与表达分析安徽农业科学, 2015, 43(15): 28–31. Zhang W X, Pang C Y, Fan S L, Song M Z, Wei H L, Yu S X. Molecular cloning and expression analysis of SVP-like genefromL., 2015, 43(15): 28–31 (in Chinese with English abstract).
[21] Jeong S, Clark S E. Photoperiod regulates flower meristem development in, 2005, 169: 907–915.
[22] Mengin V, Pyl E T, Alexandre M T, Sulpice R, Krohn N, Encke B, Stitt M. Photosynthate partitioning to starch inis insensitive to light intensity but sensitive to photoperiod due to a restriction on growth in the light in short photoperiods, 2017, 40: 2608–2627.
[23] Zhang X H, Wang C C, Pang C Y, Wei H L, Wang H T, Song M Z, Fan S L, Yu S S. Characterization and functional analysis of PEBP family genes in upland cotton (L.), 2016, 11: e0161080.
[24] Ryu J Y, Lee H J, Seo P J, Jung J H, Ahn J H, Park C M. Thefloral repressor BFT delays flowering by competing with FT for FD binding under high salinity, 2014, 7: 377–387.
Expression and promoter activity ofandin Upland cotton
ZHANG Xiao-Hong1, HU Gen-Hai1, WANG Han-Tao2, WANG Cong-Cong2, WEI Heng-Ling2, FU Yuan-Zhi1, and YU Shu-Xun2,*
1College of Life Science and Technology, Henan Institute of Science and Technology / Henan Collaborative Innovation Center of Modern Biological Breeding, Xinxiang 453003, Henan, China;2Institute of Cotton Research, Chinese Academy of Agricultural Sciences / State Key Laboratory of Cotton Biology, Anyang 455000, Henan, China
In this study, we cloned the phosphatidylethanolamine-binding proteinandgenes from Upland cotton, and analyzed their expression and promoter activity. The results of promoter structure prediction revealed thatpromoter contains abscisic acid (ABA) responsiveness elements, drought-induced MYB binding sites and shoot-specific expression and light responsiveness elements, and the promoter region ofcontains ethylene-responsive element, drought-induced MYB binding sites and salicylic acid (SA) responsiveness elements. Thus, we constructed the fusion vector pBI121-GhTFL1a-GUS and pBI121-GhTFL1c-GUS, respectively. Transient transformation of tobacco showed that both promoters had the activity to drive the expression of target gene. Quantitative Real-time PCR result indicated that the expression profile ofandwas opposite during different photoperiod treatments of cultivated and semi-wild cotton. Meanwhile, theexpression ofwas induced by ABA, SA, and salt (NaCl), whileexpression was induced by SA, gibberellin (GA) and ABA. Taken together, the results suggest thatandmight be involved in the regulation of response to abiotic stresses (SA and ABA), which could provide a solid foundation for further function identification.
upland cotton;;; expression analysis; promoter activity
2018-06-20;
2018-12-24;
2019-01-04.
10.3724/SP.J.1006.2019.84082
喻树迅, E-mail: ysx195311@163.com
E-mail: 12-126meinv@163.com
本研究由河南省高等学校重点科研项目(18A210002)和棉花生物学国家重点实验室开放课题基金(CB2018A08)的资助。
This study was supported by the Key Scientific Research Projects of Colleges and Universities in Henan (18A210002) and the State Key Laboratory of Cotton Biology Open Fund (CB2018A08).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20181230.2243.008.html
