沉默肌球蛋白轻链9基因对非小细胞肺癌H1299细胞株增殖及迁移的影响▲
2019-03-15覃聪昕王永勇梁冠标陈铭伍
覃聪昕 谭 翔 王永勇 戴 磊 梁冠标 陈铭伍
(广西医科大学第一附属医院心胸外科,南宁市 530021,电子邮箱:congxin2000@126.com)
肺癌是我国发病率和死亡率较高的恶性肿瘤。肺癌在男性恶性肿瘤中的发病率和死亡率均居第一位,在女性恶性肿瘤中的发病率居第二位,但死亡率居第一位。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的组织类型,占80%~85%,且发现时患者病情多处于晚期。尽管近年来肺癌的诊断和治疗手段取得了一定进展,但其5年生存率仍低于20%[2]。目前临床治疗肺癌的方法主要有手术、化疗、放疗、靶向治疗等。近年来,靶向治疗在肺癌特别是NSCLC上有重大突破,与传统肿瘤治疗药物比较,其对肿瘤细胞的针对性及杀伤力更强,而毒副作用较少,是目前研究NSCLC治疗药物的热点。
我们在前期研究中发现肌球蛋白轻链9(myosin light chain 9,MYL9)基因与NSCLC的发生和转移相关,并且运用基因富集等生物信息学方法对基因芯片数据库进行筛选,发现MYL9基因是与NSCLC发生、发展密切相关的关键基因之一[3],但其作用机制尚未完全明确。本研究应用RNA干扰技术沉默NSCLC H1299细胞株中的MYL9基因,探讨沉默MYL9基因对H1299细胞株增殖及迁移的影响,拟为肺癌的治疗提供新靶点。
1 材料与方法
1.1 主要材料 NSCLC H1299细胞株购自中科院上海细胞库;含pSLLV-U6-zsGreen-puro-MYL9和pSLLV-U6-zsGreen-puro-NC的短发夹RNA(short hairpin RNA,shRNA)慢病毒由赛澜公司构建并包装;RPMI 1640培养基(批号:8116498)、胰酶(批号:1748050)、胎牛血清(批号:42Q9462K)购于Gibco公司;青-链霉素混合液(批号:NO.20170627)、四甲基偶氮唑盐(methylthiazolyl tetrazolium,MTT)(批号:NO.303HC610)、嘌呤霉素(批号:NO.724H043)购自北京索莱宝公司;总RNA提取试剂盒(批号:AK1301)、反转录试剂盒(批号:AK4602)及cDNA扩增试剂盒(批号:AK9506)购自日本TaKaRa公司;PCR引物由北京擎科生物技术有限公司合成(甘油醛-3-磷酸脱氢酶上游5′-CTCAGACAC CATGGGGAAGGTGA-3′,下游5′-ATGATCTTGAGGCTGTTGTCATA-3′;MYL9上游5′-TCTTCGCAATGTTTGACCAGT-3′,下游5′-GTTGAAAGCCTCCTTAAACTCCT-3′)。
1.2 实验方法
1.2.1 细胞培养:H1299细胞株用含有10%胎牛血清和1%青-链霉素的RPMI 1640培养基于37℃、5%CO2、饱和湿度的细胞培养箱中常规培养,每2~3 d传代或换液。转染含pSLLV-U6-zsGreen-puro-MYL9的慢病毒的细胞为敲减组(KD 组),同时设立转染含pSLLV-U6-zsGreen-puro-NC的空载慢病毒的细胞为阴性对照组(NC组),以及不进行转染操作的H1299细胞为对照组(CON组)。
1.2.2 慢病毒转染及构建细胞稳定株:用胰酶消化处于对数生长期的H1299细胞后,制成细胞悬液,按1.0×105个/孔接种于6孔板中,于37℃、5%CO2细胞培养箱培养,待第2天细胞融合度达到30%~50%时,换含1/2体积含合适浓度聚凝胺的完全培养基,根据预实验得出的病毒感染复数加入适量慢病毒,4 h后补齐培养基继续培养,加入慢病毒24 h后换用新鲜完全培养基培养。用荧光显微镜观察到细胞显示绿色荧光后换用含1μg/ml嘌呤霉素的完全培养基继续培养9~14 d并进行筛选,获得稳定细胞株。荧光显微镜下观察细胞的感染效率转染情况并拍照,转染效率=(荧光视野下细胞数/普通光视野下细胞数)×100%。
1.2.3 实时荧光定量PCR检测MYL9 mRNA表达情况:根据总RNA提取试剂盒操作说明书提取3组细胞总RNA并检测其浓度与纯度,然后按反转录试剂盒说明书进行反转录合成cDNA。各组行特定引物PCR扩增,采用20 μl反应体系:SYBR® Premix Ex Taq Ⅱ(2×)10 μl,上、下游引物各0.8 μl,ROX Reference DyeⅡ 0.4 μl,DNA模板2 μl,灭菌水6 μl。混匀后于0℃、1 000 r/min离心1 min。扩增条件:95℃预变性30 s,95℃ 5 s,60℃ 34 s,40个PCR循环,应用Applied Biosystems公司7500型实时荧光PCR系统进行分析。采用2-△△Ct法计算各组MYL9的mRNA相对表达量。实验重复3次,取平均值。
1.2.4 MTT法检测细胞增殖能力:取对数生长期细胞,用胰酶消化各组细胞并重悬,以1×103个/孔接种到96孔板中,每孔培养基量为200 μl,设5个复孔,边缘孔用无菌磷酸缓冲盐(phosphate-buffered saline,PBS)溶液填充,于37℃、5%CO2的细胞培养箱中培养,分别于培养 24 h、48 h、72 h、96 h、120 h后在光学显微镜下观察各组细胞的生长情况,每孔加入MTT溶液(5 mg/ml)25 μl,继续常规培养4 h后终止培养,小心吸除孔内培养液,每孔加入二甲基亚砜溶液150 μl,将培养板置于震荡仪上低速振荡10 min,充分溶解结晶物。采用酶标仪测量各组490 nm波长的吸光度值(A值),取各平行孔A值平均值并记录结果;以时间为横轴、A值为纵轴,绘制细胞的生长曲线,观察细胞生长情况。实验重复3次。
1.2.5 划痕实验检测细胞迁移能力:取对数生长期细胞,采用胰酶消化各组细胞后制成细胞悬液,各组细胞按5×105个/孔接种于6孔板内,每孔培养基量为2 ml,待细胞过夜贴壁后使用黄色枪头比着直尺在细胞中垂直划线形成划痕,PBS溶液轻柔洗除漂浮细胞,每孔重新加入无血清的培养基后继续培养。分别于培养0 h、24 h、48 h后用Olympus显微镜拍照记录划痕区域的变化。采用Image J软件测量图片划痕区域面积。划痕愈合率=(0 h划痕面积-各时相点划痕面积)/0 h划痕面积×100%。实验重复3次,取平均值。
1.3 统计学分析 采用SPSS 20.0统计软件。计量资料用(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
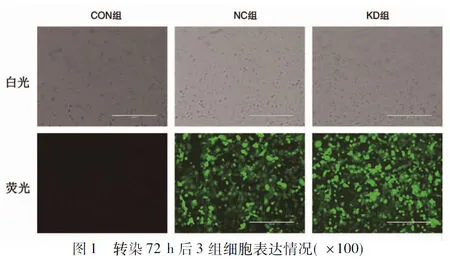
2.1 慢病毒转染细胞情况 在荧光显微镜观察下,CON组未见绿色荧光蛋白表达,NC组与KD组均见绿色荧光蛋白表达,且转染72 h后平均转染效率达90%以上,见图1。
2.2 3组细胞MYL9基因mRNA相对表达水平比较 CON组、NC组、KD组细胞MYL9基因的mRNA相对表达水平依次为(1.04±0.07)、(0.98±0.03)、(0.38±0.05),差异有统计学意义(F=138.207,P<0.001),其中KD组MYL9的mRNA相对表达水平均低于CON组与NC组(均P<0.05),CON组与NC组MYL9的mRNA相对表达水平比较差异无统计学意义(P>0.05)。
2.3 3组细胞增殖能力比较 3组细胞的A值比较,差异有统计学意义(F组间=531.123,P组间<0.001);3组细胞的A值均有随时间变化的趋势(F时间=6 628.444,P时间<0.001);分组与时间存在交互效应(F交互=321.457,P交互<0.001)。3组细胞在培养24 h、48 h、72 h、96 h、120 h时的A值比较,差异均有统计学意义(均P<0.05),其中KD组各时点的A值均低于CON组与NC组(均P<0.05)。除24 h外,NC组其余时点A值均低于CON组(均P<0.05)。见表1。
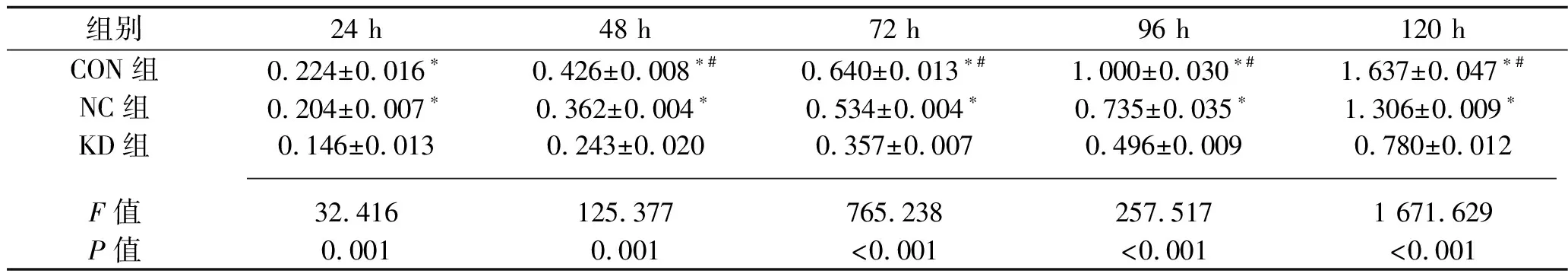
表1 3组细胞不同时点A值的比较(x±s)
注: 与KD组比较,*P<0.05;与NC组比较,#P<0.05。
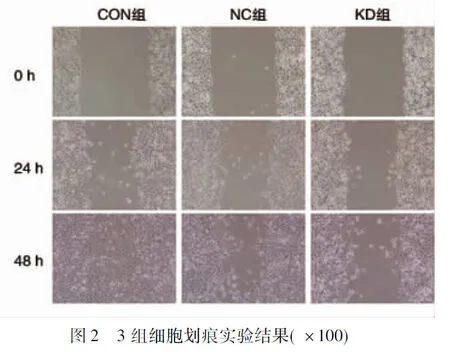
2.4 3组细胞迁移能力比较 CON组、NC组、KD组在24 h的划痕愈合率分别为(33.98±0.89)%、(21.68±1.12)%、(8.47±2.01)%,48 h的划痕面积愈合率分别为(83.75±3.25)%、(82.51±13.64)%、(28.43±2.12)%,差异均有统计学意义(F=240.545,P<0.001;F=44.658,P<0.001),其中KD组24 h、48 h划痕愈合率均低于CON组与NC组(均P<0.05),NC组与CON组划痕愈合率比较,差异均无统计学意义(均P>0.05),见图2。
3 讨 论
MYL9基因位于人类染色体20q11.23上,编码的MYL9为肌球蛋白的重要组成部分。肌球蛋白广泛参与各种细胞的生物学活动,如细胞分泌、信号转导、细胞迁移、物质转运、胞质流动、有丝分裂和基因转录等,被称为细胞骨架的分子“马达”[4]。肌球蛋白Ⅱ是一个由两条重链和两组成对轻链组成的六聚体,其活性主要通过MYL9基因进行转录后磷酸化而调节,肌球蛋白Ⅱ被MYL9激活后,收缩性加强,并向细胞黏附的位点传导。Licht等[5]研究发现,Junb基因缺失的细胞其运动和收缩能力明显减弱,Junb基因重新表达可使细胞的MYL9表达上调从而使细胞恢复运动和收缩能力。研究表明,MYL9的表达依赖心肌相关转录因子和血清反应因子,是维持细胞骨架动力学和迁移的必需条件,也是尖端细胞和巨核细胞迁移的所需条件[6-8]。MYL9活性受肌球蛋白调节轻链激酶或Rho相关卷曲螺旋形成蛋白激酶(Rho associated coiled coil forming protein kinase,ROCK)正性调节,受肌球蛋白调节轻链磷酸酶负性调节[9-10]。
肿瘤细胞的增殖与扩散是复杂的、多因素相互作用的过程,目前主要认为受细胞表面受体、肌动蛋白细胞骨架的运动性和肿瘤微环境共同作用影响[11]。肿瘤细胞增殖与扩散的前提是自身运动能力的增强。丝氨酸-19使MYL9磷酸化从而增强肌球蛋白ATP酶的活性,激活肌球蛋白Ⅱ,改变细胞骨架结构,使细胞与细胞之间以及细胞与细胞外基质之间的黏附减少,并导致细胞变形和收缩,推动细胞向前运动,最终促成肿瘤细胞向远处转移[12]。同时,肿瘤细胞的有丝分裂依赖细胞骨架结构的改变,MYL9的磷酸化可以影响细胞骨架结构的变化,从而促进肿瘤细胞的有丝分裂,进而影响细胞的增殖[13]。MYL9在正常组织及肿瘤组织中均有表达,如肌肉组织、内脏组织、肺癌组织、前列腺癌等组织[14]。有研究表明,MYL9的表达上调和磷酸化作用可以促进癌细胞生长及转移,肝癌细胞通过ROCK基因表达的下调降低MYL9的磷酸化,抑制细胞骨架改变从而抑制肝癌细胞的转移[15]。有学者发现,DEK原癌基因表达的下调或可通过Rho/ROCK/MYL9通路降低MYL9的磷酸化作用从而抑制肺癌细胞的迁移能力[16]。另外,肺癌组织中MYL9的表达增高与NSCLC病理分期及淋巴结转移呈正相关[3]。Luo等[17]发现,MYL9的表达上调可增强乳腺癌细胞的迁移和侵袭能力。Wang等[18]的研究结果显示,MYL9在食管癌中高表达是根治性切除术后复发和患者总生存时间缩短的独立风险因素。然而徐文锋等[19]研究发现,MYL9在前列腺癌中的表达下调,且前列腺癌患者不良预后与其表达下调程度呈正相关。Yan等[20]也发现,MYL9的表达与磷酸化水平在结肠癌组织中下调,MYL9的低表达明显降低结肠癌患者的中位生存率。
虽然较多文献报告MYL9与肿瘤增殖、迁移相关,但其在NSCLC中的作用机制仍不清楚。为了明确MYL9在NSCLC中的生物学功能,本研究构建以MYL9基因为靶点的shRNA慢病毒载体,并形成沉默MYL9基因后稳定转染的NSCLC H1299细胞株,结果显示,KD组MYL9的mRNA相对表达水平均低于CON组与NC组(均P<0.05),提示沉默MYL9基因后H1299细胞MYL9 mRNA的表达下调。此外,KD组在培养24 h、48 h、72 h、96 h、120 h时的A值均低于CON组与NC组(均P<0.05),说明抑制MYL9基因的表达可明显抑制H1299细胞增殖。本研究划痕实验结果显示,KD组24 h、48 h划痕愈合率均低于CON组与NC组(均P<0.05),说明沉默MYL9基因后H1299细胞划痕愈合速度明显变慢,提示MYL9基因对H1299细胞的迁移有促进作用。本研究结果与既往多项研究结果[3,15-18]相似,但与徐文锋等[19]及Yan等[20]的研究结果有所差异,这可能与不同器官恶性肿瘤中MYL9基因的表达及磷酸化程度不同有关,有待进一步深入研究。
综上所述,沉默MYL9基因可下调NSCLC H1299细胞株MYL9 mRNA表达水平,降低H1299细胞株增殖和迁移能力,这或可为NSCLC的治疗提供一个潜在靶点和实验参考依据。
