转化生长因子-β诱导视网膜色素上皮细胞增殖中NLRP3炎症小体的表达及意义△
2019-03-15陈莉刘静张磊雷春灵
陈莉 刘静 张磊 雷春灵
近年来,人们利用转化生长因子-β(transforming growth factor-β,TGF-β)等刺激视网膜色素上皮细胞(retinal pigment epithelium,RPE)在玻璃体内的增殖、迁移和分化等过程,成功建立了离体增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)模型[1-2]。但TGF-β还是一个重要的抗炎细胞因子[3],其促纤维化和抗炎的特性导致通过抑制TGF-β活性治疗PVR的方案处于一个两难的境地。新近发现的Nod样受体蛋白3(nod-like receptor protein 3,NLRP3)与凋亡相关微粒蛋白(apoptosis associated speck-like protein containing CRAD,ASC)、半胱天冬酶(cysteine aspartic-acid protease,Caspase)等形成的炎症小体可以促进大量白细胞介素(interleukin,IL)-1β和 IL-18等炎症因子分泌和释放,加重细胞死亡,在老年性黄斑变性、脑卒中和癫痫中发挥重要作用[4-5],但未见NLRP3炎症小体与PVR是否存在关系的研究报道。本研究拟观察NLRP3炎症小体在TGF-β刺激RPE增殖中的表达改变,以期探讨其在PVR中的作用和意义。
1 材料与方法
1.1材料RPE细胞系ARPE19(CRL-2302;American Type Culture Collection,Manassas,VA,美国);二氧化碳(CO2) 培养箱、厌氧培养箱(Thermo,美国),超净工作台(Artech),540型酶标仪(BIO-RAD,美国),荧光显微镜(OLYMPUS,日本);Trizol(Invitrogen,美国),TGF-β(Sigma,美国),兔源性NLRP3单克隆抗体(AdipoGen,美国),兔源性β-actin单克隆抗体(Cell Signaling,美国),山羊抗兔IgG/辣根酶标记(北京中杉金桥),IL-1β和 IL-18 ELISA试剂盒(武汉博士德),链霉菌抗生物素蛋白-过氧化物酶免疫组化试剂盒(北京中山),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)(Applichem,美国)。
1.2方法
1.2.1RPE细胞系ARPE19传代和培养将ARPE19细胞放入37 ℃、含体积分数5%CO2饱和湿度培养箱内复苏、培养,加入2.5 g·L-1胰蛋白酶消化液1~2 mL后轻轻摇动培养瓶,使消化液均匀覆盖细胞表面,常温下静置1~2 min,倒置相差显微镜下观察细胞间隙扩大、胞质回缩、胞体变圆时弃去胰蛋白酶消化液,加入含体积分数10%胎牛血清的DMEM培养液终止消化;制备细胞悬液,按所需细胞数吸取一定量的细胞悬液种植于新的培养瓶中,加入适量含血清培养液,按13比例传代培养;传代 8 h 后细胞大部分贴壁生长,24 h后细胞全部贴壁,倒置相差显微镜下每天观察细胞的生长情况和形态特征,ARPE19细胞贴壁生长密度接近80%~90%时更换培养液。所有细胞均使用DMEM培养基+体积分数10%胎牛血清+5 mmol·L-1葡萄糖+10 g·L-1青链霉素常规培养。
1.2.2TGF-β诱导RPE细胞增殖及分组选择生长良好的第3代ARPE19用于本实验。细胞同步化后,加入含不同浓度TGF-β的无血清培养液200 μL。TGF-β以无血清培养液稀释后,其药物终浓度为0.5 μg·L-1、2.5 μg·L-1、10.0 μg·L-1、12.5 μg·L-1。随机分组:空白对照组(Sham组),TGF-β诱导RPE细胞增殖组(TGF-β组),TGF-β组再根据浓度分组如下:0.5 μg·L-1TGF-β组、2.5 μg·L-1TGF-β组、10.0 μg·L-1TGF-β组、12.5 μg·L-1TGF-β组。
1.2.3RPE细胞增殖测定RPE细胞增殖测定则采用MTT比色法来确定。选择生长良好的第3代RPE,2.5 g·L-1Trypsin-EDTA 消化,用含体积分数 10%胎牛血清的DMEM 培养液制成细胞悬液,以每孔10×103个细胞接种于96孔板,每孔加入20 μL MTT溶液,在细胞培养箱37 ℃下孵育4 h,吸出孔内培养液后再加入二甲基亚砜溶液,酶标仪在490 nm测定吸光度(A)值。以对照组细胞活力为100%,细胞存活率计算用下面的公式:细胞存活率(%)=A处理组/A正常组×100%。
1.2.4免疫荧光检测NLRP3表达取第2代生长良好的RPE,以40×106L-1的密度接种于24孔板,每孔500 μL,置于37 ℃、含体积分数5%CO2培养箱中继续培养24 h;RPE爬片后经40 g·L-1多聚甲醛固定15 min,PBS洗涤3遍,37 ℃驴血清封闭30 min;去除血清后加入NLRP3一抗抗体(150)4 ℃过夜,PBS洗涤3遍,加入驴抗兔荧光二抗抗体(11000)室温孵育3 h;PBS洗涤5遍,DAPI 染料染核5 min,PBS洗涤5遍,荧光淬灭封片剂封片。暗室中荧光显微镜下选择波长为490 nm和590 nm,观察NLRP3表达情况。
1.2.5Westernblot检测NLRP3表达收集各组处理过的RPE,在RIPA缓冲液中裂解(10 g·L-1Nonidet P-40、5 g·L-1脱氧胆酸钠、1 g·L-1PBS和SDS),提取细胞总蛋白,考马斯亮蓝法测定蛋白浓度,等量蛋白(50 μg)加入到120 g·L-1聚丙烯酰胺凝胶电泳,分离蛋白后转移到硝酸纤维素膜上,膜使用50 g·L-1脱脂牛奶封闭1 h,与NLRP3(1500)、β-actin(12 000)一抗结合,4 ℃过夜;然后TBST冲洗30 min,与辣根过氧化物酶标记的二抗结合,室温孵育1 h;电化学发光法显色后照相。最后用凝胶成像系统(Image master VDS)摄影,图像分析软件(Image J) 行灰度扫描分析。以目的蛋白与β-actin 的蛋白产物条带灰度值之比作为其蛋白水平表达的相对量,并进行扫描图像分析仪计算蛋白条带的表达。
1.2.6标准ELISA试剂盒检测IL-1β和IL-18表达将RPE接种于96孔板中,按照Sham组、不同TGF-β组浓度(0.5 μg·L-1、2.5 μg·L-1、10.0 μg·L-1、12.5 μg·L-1)分组,根据ELISA试剂盒流程进行IL-1β和IL-18表达的检测,先包被抗原,再洗涤后加入检测标本,洗涤后加入酶标记特异性 IL-1β 和IL-18抗体溶液,反复洗涤分别加入底物溶液于凹孔中被终止反应,最后利用酶标比色计测定结果。
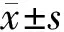
2 结果
2.1MTT检测RPE细胞增殖结果与Sham组比较,0.5 μg·L-1TGF-β组RPE细胞增殖不明显,差异无统计学意义(P>0.05),其余三组RPE细胞增殖明显(均为P<0.05);与0.5 μg·L-1TGF-β组相比较,2.5 μg·L-1、10.0 μg·L-1和12.5 μg·L-1TGF-β组细胞增殖均显著增加(均为P<0.05);与2.5 μg·L-1TGF-β组相比较,10.0 μg·L-1和12.5 μg·L-1TGF-β组细胞增殖显著增加(均为P<0.05)。见图1。
2.2免疫荧光检测RPE中NLRP3表达结果NLRP3染色阳性细胞中阳性染色呈颗粒状,分布在细胞膜、细胞质。与Sham组比较,0.5 μg·L-1TGF-β组RPE中NLRP3染色阳性率高;与2.5 μg·L-1、10 μg·L-1和12.5 μg·L-1TGF-β组比较,0.5 μg·L-1TGF-β组RPE中NLRP3染色阳性率也较高。见图2。
图1 TGF-β诱导后各组RPE细胞增殖情况。与Sham组比较,aP<0.05;与0.5 μg·L-1TGF-β组比较,bP<0.05;与2.5 μg·L-1 TGF-β组比较,cP<0.05

图2 RPE中NLRP3的表达。A、B、C分别为Sham组中NLRP3表达、核Hoechst染色和两者合成图;D、E、F分别为0.5 μg·L-1TGF-β组NLRP3表达、核Hoechst染色和两者合成图;Bar=300 μm
2.3Western-blot检测RPE中NLRP3中表达结果与Sham组比较,0.5 μg·L-1TGF-β组中NLRP3蛋白表达水平增高,差异有统计学意义(P<0.01),而其余三组中NLRP3蛋白表达水平也增高,差异均有统计学意义(均为P<0.05);与0.5 μg·L-1TGF-β组比较,2.5 μg·L-1、10.0 μg·L-1和12.5 μg·L-1TGF-β组的NLRP3蛋白表达水平低,差异均有统计学意义(P<0.05或P<0.01);与2.5 μg·L-1TGF-β组比较,10.0 μg·L-1和12.5 μg·L-1TGF-β组的NLRP3蛋白表达水平低,差异均有统计学意义(均为P<0.05)。见图3、表2。

图3 Western blot检测NLRP3蛋白在各组RPE中的表达
2.4标准ELISA试剂盒检测IL-1β和IL-18表达结果IL-1β和IL-18表达变化情况与NLRP3的变化情况相似,与Sham组比较,0.5 μg·L-1TGF-β组中IL-1β和IL-18释放增高,差异均有显著统计学意义(均为P<0.01),而其余三组中IL-1β和IL-18表达也增高,差异均有统计学意义(均为P<0.05);与0.5 μg·L-1TGF-β组比较,2.5 μg·L-1、10.0 μg·L-1和12.5 μg·L-1TGF-β组的IL-1β和 IL-18释放少,差异均有统计学意义(P<0.05或P<0.01);2.5 μg·L-1、10.0 μg·L-1和12.5 μg·L-1TGF-β组三组间比较,差异均无统计学意义(均为P>0.05)。见表2。
表2各组RPE中NLRP3、IL-1β和IL-18表达比较

组别NLRP3蛋白相对表达IL-1βIL-18Sham组0.78±0.121.00±0.011.00±0.010.5 μg·L-1 TGF-β组2.47±0.28a2.13±0.26a3.34±0.28a2.5 μg·L-1TGF-β组1.97±0.23bc1.76±0.19bc2.11±0.21bc10.0 μg·L-1TGF-β组1.48±0.17bde1.68±0.15bd2.06±0.22bd12.5 μg·L-1TGF-β组1.40±0.15bde1.66±0.17bd2.17±0.23bd
注:与Sham组比较,aP<0.01,bP<0.05;与0.5 μg·L-1TGF-β组比较,cP<0.05,dP<0.01;与2.5 μg·L-1TGF-β组比较,eP<0.05
3 讨论
PVR是一种由于病理性细胞在玻璃体后表面和视网膜内外两侧广泛增殖和收缩而形成视网膜前膜、视网膜下膜及横跨玻璃体腔的膜状病理改变。基础实验研究和临床观察发现[6-7],PVR病理发展过程大致可分为三个阶段:炎症反应期、增殖期及瘢痕重塑期。RPE是参与PVR形成最重要的细胞成分之一,TGF-β是调控RPE 细胞增殖过程的关键炎症因子,在PVR患者和实验模型的玻璃体中,TGF-β的表达水平与PVR的严重程度呈正相关[8-9]。因此,本研究采用不同浓度TGF-β刺激RPE细胞增殖来模拟体外PVR模型。PVR早期由于创伤、视网膜裂孔形成、长期视网膜脱离或手术导致组织损伤等启动炎症反应,导致炎症细胞的释放、迁移、血浆蛋白渗漏,诱发RPE移行到脱离的视网膜表面和下方及玻璃体腔进行增殖,但炎症反应调控RPE细胞增殖、迁移和转化的作用及具体分子机制还不清楚。
炎症小体是存在于免疫细胞中的多蛋白质复合物,由ASC、Caspase-1和Nod样受体(nod-like receptor,NLP)组成[10]。NLRP3 是目前研究最多,也是作用机制最不清楚的炎症小体。大量研究证明,NLRP3炎症小体在动脉粥样硬化、多发性硬化、2型糖尿病、老年性黄斑变性等多种疾病的发病过程中发挥重要作用[11-13]。
老年性黄斑变性时,RPE中形成的dsRNA可以激活NLRP3与已被激活的Caspase-1结合,形成NLRP3炎症小体,促进IL-1β、IL-6和IL-18等的产生,影响细胞存活,给机体造成伤害[14]。在增生型糖尿病视网膜病变合并牵拉性视网膜脱离患者的玻璃体液中,NLRP3表达明显升高,并且在PDR患者的纤维血管膜中检测到高表达的NLRP3、Caspase-1以及IL-1β。在糖尿病视网膜病变的动物模型研究中同样证实,NLRP3参与病理性视网膜新生血管的形成[15-16]。
但是,NLRP3炎症小体是否参与RPE细胞增殖,进而影响PVR的发生发展尚不清楚。本研究证实,与正常培养的RPE比较,TGF-β刺激的RPE中NLRP3表达增高,炎症因子IL-1β和 IL-18也明显分泌和释放。这些结果均提示,以NLRP3炎症小体为代表的固有免疫系统诱发的炎症反应可能在PVR中发挥着影响RPE细胞增殖的重要作用,直接影响患者的预后。
在利用不同浓度TGF-β刺激RPE细胞增殖模拟PVR建立的离体PVR模型上,本研究还证实,不同浓度梯度的TGF-β均可提高NLRP3表达,激活IL-1β和 IL-18成熟和释放,特别是2.5 μg·L-1浓度以上TGF-β显著刺激RPE细胞增殖,与其他文献报道结果一致[2],提示TGF-β激活RPE细胞增殖存在浓度依赖性,而且可能通过调控IL-1β和 IL-18等炎症因子介导炎症反应参与PVR的发生发展。许多文献报道,TGF-β在促RPE细胞增殖和纤维化的过程中还发挥重要的抗炎作用,而NLRP3炎症小体引发大量炎症因子释放,引起一种不同于凋亡和坏死的细胞死亡模式的“替补”程序性死亡方式——焦亡,两者相互调控,共同影响RPE细胞增殖和死亡[17-18]。本研究还发现,0.5 μg·L-1TGF-β组中NLRP3、IL-1β和 IL-18高表达更显著,而RPE细胞增殖不明显,提示可能TGF-β浓度不够,无法显著激活RPE细胞增殖,也可能NLRP3拮抗了TGF-β的促增殖作用,也间接证实了PVR病理发展存在炎症反应期、增殖期及瘢痕重塑期。在早期,即炎症反应期,TGF-β、凝血酶等各种细胞因子分泌较少,而血管受损,血-视网膜屏障、血-房水屏障破坏启动的炎症反应反而促进RPE死亡,而到了早中期(增殖期),各种调控因子分泌增多,在其作用下细胞外环境破坏,RPE细胞增殖、迁移,并向成纤维细胞转变的病理过程。
综上所述,在PVR不同时期,炎症因子和各类细胞因子可能通过相互“正”、“负”反馈调控作用共同参与PVR的发生发展,但具体的分子调控机制还缺乏相关研究,急需我们以 NLRP3和TGF-β为药物靶点进行深入研究。
