Cochlin及其编码基因凝血因子C同源物(COCH)在形觉剥夺性近视豚鼠眼球后极部组织的表达△
2019-03-15郭芳魏瑞华孙笑笑陈思童吴绵绵李亚红张琰
郭芳 魏瑞华 孙笑笑 陈思童 吴绵绵 李亚红 张琰
平行光线进入调节静止的眼睛,经眼内屈光介质折射后聚焦在视网膜前,形成近视[1]。目前,全球的近视患病率约为23.8%[2]。在我国,青少年近视患病率逐年上升,已成为不可忽视的公共卫生问题[3]。近视会引起裸眼视力下降,视物模糊,严重降低患者的生活质量。研究表明,高度近视还易引发视网膜脱离、脉络膜新生血管、近视性黄斑病变、青光眼等眼病,严重者可致盲[4-6]。目前对近视的发病机制仍不明确,尚无安全高效的防治手段。因此,深入研究近视的发病机制以寻求新型、高效的干预靶点已成为亟待解决的问题。近年来,蛋白质组学在筛选、发现与眼科疾病发病密切相关的特异性蛋白方面取得突破性进展,已应用于原发性开角型青光眼[7]、急性角膜移植排斥反应[8]、近视[9-10]、白内障[11]、年龄相关性黄斑变性[12]等眼病研究,为研发新型、高效的干预药物提供思路和根据。
本研究应用高通量蛋白质组学筛选出与豚鼠形觉剥夺性近视(form-deprived myopia,FDM)发生发展密切相关的差异性蛋白,选取表达上调最明显的Cochlin进行验证,初步探讨Cochlin及其编码基因凝血因子C同源物(coagulation factor C homology,COCH)在豚鼠FDM模型中的表达情况。
1 材料与方法
1.1主要试剂及仪器复方托吡卡胺滴眼液(沈阳兴齐眼药股份有限公司),4 g·L-1盐酸奥布卡因滴眼液(参天制药有限公司),石蜡切片机(德国SLEE公司),酶标仪(瑞士Tecan公司),A超(KN1800,无锡康宁医疗电子设备开发公司),检影镜(YZ24,苏州六六视觉科技股份公司),角膜曲率计(瑞安市博览光学仪器厂),兔抗COCH多克隆抗体、辣根过氧化物酶标记的羊抗兔二抗(美国Abcam公司),兔抗GAPDH单克隆抗体(美国Cell Signaling Technology公司),中性RIPA缓冲液、BCA试剂盒(北京康为世纪生物科技有限公司),多光谱成像系统(美国UVP公司),Trizol(美国Invitrogen公司),逆转录试剂盒、Nanodrop2000(美国ThermoFisher公司),HT7900荧光定量PCR仪(美国Applied Biosystem公司),SYBR Green FastStart 2X Master Mix(瑞士Roche公司)。
1.2实验动物选取3周龄的雄性健康三色豚鼠46只,体质量150~180 g(南京市浦口区莱芙养殖场)。实验前排除有眼部疾患、屈光参差大于1.50 D以及近视的豚鼠。给予豚鼠充足的新鲜饲料、水和蔬菜,保持室内温度在23~ 25 ℃,提供12 h的节律性光照。
1.3豚鼠FDM模型的构建将豚鼠随机分为2组,正常对照组和FDM组,每组23只,饲养6周。正常对照组的双眼不予任何处理,FDM组的右眼为实验眼,左眼为自身对照。采用半透明乳胶气球制成头套,遮盖FDM组豚鼠的右眼,但不压迫右眼角膜和眼睑,保证右眼能自由瞬目;同时使左眼、口鼻及双耳充分暴露[13]。每隔1 d检查头套的配戴情况,及时更换破损、移位及过紧的头套,保证FDM组豚鼠的右眼持续被遮盖但可自由瞬目。
1.4眼球生物学参数的测量在遮盖后0周、2周、4周及6周时,分别进行屈光度、眼轴长度和角膜曲率半径的测量。
1.4.1屈光度按文献[14]所述,用复方托吡卡胺滴眼液滴双眼散瞳4次,间隔5 min,麻痹睫状肌。暗适应30 min,充分散瞳后,于暗室行带状光检影验光。工作距离为50 cm,保持豚鼠头部固定不动,取水平和垂直子午线的平均值作为屈光度值。每眼重复测量3次,记录平均值。
1.4.2眼轴长度按文献[15]所述,测量前在豚鼠结膜囊内滴1滴盐酸奥布卡因滴眼液行表面麻醉,将A超探头垂直接触角膜顶点,并对准瞳孔中心,以角膜前顶点到视网膜前表面的距离为眼轴长度。每眼重复测量5次,记录平均值。
1.4.3角膜曲率半径根据文献报道的方法[16],测量豚鼠角膜曲率半径。将+8.00 D的镜片固定于角膜曲率计的前面,用于放大豚鼠角膜。记录水平和垂直读数的平均值,再乘以修正系数0.451,获取豚鼠真实的角膜曲率半径值。每眼重复测量3次,记录平均值。
1.5HE染色观察后极部巩膜的厚度及形态变化遮盖后6周测量完参数后,两组均随机选取6只豚鼠,腹腔注射过量的100 g·L-1水合氯醛处死,摘取右眼。眼球经酸性福尔马林固定、脱水、透明以及石蜡包埋。随后,沿平行视神经的方向连续切片(5 μm),当接近视神经时,收集切片,进行常规HE染色。光学显微镜下选取视神经两侧1 mm范围内的后极部巩膜,进行拍照。
1.6标本收集及后续检测第6周,上述各项光学参数测量完毕后,两组均随机选取17只豚鼠,腹腔注射过量100 g·L-1水合氯醛处死后,迅速摘取右眼,沿锯齿缘垂直切开眼球,去除眼前节组织及玻璃体,将后极部组织(包括视网膜、脉络膜、巩膜)置于1.5 mL EP管内,液氮速冻,-80 ℃冰箱保存。一部分组织标本采用Trizol法提取总RNA后,Nanodrop2000测定RNA的浓度和纯度,用于逆转录和实时荧光定量PCR检测(n=7);另一部分组织标本用中性RIPA缓冲液抽提总蛋白后,BCA法测定总蛋白浓度,分别用于高通量蛋白质组学分析(n=3)和Western blot检测(n=7)。
1.6.1高通量蛋白质组学分析将蛋白质样本还原烷基化及酶解,收集酶解后的肽段,然后用iTRAQ试剂进行差异标记,再将标记的样本相混合,用液相色谱分离多肽,进而用串联质谱进行相对定量分析。该实验委托广州RayBiotech公司实施。
1.6.2实时荧光定量PCR检测COCHmRNA的表达量按逆转录试剂盒说明,将1 μg总RNA合成cDNA后进行实时荧光定量PCR。引物由北京赛百盛基因技术有限公司合成。COCH引物序列:正向:GATGGTCTGCTTCTTTCACAGTAACT,反向:ACGCGCCGTGGACACT;β-actin引物序列:正向:ACGGAGCGTGGCTACAGTT,反向:TCCTTGATGTCACGCACAATTT。以3 μL cDNA为模板,加入COCH与β-actin的上下游引物各0.3 μL,以及5 μL SYBR Green FastStart 2X Master Mix,再加入无核酸酶的水,补足10 μL反应体系,在384孔板中进行实时PCR扩增。反应参数为:50 ℃预孵育2 min,95 ℃变性10 min,循环40次:95 ℃ 15 s,60 ℃ 1 min,并加入解离,95 ℃ 15 s,60 ℃ 15 s,95 ℃ 15 s。然后以β-actin为内参基因,应用2-ΔΔCt法定量分析两组COCH mRNA的相对表达量。
1.6.3Westernblot检测Cochlin的蛋白表达水平每份样本取50 μg总蛋白进行SDS-PAGE电泳,通过湿转法将蛋白转移到PVDF膜上,室温下经50 g·L-1脱脂奶粉封闭2 h,随后将膜分别与COCH兔多抗(1250)、GAPDH兔单抗(15000)在4 ℃摇床过夜孵育。第2天,TBST缓冲液洗膜3次后,把膜分别与辣根过氧化物酶标记的羊抗兔二抗(12000、130 000)在室温孵育2 h。显影液避光孵育3 min,在多光谱成像系统中拍照,使用Image J软件对目标条带的灰度值进行定量分析。
1.7统计学分析采用SPSS 13.0统计学软件进行统计分析。两组量化的数据资料经Shapiro-Wilk检验呈正态分布,以均数±标准差表示数据,各组间均数经Levene检验证实方差齐。两组豚鼠眼球光学参数的整体比较采用双因素方差分析,两两比较采用Tukey post hoc检验。两组间COCH基因在mRNA和蛋白水平上的表达比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1两组豚鼠屈光度和眼轴长度的比较遮盖前,两组豚鼠眼球的屈光度和眼轴长度双眼间差值(右眼-左眼)差异均无统计学意义(均为P>0.05)。遮盖后2周,相比对侧的左眼,FDM组右眼诱导出近视,眼轴相对延长;与正常对照组相比,FDM组右眼的屈光度下降,眼轴长度增加,差异均有统计学意义(均为P<0.05)。遮盖后4周和6周,FDM组的右眼相对左眼近视程度进一步加深,眼轴相对更加延长,近视度数和眼轴长度双眼间差值较正常对照组差异进一步加大,均有统计学意义(均为P<0.05)。此外,正常对照组的右眼与左眼间屈光度和眼轴长度双眼间差值不随时间发生明显变化,差异均无统计学意义(均为P>0.05)。而任意两个测量时间点的FDM组右眼与左眼间屈光度和眼轴长度双眼间差值比较,差异均有统计学意义(均为P<0.05),FDM组右眼的近视程度随形觉剥夺时间的延长逐渐加深。见表1和表2。
2.2两组豚鼠角膜曲率半径的比较遮盖前,正常对照组和FDM组豚鼠角膜曲率半径双眼间差值差异无统计学意义(P>0.05)。在遮盖后2周、4周及6周,两组豚鼠眼球的角膜曲率半径双眼间差值差异均无统计学意义(均为P>0.05)。见表3。
表1两组豚鼠各时间点双眼间屈光度差值(右眼-左眼)的比较

组别屈光度差值/D遮盖前遮盖后2周遮盖后4周遮盖后6周正常对照组0.27±0.490.20±0.360.24±0.400.40±0.53FDM组0.15±0.35-3.89±1.25-4.76±0.90-6.05±1.07P值0.6920.0000.0000.000
表2两组豚鼠各时间点双眼间眼轴长度差值(右眼-左眼)的比较

组别眼轴长度差值/ mm遮盖前遮盖后2周遮盖后4周遮盖后6周正常对照组-0.02±0.03-0.01±0.03-0.02±0.03-0.02±0.02FDM组-0.01±0.040.14±0.070.19±0.060.29±0.06P值0.5540.0000.0000.000
表3两组豚鼠各时间点双眼间角膜曲率半径差值(右眼-左眼)的比较
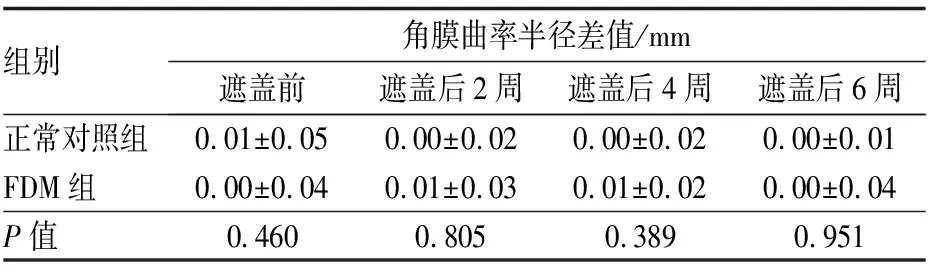
组别角膜曲率半径差值/mm遮盖前遮盖后2周遮盖后4周遮盖后6周正常对照组0.01±0.050.00±0.020.00±0.020.00±0.01FDM组0.00±0.040.01±0.030.01±0.020.00±0.04P值0.4600.8050.3890.951
2.3两组豚鼠眼球后极部巩膜厚度及形态变化遮盖后6周,HE染色结果显示,正常对照组右眼后极部巩膜的厚度正常,胶原纤维排列致密规则,未见断裂现象(图1A)。然而FDM组右眼的后极部巩膜变薄,胶原纤维变细,变稀疏,间隙变大,且部分纤维出现断裂现象(图1B)。
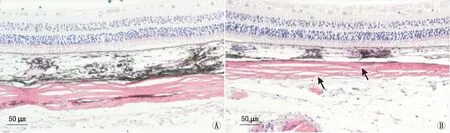
图1 遮盖后6周,两组豚鼠右眼后极部巩膜的HE染色结果。A:正常对照组胶原纤维排列规则,未见断裂现象;B:FDM组胶原纤维疏松,部分纤维出现断裂现象(黑色箭头)
2.4两组豚鼠眼球后极部组织的差异表达蛋白蛋白质组学分析结果显示,正常对照组和FDM组间表达差异在1.3倍以上的蛋白共221种,其中100种上调,121种下调。两组之间表达差异最明显的前10位蛋白已列出,见表4。其中Cochlin在FDM组豚鼠眼球后极部组织的表达量是正常对照组的3.77倍,升高趋势最明显,可能在豚鼠FDM眼中发挥重要作用。因此本研究选择Cochlin进行验证,探究Cochlin及其编码基因COCH在豚鼠FDM眼球后极部组织的表达变化。
2.5COCHmRNA的表达变化实时荧光定量PCR检测结果显示,遮盖后6周,在正常对照组和FDM组右眼后极部组织中,COCH mRNA的相对表达量分别为0.38±0.15和1.86±0.35。FDM组的相对表达量明显高于正常对照组,差异有统计学意义(P<0.05)。见图2。
表4正常对照组与FDM组豚鼠眼球后极部组织前10位差异表达蛋白

蛋白名称基因名称蛋白表达比值(FDM组/正常对照组)CochlinCOCH3.77Four and a half LIM domains 1FHLI3.13Keratin 19KRT192.81Keratin 4KRT42.78CeruloplasminCP2.27Crystallin gamma ACryga0.30BetaB3-crystallinCrybb30.34Retinal outer segment membrane protein 1ROM10.41Histidine rich glycoproteinHRG0.42BetaB1-crystallinCrybb10.47
2.6Cochlin的表达变化Western blot检测结果显示在正常对照组和FDM组右眼后极部组织中,Cochlin与GAPDH的灰度比值分别为0.37±0.14和0.73±0.15。FDM组Cochlin的表达水平显著高于正常对照组,差异有统计学意义(P<0.05)。见图2。
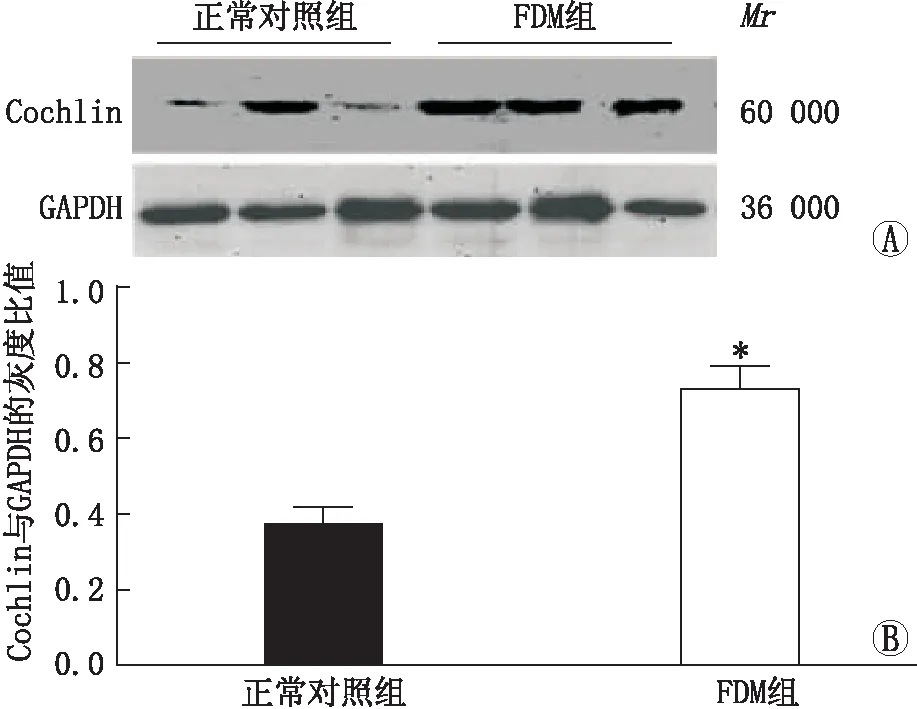
图2 两组豚鼠右眼后极部组织中Cochlin的蛋白表达变化。A:两组Cochlin蛋白表达的Western blot结果;B:两组Cochlin蛋白表达的定量分析结果,与正常对照组比较,*P<0.05
3 讨论
“局部视网膜机制和巩膜主动重塑”学说认为,异常的视觉刺激首先作用于视网膜,引起视网膜信号因子的改变,如多巴胺、视黄酸等,随后通过视网膜色素上皮层-脉络膜途径转导至巩膜,最终导致巩膜重塑。本研究采用半透明乳胶气球遮盖法成功构建了豚鼠FDM模型,通过高通量蛋白质组学分析及后续验证,在眼球后极部探寻近视发病过程中的关键蛋白。我们发现,在FDM豚鼠眼球后极部,COCH基因在核酸和蛋白水平上的表达显著上调,提示其编码的蛋白Cochlin可能在豚鼠FDM的发生发展过程中起到重要作用,但具体的分子和细胞机制仍待进一步探索。
豚鼠的眼球结构及发育过程与人类相似,而且眼球较大,性情温和,易于眼球参数的测量,已成为国内外常用的近视模型动物之一[17]。本研究给予豚鼠单眼形觉剥夺6周后发现,相比左眼,右眼的屈光度显著下降,形成(-6.05±1.07)D的相对近视。与屈光度下降保持一致的是,豚鼠眼轴显著延长,但未伴随角膜曲率半径的明显改变,提示形觉剥夺诱导豚鼠近视的发生,且屈光度下降主要由眼轴延长引起,与角膜曲率无关。另外,随着遮盖时间的延长,近视和眼轴延长的程度逐渐加深。这些实验结果与Lu等[13]的研究结果一致。此外,眼轴的过度延长主要由于后极部巩膜细胞外基质(extracellular matrix,ECM)重塑所造成,且常伴随巩膜的病理学改变。大量研究表明,后极部巩膜重塑,如胶原纤维合成减少,降解增多,直径变小,巩膜变薄等,可使巩膜的弹性模量及最大应力减小,抵抗力减弱,最终在眼压的作用下,巩膜发生扩张,眼轴延伸而诱发近视[18-20]。本研究同样发现,遮盖后6周,与正常对照组比较,FDM组右眼的后极部巩膜变薄,胶原纤维变细、间隙变大、排列紊乱,甚至出现断裂的现象。
COCH基因及其编码蛋白Cochlin在眼部的功能尚不清楚。COCH基因是人类发现的第一个伴前庭功能障碍的耳聋基因,为常染色体显性遗传,位于人类14q12-13,含有12个外显子[21]。Cochlin蛋白是构成内耳ECM中非胶原蛋白的主要成分,是一种分泌性蛋白,主要由含有大量半胱氨酸并与无脊椎动物鲎的C因子同源的结构域以及两个与非胶原结构糖蛋白A型结构域同源的区域构成[22]。既往研究表明,非胶原结构糖蛋白A型结构域可通过结合胶原纤维或糖蛋白,参与构成ECM,二者之间的相互作用发生改变会引发胶原蛋白降解[23-24]。Cochlin可能通过与ECM成分结合,参与维持ECM结构的完整性以及稳定性。Khetarpal等[25]在伴前庭功能障碍的耳聋患者的内耳中发现,含有Cochlin与黏多糖的沉积物积聚在ECM内,Ⅱ型胶原大量缺失,而且紊乱的微纤维状结构增多。随后,Calzada等[26]在梅尼埃病患者的前庭标本中发现,Cochlin的表达量增多,同时IV型胶原和层粘连蛋白-β2的含量减少。以上结果均提示Cochlin的过度表达可能破坏正常胶原纤维形成,导致胶原蛋白和其他ECM成分的降解。此外,除在耳蜗和前庭中存在高表达外,COCH基因在人和小鼠的眼中则存在较低的表达水平[27]。Bhattacharya等[28]研究发现,Cochlin仅在原发性开角型青光眼患者以及DBA/2J小鼠青光眼模型的小梁网组织中表达,然而在人和野生型小鼠的正常小梁网中未检测出Cochlin的存在。随后他们还发现Cochlin与黏多糖共同沉积在人小梁网组织中,并且伴随Ⅱ型胶原蛋白含量降低,提示Cochlin可能破坏小梁网ECM的完整性,使得胶原纤维更易降解,形成碎片沉积物。本研究发现COCH mRNA和Cochlin在豚鼠FDM眼球后极部组织的表达显著上调。COCH表达上调的可能作用机制是Cochlin的过度表达,使巩膜ECM发生重塑,胶原纤维降解增多,最终可能导致眼轴延长。
