土拉弗朗西斯氏菌LAMP快速检测方法的应用
2019-03-15李子微邓仲良
李子微 邓仲良
(南华大学公共卫生学院,衡阳 417000)
土拉弗朗西斯氏菌(Francisella tularensis)是一种革兰氏阴性菌,可引起急性、感染性人畜共患疾病[1-2]。野兔和鼠类为主要传染源,蜱虫为主要传播媒介。土拉弗朗西斯氏菌有4个亚种[3],其中A型土拉热亚种毒力最强[4],在缺乏抗生素治疗的情况下,感染10个细菌可引发急性的、甚至致命的病症[5],临床表现为发热、黄瘟等,严重者死亡。其传播途径多样,易扩散、毒性强、病死率高,被美国预防与疾控控制中心列为A类生物恐怖制剂[6]。40年前,在我国新疆、黑龙江和内蒙古曾有“野兔热”的报道[7]。
土拉弗朗西斯氏菌生长十分缓慢且可经气溶胶传播,采用细菌培养的方法检测诊断难度较大,同时,土拉弗朗西斯氏菌易与变形杆菌、鼠疫耶尔森氏菌菌产生血清学交叉反应。目前,土拉弗朗西斯氏菌病早期的核酸快速检测方法有普通PCR、Realtime PCR等,需借助大型仪器,且不适合现场实时检测和基层的推广。近年来寻求对土拉弗朗西斯氏菌进行快速、准确、操作简便的检测技术一直是相关研究的热点。2000年,Notomi等[8]发明了一种新型的核酸等温扩增技术-环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP),利用具有链置换活性的BstDNA 聚合酶(Bst DNA polymerase)提供反应的动力,在65℃条件下反应15-60 min,能将目标片段可以扩增到1010倍左右,反应结果可通过反应副产物焦磷酸镁白色沉淀的混浊度来判定[9-11]。该方法规避了常规PCR反应的变性、退火、延伸等一系列复杂的过程,大大节省了反应时间和成本,且同时具有高特异性、高灵敏度、高效简便的特点,为临床和现场一线的快速检测提供可能。自开发以来,LAMP技术已被应用于对细菌、病毒、寄生虫的检测和动物胚胎性别鉴定等领域[12]。
目前,国内外尚未见LAMP方法检测土拉弗朗西斯氏菌的报道,本研究根据土拉弗朗西斯氏菌FopA基因片段设计LAMP引物[13],对土拉弗朗西斯氏菌进行检测,优化反应条件,验证特异性和灵敏度,并应用于土壤模拟样品的直接检测,建立针对土拉弗朗西斯氏菌的LAMP快速检测方法。本研究对于防止野兔热的暴发流行,防范公共安全事件均具有重要意义。
1 材料与方法
1.1 材料
1.1.1 菌株 土拉弗朗西斯氏菌、布鲁氏菌、鼠疫耶尔森氏菌和蜱DNA由中国人民解放军军事医学科学院微生物流行病研究所提供;副溶血性弧菌、大肠杆菌(Escherichia coli)O157型、单增李斯特氏菌、沙门氏杆菌、金黄色葡萄球菌、聚合拟杆菌、脆弱拟杆菌、乳酸杆菌、双歧杆菌由北京热景生物技术股份有限公司提供。
1.1.2 主要试剂与仪器 BstDNA聚合酶大片段(New England Biolabs);细菌纯培养物DNA提取试剂盒(北京开景基因技术有限公司);betaine(Sigmaaldrich);D30核酸蛋白测定仪(艾本德中国有限公司);XMTD-6000电热恒温水浴锅(北京市长风仪器仪表公司);DYY-8C型电泳仪(北京市六一仪器厂);质粒提取试剂盒(天根生化科技有限公司,北京)。
1.2 方法
1.2.1 引物的设计与合成 根据土拉弗朗西斯氏 菌FopA基 因 序 列(GenBank accession no.:HM371345.1),利用软件PrimerExplorer V5(日本荣研化学株式会社)设计特异的LAMP引物,引物由北京梓熙生物科技有限公司合成,序列如表1所示。

表1 扩增土拉弗朗西斯氏菌FopA基因的LAMP引物序列
1.2.2 DNA模板的制备
1.2.2.1 试剂盒法 按照试剂盒说明书提取细菌纯培养物DNA。
1.2.2.2 煮沸法 吸取细菌培养液1 mL,沸水浴中煮沸10 min,10 000×g离心3 min,上清液作为扩增模板。
1.2.3 LAMP反应体系的配制 10×Thermopol buffer(1 μL),1.8 mmol MgSO4,0.24 mmol dNTPs Mix,10 mmol Betaine,1 pmol F3,1 pmol B3,6 pmol FIP,6 pmol BIP,4 pmol LB,128 U/mL Bst DNA Polymerase,H2O补足至10 μL,模板(2 μL),混匀;同时,采用灭菌水为模板(2 μL)作为阴性对照,混匀。迅速置于65℃恒温水浴锅,反应60 min,80℃灭活5 min,终止反应。肉眼观察反应体系的浊度,产物于2%的琼脂糖凝胶进行电泳分析。
1.2.4 LAMP反应体系和反应条件的优化 (1)反应温度:分别于59℃、61℃、63℃、65℃、67℃、68℃反应60 min,确定最佳反应温度。(2)外内引物对比例:选择外引物与内引物比例依次为1∶2、1∶4、1∶6、1∶8、1∶10进行扩增,确定最佳比例关系。(3)Mg2+浓度:选择Mg2+浓度依次为2、2.5、3、3.5和4 mmol/L进行扩增,确定Mg2+的最佳浓度。(4)甜菜碱浓度:选择甜菜碱浓度依次为8、9、10、11、12、13、14和15 mmol/L进行扩增,确定甜菜碱的最佳浓度。(5)dNTPs浓度:选择dNTPs浓度依次为4、6、10、14、16和18 mmol/L进行扩增,确定dNTPs的最佳浓度。
1.2.5 特异性实验 采用建立的LAMP方法分别对土拉弗朗西斯氏菌、布鲁氏菌、鼠疫耶尔森氏菌、副溶血性弧菌、O157型大肠杆菌、单增李斯特氏菌、沙门氏杆菌、金黄色葡萄球菌、聚合拟杆菌、脆弱拟杆菌、乳酸杆菌、双歧杆菌和蜱的DNA进行扩增,电泳观察扩增结果,验证方法的特异性。
1.2.6 灵敏度实验
1.2.6.1 细菌纯培养物检测灵敏度 提取过夜培养的土拉弗朗西斯氏菌菌液DNA,10倍倍比稀释至4.9×10-4.9×108pg/mL,分别取2 μL作为反应模板,进行LAMP扩增。
1.2.6.2 克隆质粒检测灵敏度 提取土拉弗朗西斯氏菌克隆株质粒DNA,10倍倍比稀释至1×10-1×109copies/μL,分别取2 μL作为反应模板,进行LAMP扩增,同时与普通PCR方法进行比较分析。
1.2.7 污染土壤模拟样品实验 采用10倍倍比稀释的土拉弗朗西斯氏菌克隆菌株悬液污染土壤,4℃过夜后,经煮沸法提取DNA,通过荧光定量PCR和LAMP对比检测,比较分析该方法的准确率和实际应用价值。
2 结果
2.1 LAMP反应条件的优化
从图1可以看出,在扩增温度为65℃(图1-A)、外引物与内引物比例为1∶6(图1-B)、Mg2+浓度为2.5 mmol/L(图1-C)、甜菜碱浓度为9-10 mmol/L(图1-D)、dNTPs浓度为10 mmol/L(图 1-E)时,土拉弗朗西斯氏菌DNA的扩增效果较好,由此确定反应体系。
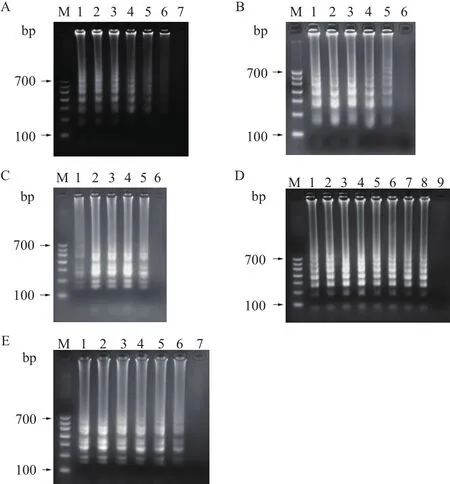
A:反应温度优化结果:M:100 bp marker;1:59℃;2:61℃;3:63℃;4:65℃;5:67℃;6:69℃;7:阴性对照。B:外内引物对比例优化结果:M:100 bp marker;1∶1∶2;2∶1∶4;3∶1∶6;4∶1∶8;5∶1∶10;6:阴性对照。C:Mg2+浓度优化结果:M:100 bp marker;1:2 mmol/L;2:2.5 mmol/L;3:3 mmol/L;4:3.5 mmol/L;5:4 mmol/L;6:阴性对照。D:甜菜碱浓度优化:M:100 bp marker;1:8 mmol/L;2:9 mmol/L;3:10 mmol/L;4:11 mmol/L;5:12 mmol/L;6:13 mmol/L;7:14 mmol/L;8:15 mmol/L;9:阴性对照。E:dNTPs浓度优化结果 M:100 bp marker;1:4 mmol/L;2:6 mmol/L;3:10 mmol/L;4:14 mmol/L;5:16 mmol/L;6:18 mmol/L;7:阴性对照
2.2 特异性试验
特异性实验结果(图2)显示,仅土拉弗朗西斯氏菌纯培养物DNA出现了LAMP反应特有的阶梯状条带,其他11株非土拉弗朗西斯氏菌DNA和蜱的DNA均未出现阶梯状条带。
2.3 灵敏度实验
根据土拉弗朗西斯氏菌的行业标准,对土拉弗朗西斯氏菌纯培养物、土拉弗朗西斯氏菌克隆质粒进行LAMP灵敏度检测,同时对土拉弗朗西斯氏菌克隆质粒进行PCR灵敏度检测,由图3可知,LAMP检测土拉弗朗西斯氏菌纯培养物灵敏度为4.9×102pg/mL(图3-A);LAMP检测土拉弗朗西斯氏菌克隆质粒可达到8 copies/μL(图3-B),高于PCR检测灵敏度103copies/μL(图3-C)。

图2 LAMP特异性实验结果
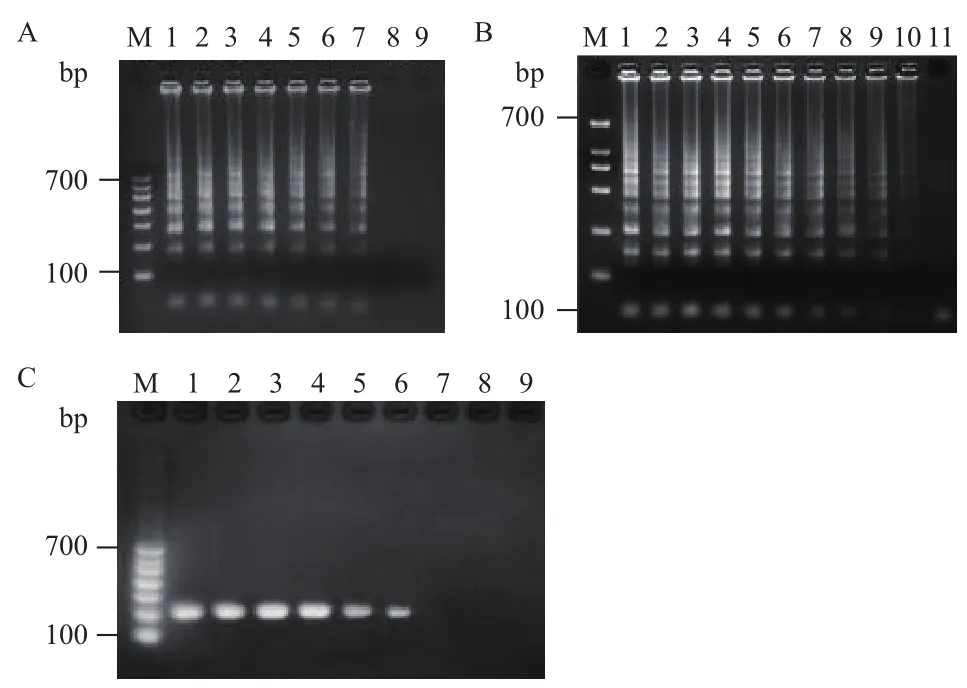
图3 LAMP灵敏度实验结果
2.4 土壤模拟样品检测
图4显示,对土壤模拟样本LAMP检测结果与预期完全一致,且与行业标准认可的荧光定量PCR方法的检测结果相吻合,无假阳性或假阴性结果出现,说明该方法具有良好的特异性和实用价值。
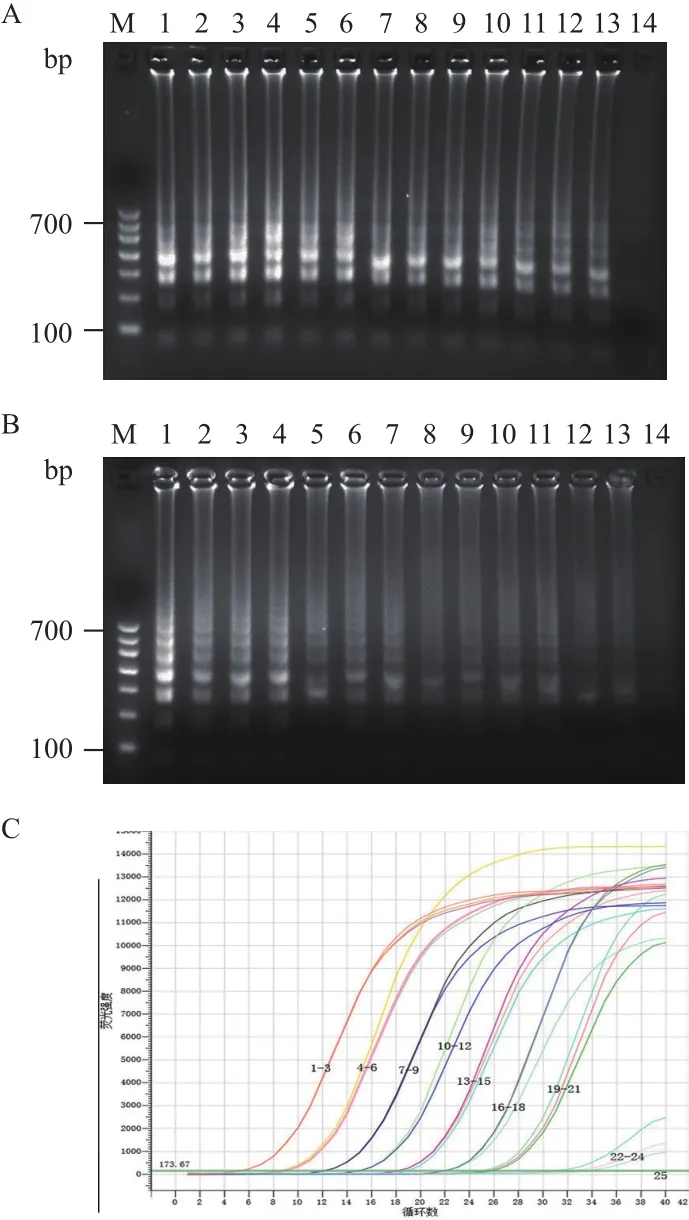
图4 24份不同稀释度土壤模拟样本电泳图
3 讨论
土拉菌致病性强,致死率高,长期以来一直被视为危险的生物武器,与鼠疫、炭疽等被列为A类生物恐怖战剂,其严重的危害性引起了人们的高度关注,已成为反恐和世界卫生安全的重要问题之一。
FopA蛋白是的土拉弗朗西斯氏菌外膜蛋白之一,特异性强、保守性好,并具有良好的抗原性。患者在恢复期,血清中仍然存在抗FopA抗体,由土拉弗朗西斯氏菌FopA基因编码,其高度保守性使其适用于土拉弗朗西斯氏菌的核酸诊断。因此,本研究选择土拉弗朗西斯氏菌FopA基因为靶基因建立LAMP检测方法。本研究针对土拉弗朗西斯氏菌FopA基因设计一套LAMP引物进行核酸扩增,通过电泳分析法优化反应条件,并验证其特异性、灵敏度,建立了简便、灵敏、快速,可特异性检测土拉弗朗西斯氏菌的方法。在研究过程中,采用优化后的LAMP方法和荧光定量PCR技术分别土拉弗朗西斯氏菌的基因组DNA进行核酸扩增,结果显示明显的阳性扩增;而对鼠疫耶尔森氏菌、布鲁氏菌、大肠杆菌等11种标准菌株的基因组DNA和蜱虫DNA进行核酸扩增,均未出现非特异性扩增。灵敏度测试采用了土拉弗朗西斯氏菌基因组DNA和克隆株质粒进行同时确定,从土拉弗朗西斯氏菌活菌中提取的土拉弗朗西斯氏菌基因组DNA保证了灵敏度实验的可靠性,为了避免活菌细胞裂解不完全,影响灵敏度检测结果,采用构建质粒的方式进一步精确计算灵敏度。LAMP检测土拉弗朗西斯氏菌克隆质粒的灵敏度为10 copies/μL,达到文献报道的应用TaqMan荧光定量PCR检测土拉弗朗西斯氏菌[14]的灵敏度。此外,LAMP检测土拉弗朗西斯氏菌的基因组DNA灵敏度为490 pg/mL。土壤资源是生态基础中非常重要的部分,也是各种生物生存发展的基础;土壤环境中存在成千上万种微生物,环境复杂,土拉弗朗西斯氏菌的检测易受土壤环境中其他微生物和其他物质的干扰。优化后的LAMP技术可直接对土壤中的土拉弗朗西斯氏菌进行检测,且检出限达44 CFU/g,低于TaqMan探针实时荧光定量PCR快速检测土壤样本中土拉弗朗西斯氏菌[14]的检出限440 CFU/g,验证了LAMP技术检测土拉弗朗西斯氏菌的实用价值。
LAMP技术检测土拉弗朗西斯氏菌不仅仅有特异性强、灵敏度高的特点,与传统方法相比,还大大减少了检测周期,扩增反应在15-60 min即可判断结果,环引物的加入进一步提高了反应速度,缩短了检测时间;反应在恒温条件下进行,对实验设备无特殊要求,仅需要恒温加热装置即可。此外,由于LAMP独特的核酸扩增机制,其产物是由多重复靶序列的茎-环结构状DNA和花椰菜状DNA所组成的混合物,在琼脂糖凝胶电泳上呈现特有的的阶梯状条带,结果易判断;LAMP技术的扩增效率极高,在反应过程中,合成大量核酸,从dNTPs析出焦磷酸根离子,与反应体系中添加的镁离子结合,产生副产物焦磷酸镁白色沉淀,也可直接肉眼观察或通过浊度计检测,这是判断目的基因是否存在最直接的参照方式。
综上所述,此次研究建立的针对土拉弗朗西斯氏菌的LAMP检测技术具有特异性强、灵敏度高、简便高效等特点,为土拉弗朗西斯氏菌的快速检测提供了新的发展方向,有望成为常规的快速检测手段,可满足基层实验室、应急检测和现场检测等方面的使用需求,具有良好的应用价值和发展前景。但由于LAMP检测技术建立的时间不长,依然存在有不足之处:检测结果只有阳性与阴性两种,只能定性不能定量,一旦产生非特异性扩增,不易鉴别;设计土拉弗朗西斯氏菌的LAMP引物时,采用了5条引物,且在恒温条件下进行扩增,引物之间可能形成互补而扩增出非特异性的条带,造成假阳性;LAMP扩增效率极高,过于灵敏和产物量大,实验室一旦遭到扩增产物气溶胶污染,易出现假阳性。为了减少污染,确保检测结果的可信度,在实验过程中,将试剂配制操作、阳性样本加样操作、水浴锅反应操作分别在不同的封闭实验室进行;将反应混合物加入反应管后,用封口膜封闭管口,防止扩增产物污染实验室气体环境;试剂和引物进行小瓶分装使用,并于低温条件下密封保存。这些措施均充分保证了检测结果的可靠性。
4 结论
针对土拉弗朗西斯氏菌FopA基因设计引物并建立环介导等温扩增技术,并应用于土壤模拟样本的检测,结果表现出特异性强、灵敏度高、速度快且设备要求简单等特点。
