蒺藜苜蓿PYL基因家族的全基因组鉴定、表达和功能分析
2019-03-15黄思源呼天明杨培志
黄思源,呼天明,杨培志
(西北农林科技大学草业与草原学院,陕西 杨凌 712100)
截至目前,已经有许多植物鉴定到PYL家族基因,如在拟南芥(Arabidopsis thaliana)中鉴定到14个具有高度保守氨基酸序列的PYL基因[9],在水稻(Oryza sativa)、葡萄(Vitis vinifera)、番茄(Lycopersicon esculentum)、 橡 胶 树 (Hevea brasiliensis)和 棉 花(Anemone vitifolia)中分别鉴定到 12、8、14、21和27个PYL基因[10-14],其中一些PYL基因的功能已经被成功验证,如拟南芥AtPYL4过表达可以增强拟南芥的耐旱性[15],AtPYL8与AtPYL9在拟南芥侧根生长中起重要作用[16],玉米(Zea mays) ZmPYL8、ZmPYL9和ZmPYL12的过表达可以增强玉米的耐寒性[17],水稻OsPYL5的过表达可以增强水稻对干旱和盐胁迫耐性[18]。目前,蒺藜苜蓿全基因组测序已经完成[19],这为用生物信息学手段研究该物种基因家族系统演化及功能分析奠定了基础,而PYL基因在增强非生物胁迫下的耐受性方面发挥重要作用。因此,鉴定和验证蒺藜苜蓿中的PYL基因对理解它们的功能和ABA信号转导途径具有非常重要的作用。
本研究利用生物信息学的方法鉴定蒺藜苜蓿中PYL基因家族成员,并分析其基因结构、蛋白结构域、保守基序等信息,同时检测该基因家族成员在干旱胁迫下的表达模式,旨在为蒺藜苜蓿PYL基因的克隆及功能研究提供理论基础。
1 材料与方法
1.1 植物材料和处理
用次氯酸钠将蒺藜苜蓿种子消毒5 min后用蒸馏水冲洗干净,将处理后的种子放入滤纸覆盖的培养皿中,放入人工培养箱,在25 ℃/15 ℃(白天/黑夜)进行暗培养,暗培养5 d后,将幼苗移栽到装有石英砂的塑料培养钵 (9 cm × 27 cm)中进一步培养[20],培养30 d后,将蒺藜苜蓿根部从石英砂中洗出,放置在新的具有干石英砂的塑料培养钵中进行干旱胁迫[21]。采集干旱胁迫0(CK)、3、8 h的蒺藜苜蓿叶片,收集样品后立即在液氮中冷冻,储存在-80 ℃冰箱中以备之后进行RNA提取。
1.2 蒺藜苜蓿PYL基因家族的全基因组鉴定与染色体定位
以拟南芥的14个PYL蛋白序列作为查询序列,在NCBI网站(https://www.ncbi.nlm.nih.gov/ncbisearch/)通过蛋白质基本局部比对工具设置BLASTp[22]搜索蒺藜苜蓿全基因组,设置检索阈值E-value为e-6,同时,在Pfam数据库(http://pfam.xfam.org/browse)中下载了Polyketide_cyc2结构域的HMM文件(PF10604),并利用 HMMER V3.1b2(http://www.hmmer.org)软件构建隐马尔科夫模型(HMM),在蒺藜苜蓿蛋白数据库搜索含有Polyketide_cyc2结构域的序列,人工去除冗余基因,并通过NCBI-CDD数据库[23](https://www.ncbi.nlm.nih.gov/cdd/)鉴定候选的序列是否具有PYR_PYL_RCAR_like结构域(cd07821),根据染色体的位置对包括PYR/PYL/RCAR功能域的候选基因进行命名。在蒺藜苜蓿基因组浏览器(http://www.medicagohapmap.org/fgb2/gbrowse/mt40/)中鉴定基因序列和位置。在ExPASy[24]网站(http://web.expasy.org/)上鉴定氨基酸数目及等电点(pI)和分子量(MW)。通过YLoc网站[25](http://abi.inf.uni-tuebingen.de/Services/YLoc/webloc.cgi)对候选基因进行亚细胞定位预测。使用MapInspect软件[26]对基因在染色体的分布进行定位,利用MCScanx[27]进行基因家族的复制分析,判定基因复制事件。
1.3 蒺藜苜蓿 PYL基因家族的系统进化树分析
使用蒺藜苜蓿、水稻和拟南芥PYL基因的蛋白质序列构建系统发育树。使用MEGA 6.0[28]软件对蛋白质序列进行序列比对,通过邻接(NJ)法构建系统发育树,设定bootstrap值等于1 000。最后将构建好的树形图文件上传到ITOL[29]网站(http://itol.embl.de/)进行美化,以更好地展示。
1.4 基因外显子-内含子结构和蛋白质保守基序分析
使用TBtools软件比较蒺藜苜蓿PYL基因的CDS序列和基因组序列,分析基因外显子-内含子结构。在MEMEsuite网站[30](http://meme-suite.org/)对候选的蒺藜苜蓿PYL基因鉴定保守基序,设定8个基序的限制。
1.5 MtPYL启动子中的顺式元件分析
从 Ensemble plants网站 (http://plants.ensembl.org/index.html)数据库获得蒺藜苜蓿PYL基因起始密码子(ATG)上游1 500碱基对(bp)内的序列,使用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)搜索启动子中的顺式元件[31]。
上海印刷集团在坚持印刷这一主营业务的同时,不断发展文化创意产业,实施文化创新战略,打造中国文物保护的文化服务行业。
1.6 靶向 MtPYL基因的 miRNA 的预测
在PSRNATarget网站[32](http://plantgrn.noble.org/psRNATarget/)预测潜在的miRNA,采用默认参数。对预测结果使用Cytoscape软件[33](http://www.cytoscape.org/)进行展示。
1.7 基因表达谱和基因本体富集分析
从蒺藜苜蓿基因表达图谱(MtgeA)Web服务器[34](http://mtgea.noble.org/v2/)下载蒺藜苜蓿不同组织及盐胁迫下的PYL基因的表达数据,获取的表达数据用R语言程序包pheatmap绘制热图,使用R语言程序包clusterProfiler[35]进行基因本体(GO)分析及KEGG通路分析,对基因进行功能注释。
1.8 RNA 提取和实时 qRT-PCR
使用Eastep TM总RNA提取试剂盒(北京普洛麦格生物技术有限公司)从干旱的样品中提取RNA。使用 1 µg RNA 模板样品,使用 HiScript II Q Select RT SuperMix for qPCR 试剂盒 (南京诺维赞生物科技有限公司)合成互补DNA的第一链(cDNA)。使用LightCycler® 480 II实时荧光定量 PCR 仪进行 qRTPCR测定。
2 结果与分析
2.1 MtPYL基因的全基因组鉴定
根据拟南芥PYL蛋白序列对蒺藜苜蓿基因组进行BLASTp搜索,为了进一步证实这些候选序列的可靠性,通过Pfam数据库鉴定序列存在Polyketide_cyc2结构域(PF10604),并通过NCBI-CDD数据库鉴定序列存在PYR_PYL_RCAR_like结构域(cd07821)。最终在蒺藜苜蓿基因组中鉴定到14种PYL基因家族成员(表1)。根据其在染色体上的位置(表1),14个成员被命名为MtPYL1-14。
基因在染色体上的分布显示,14个PYL基因家族成员分布在除2号染色体外的其他7条染色体上,其中在第1、3、5号染色体上分布较多,各有3个PYL基因(图1)。物理化学分析表明,14个PYL基因家族成员氨基酸的长度在168~233个氨基酸(aa)范围内,相应的蛋白质分子量在18.5~25.4 kDa,等电点 (PI)在 4.45~7.64。根据 YLoc网站对PYL蛋白亚细胞定位的预测表明,PYL蛋白主要定位在细胞质中。
2.2 蒺藜苜蓿 PYL基因的系统发育分析和分类
为了确定蒺藜苜蓿PYL基因的进化关系并对它们的分类,对蒺藜苜蓿、拟南芥和水稻的PYL基因进行进化分析,使用MEGA软件产生无根的NJ树。
这3个物种的共40个PYL基因被聚为4组(图2)。对每组中不同物种的PYL基因的数目进行统计,结果表明,14个蒺藜苜蓿的PYL基因被聚类到所有的组1~4中,每组分别包含4、2、3和5个蒺藜苜蓿PYL基因,拟南芥14个PYL基因被聚类到组1~3中,分别包含3、9和2个基因。水稻的12个PYL基因同样也是分布到组1~3中,分别包含3、3和6个基因,值得注意的是,组4中的5个基因全部为蒺藜苜蓿PYL基因,根据进化树发现,蒺藜苜蓿和拟南芥之间存在几个密切相关的PYL基因,比如 AtPYL4与 MtPYL13,AtPYL2与MtPYL1等,这暗示它们之间可能具有相似的功能。

表1 蒺藜苜蓿PYL基因家族成员基因组信息和蛋白特征分析Table 1 Analysis of genomic information and characterization of protein encoded by PYL gene family members in Medicago truncatula

图1 蒺藜苜蓿 PYL 基因的染色体定位Figure 1 Chromosomal mapping of PYL genes in M. truncatula
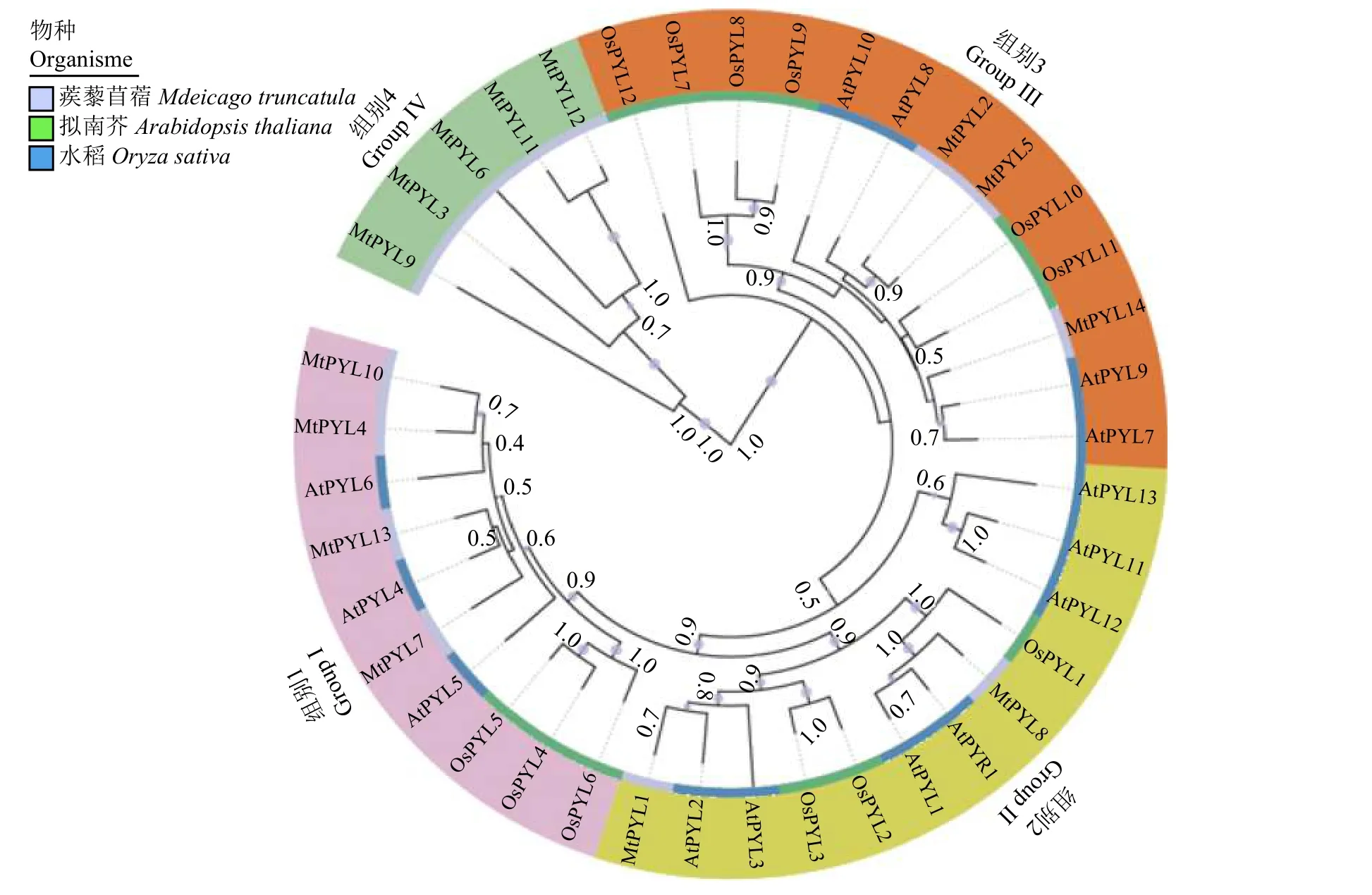
图2 3 个植物物种 PYL 蛋白的进化关系Figure 2 Phylogenetic relationship among the PYL proteins of the three plant species
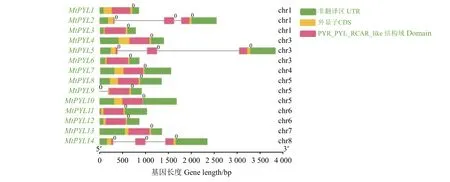
图3 蒺藜苜蓿基因的外显子-内含子结构及功能域信息Figure 3 Exon-intron structures and domain information of PYL genes in M. truncatula
2.3 蒺藜苜蓿 PYL基因的结构与功能域分析
功能域预测结果显示(图3),PYR_PYL_RCAR_like结构域存在于所有的14个蒺藜苜蓿PYL基因中,基因外显子-内含子结构结果(图3)显示,蒺藜苜蓿PYL基因的基因结构大多只含有一个外显子,只有MtPYL2、MtPYL5、MtPYL14具有3个外显子。结合进化树,14个蒺藜苜蓿MtPYL基因中,其中10个只有1个外显子的基因分布于组1,组2和组4中(图2),其中,组1和组2的成员全部只有1个外显子,具有3个外显子的MtPYL2、MtPYL5、MtPYL14全部落入组3中,而具有两个外显子的MtPYL9则落入组4中。而且具有相似外显子-内含子组织的基因大部分落入同一组中,这进一步支持了本研究中蒺藜苜蓿PYL基因的分类。
2.4 保守基序的分析
使用MEME程序鉴定蒺藜苜蓿PYL基因蛋白质的保守基序,并且通过Smart数据库进一步预测它们的序列和注释。结果显示,在大多数蒺藜苜蓿PYL基因蛋白中鉴定出3个保守的基序(表2、图4)。保守基序的长度在41~50个氨基酸范围内,Polyketide_cyc2结构域在蒺藜苜蓿PYL蛋白的保守基序1、2、4、5中被预测(表2)。保守基序1、2在 MtPYL1、MtPYL2、MtPYL4、MtPYL5、MtPYL7、MtPYL8、 MtPYL9、 MtPYL10、 MtPYL13、 MtPYL14中高度保守,保守基序4、5在MtPYL3、MtPYL6、MtPYL11、MtPYL12中高度保守,而MtPYL9只包含保守基序5(图4)。

表2 蒺藜苜蓿PYL蛋白15中不同的保守基序Table 2 Fifteen different motifs commonly observed in PYL proteins of M. truncatula
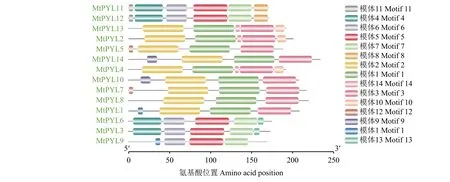
图4 蒺藜苜蓿 PYL 蛋白的保守 motif分布Figure 4 Distribution of conserved motifs of PYL proteins in M. truncatula
2.5 家族内部基因的重复事件分析
分析蒺藜苜蓿PYL基因的重复事件结果显示(表 3、 图 5), MtPYL4-MtPYL10, MtPYL5-MtPYL2,MtPYL2-MtPYL4,MtPYL7-MtPYL13的这4对基因表现为在共线性区域的共线性基因。MtPYL1,MtPYL3,MtPYL6,MtPYL8,MtPYL9表现为散在重复序列,MtPYL11,MtPYL9表现为染色体附近的重复(不相邻),未发现串联重复基因(图5、表3)。
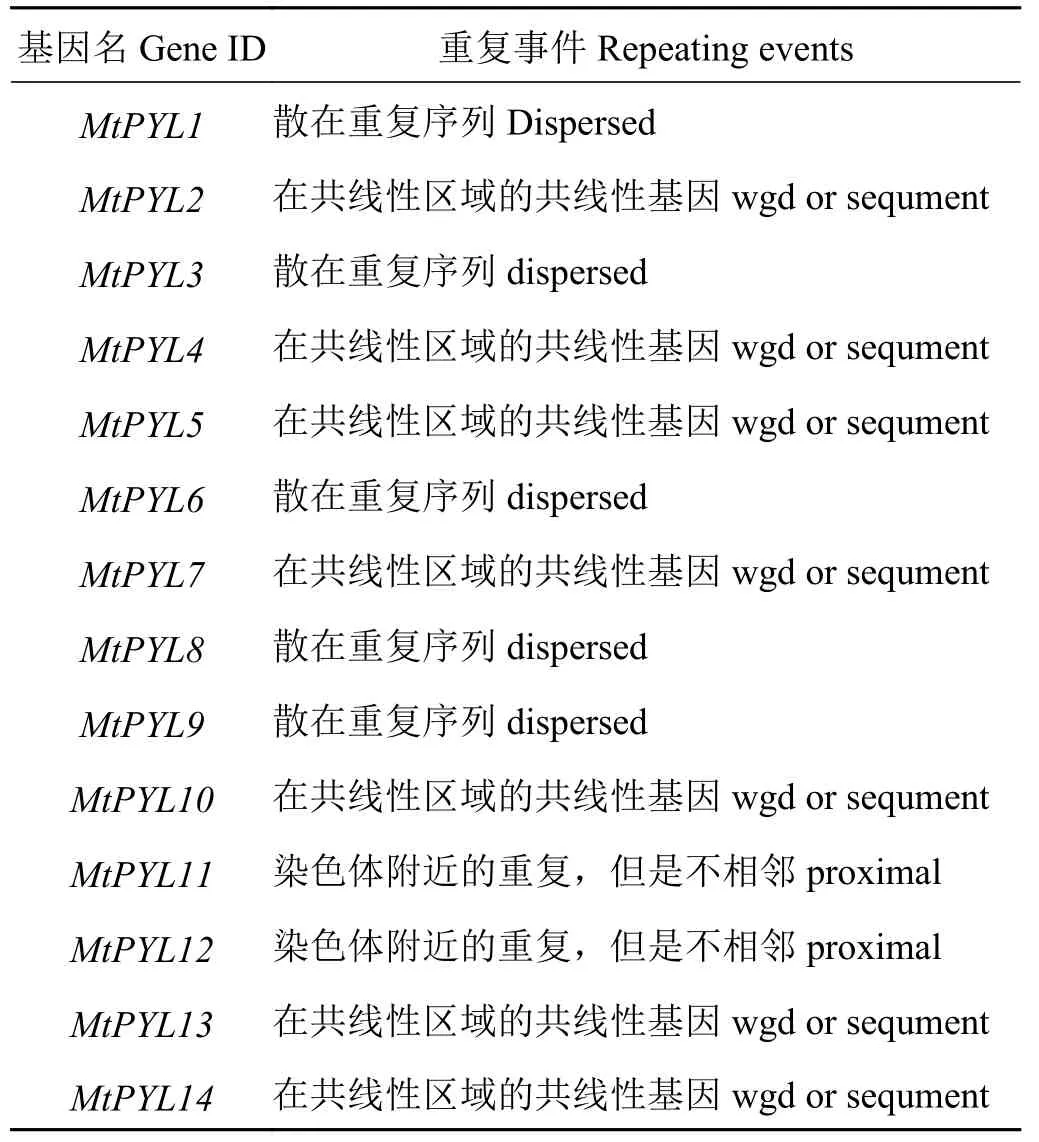
表3 蒺藜苜蓿 PYL 基因重复时间分析Table 3 Analysis of gene duplication time of PYL gene family members in M. truncatula

图5 蒺藜苜蓿PYL基因在共线性区域的共线性基因Figure 5 WGD/segmental analysis of PYL gene family members in M. truncatula
2.6 miRNA 分析
近年来,越来越多的人开始关注miRNA与mRNA之间的相互作用,已有研究表明,miRNA主要通过调节与植物胁迫相关的基因表达来应对外界胁迫。为了解参与蒺藜苜蓿PYL基因调控的miRNA,使用PStarget网站预测出了90个靶向14个蒺藜苜蓿PYL基因的miRNA,并构建了一个关系网络。分析调控网络的连接分布,发现MtPYL1和MtPYL5是成功靶向性最强的蒺藜苜蓿PYL基因,miR2630家族的26个家族成员都靶向MtPYL1和MtPYL5。除此之外,mtr-miR5248被鉴定为靶向两种蒺藜苜蓿PYL基因(MtPYL11,MtPYL12),mtr-miR2612被鉴定为靶向4种蒺藜苜蓿PYL基因(MtPYL1、MtPYL4、MtPYL7 和 MtPYL13)(图 6)。
2.7 顺式作用元件分析
顺式原件分析结果表明,在蒺藜苜蓿PYL启动子中鉴定到26种已知的与胁迫和激素相关的顺式作用元件。其中 HSE、MBS、TC-rich repeat、LTR、ARE和Box-W1是分别涉及植物对热、干旱、防御胁迫、低温、厌氧和真菌诱导反应的原件。分析结果显示,所有的14种蒺藜苜蓿PYL基因的启动子序列中至少包含3种参与与应激反应有关的顺式元件(图7),这表明蒺藜苜蓿PYL基因可能在应对各种胁迫中发挥重要作用。除此之外,14种蒺藜苜蓿PYL基因的启动子序列中还包含有0~4种类型的与激素响应有关的顺式元件,其中12个基因具有至少1个以上的与激素响应有关的顺式元件,包括生长素应答元件(TGA-element)、脱落酸响应元件(AuxRR-core)、乙烯响应元件(ABRE)、赤霉素反应元件(ERE)、水杨酸响应元件(P-box和TCA-element),这表明蒺藜苜蓿PYL基因可能在对激素的响应中也发挥重要作用。
2.8 基因本体论 (GO)分析及 PATHWAY 分析
对蒺藜苜蓿PYL基因进行GO分析显示,14个蒺藜苜蓿PYL基因在细胞成分(CC)类别的细胞质(GO:0005737)中富集,在分子功能(MF)类别的受体活性(GO:0004872)富集。在生物过程(BP)类别的脱落酸激活信号通路(GO:0009738)、信号传导(GO:0007165)和对外界压力的响应(GO:0006950)中富集。而KEGG通路分析显示,蒺藜苜蓿PYL基因主要参与植物激素信号转导。
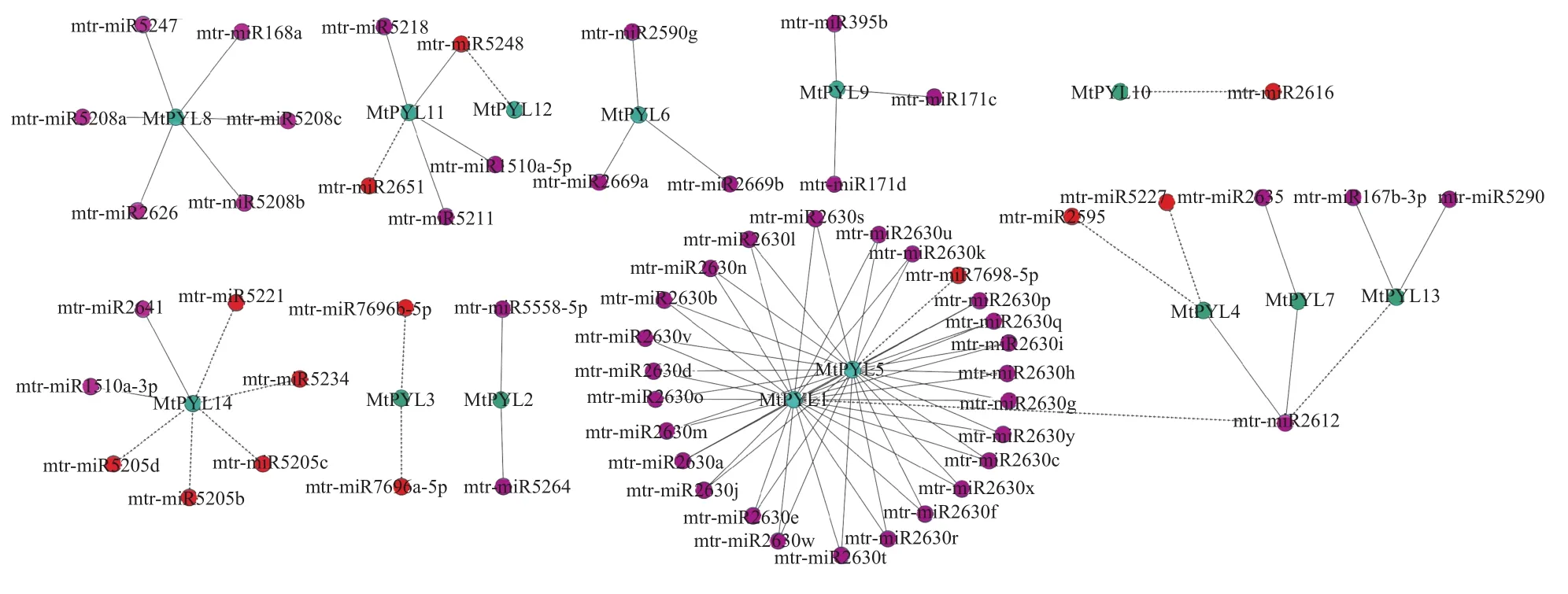
图6 蒺藜苜蓿 PYL 基因与 miRNA 的关系网络Figure 6 Regulatory network relationships between the putative miRNAs and their targeted MtPYL genes
The green circle is the MtPYLs, the purple circle is the miRNA with the expected 5 expectation, and the red circle is the miRNA with the expected 4 expectation. The smaller the expected value is, the higher the prediction accuracy is.
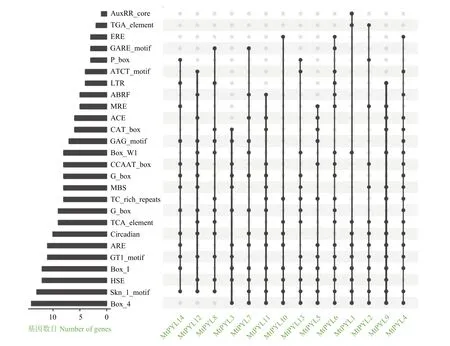
图7 蒺藜苜蓿 PYL 基因顺式原件分析Figure 7 Cis-acting elements in the promoters of each MtPYL gene
2.9 基因表达模式分析
利用蒺藜苜蓿 M. truncatula Gene Expression Atlas(MtGEA)Web服务器进行的组织表达分析结果表明,14个蒺藜苜蓿PYL基因在数据库中都有表达数据。聚类图中用红-白-蓝三色代表基因表达量的多少,红色色度越高代表基因表达量高,蓝色色度越高代表基因表达量越低。结果显示,MtPYL10与MtPYL14在根中特异性表达,MtPYL4在根中表达量最高,MtPYL1、MtPYL2、MtPYL5、MtPYL6、MtPYL11与MtPYL13在植物的各个组织都普遍表达,MtPYL3、MtPYL8、MtPYL9、MtPYL12 在植株的各个部位表达量都普遍偏低(图8A)。除此之外,我们还检测了盐胁迫下根发育过程中蒺藜苜蓿PYL基因的表达数据,结果表明,在盐胁迫下,表达量上调的基因有MtPYL12、MtPYL2和MtPYL5,表达量下调的基因有MtPYL14、MtPYL11、MtPYL13和MtPYL10。
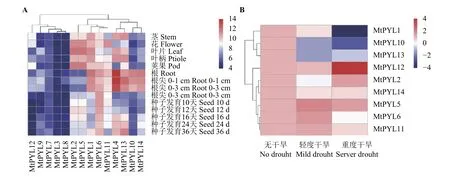
图8 蒺藜苜蓿PYL基因家族在不同组织中的表达量热图(A)和在干旱胁迫下的表达量热图(B)Figure 8 Heatmap showing members of PYL gene family in different tissues (A) and expression heatmap under drought stress (B)
2.10 RT-PCR 验证
通 过 蒺 藜 苜 蓿 M. truncatula Gene Expression Atlas(MtGEA)Web服务器上的表达数据选择在苜蓿不同部位都有明显表达的MTRPYL1、MTRPYL6、MTRPYL10、 MTRPYL11、 MTRPYL12、 MTRPYL13、MTRPYL14以及在不同盐浓度胁迫下具有响应模式的编辑MTRPYL2和MTRPYL5进行轻度干旱(3 h)与重度干旱(8 h)胁迫处理下RT-PCR,检测基因表达模式。结果显示,在轻度胁迫下大部分基因表现出显著下调的趋势(图8B),只有MTRPYL5和MTRPYL6基因表达量显著上调(P<0.05),重度干旱胁迫下大部分基因仍表现出显著的下调趋势,只有 MTRPYL2和 MTRPYL12显著上调 (P <0.05),特别是MTRPYL12上调倍数达5.3倍(图9),与蒺藜苜蓿MtGEA Web服务器上的数据表达模式基本类似。
3 讨论

图9 干旱胁迫处理后苜蓿PYL基因家族基因的相对表达量Figure 9 Relative expression of members of MtPYL gene family under drought stresses
植物激素ABA以植物生长和发育的调节以及对非生物和生物胁迫的响应两个功能而闻名[36]。作为ABA受体的PYL是下游ABA信号的第一步[37],并且是ABA信号转导途径中的重要元件。PYL基因家族在许多植物中已鉴定分离出来,本研究是首次鉴定到蒺藜苜蓿中的PYL基因。本研究在蒺藜苜蓿全基因组中鉴定出14个MtPYL基因,与拟南芥中的成员数量相同,多于水稻基因组中PYL的数量(12个)。通过复制事件分析发现,蒺藜苜蓿PYL基因家族成员中存在共线性区域的共线性基因,散在重复序列,染色体附近的重复(不相邻),未发现串联重复基因,推测这可能对蒺藜苜蓿PYL基因家族的扩展具有重要作用。此外,14个PYL蛋白具有不同的蛋白相对分子质量和不同的等电点,表明它们可能在不同的微环境中发挥其功能。
通过系统进化和基因结构等分析,蒺藜苜蓿PYL基因可被划分为4组,这种分类符合之前对拟南芥、水稻、欧洲油菜(Brassica napus)和短柄草(B. sylvaticum)中PYL的系统发育分析[38],其中3组中既有拟南芥的PYL基因家族成员,又有水稻的PYL基因家族成员,表明蒺藜苜蓿和拟南芥与水稻之间可能具有类似的进化轨迹。其中同源性较高的基因可能具有相似的功能,例如AtPYL8与MtrPYL12、MtrPYL15具有较高同源性,而AtPYL8基因与植物的侧根发育相关,推测MtrPYL12、MtrPYL15基因也可能与植物的侧根生长相关。但蒺藜苜蓿PYL基因在进化上又表现出差异性,暗示了其基因功能的多样性。通过保守基序分析鉴定出4个保守的基序,保守基序的长度在41~50个氨基酸范围内,大多数蒺藜苜蓿PYL基因包含两个保守基序,结合进化树分析,同一组的蒺藜苜蓿PYL基因具有非常相似的保守基序,这表明蒺藜苜蓿PYL基因具有高度保守的蛋白质结构。亚细胞定位预测显示蒺藜苜蓿PYL基因主要在细胞质上,这与拟南芥、水稻植物一致[6],这表明,PYL的功能在不同的植物种类中是保守的。通过GO与KEGG分析发现,14个蒺藜苜蓿PYL基因在脱落酸激活信号通路、信号传导和对外界压力的响应的过程中高度富集,这表明PYL基因在多个生物学过程中发挥着重要作用。
PYL基因家族作为ABA的受体,参与多种与ABA有关的生理反应,其中AtPYL4、AtPYL8、AtPYL9、 ZmPYL8、 ZmPYL9、 ZmPYL12 和 OsPYL5已经被相关试验成功验证。在本研究中,大部分蒺藜苜蓿PYL基因在根、茎、叶片、叶柄、花、荚果和种子等不同组织中广泛表达,表明它们可能参与多种生理反应,其中盐胁迫下蒺藜苜蓿PYL基因在根中的表达量与非胁迫条件下有明显差异,表明蒺藜苜蓿PYL基因可能参与盐胁迫反应。此外,启动子顺式原件分析显示在蒺藜苜蓿PYL基因启动子中检测到许多与胁迫有关的顺式元件,表明蒺藜苜蓿PYL基因的表达可由不同的胁迫诱导。通过RT-PCR分析发现,只有MTR_PYL5、MTR_PYL6、MTR_PYL2与 MTR_PYL12这 4种基因在干旱条件下显著上调(P<0.05),而大部分基因在受到干旱胁迫时下调表达,推测这可是负反馈调节机制[39]:当干旱胁迫下大量ABA在叶片中累积时,PYL表达可能被抑制,这进一步表明它们可能参与植物对干旱胁迫的响应过程。
4 结论
本研究在蒺藜苜蓿基因组中鉴定出14个PYL基因家族成员;通过对蒺藜苜蓿PYL基因进行基因结构、进化关系、保守基序和顺式原件等分析表明,蒺藜苜蓿PYL基因在植物应对非生物胁迫过程中具有重要作用;qRT-PCR分析结果也表明,蒺藜苜蓿PYL基因在干旱胁迫下具有明显的表达模式。总之,蒺藜苜蓿PYL基因家族作为ABA受体在蒺藜苜蓿抵抗逆境胁迫过程中是有作用的,但各成员的具体功能需要后续试验进一步验证。
