显微手术治疗Arnold-Chiari畸形的临床体会
2019-03-15孙郑春马旭东曹新亮
周 兴 孙郑春 马旭东 曹新亮 陈 龙
郑州市第一人民医院神经外科二病区,河南 郑州 450000
Arnold-Chiari畸形(Arnold-Chiari malforma-tion)是一种以小脑扁桃体下疝至椎管内为主要特征的先天性颅颈交界区畸形的疾病,伴或不伴脊髓空洞症,其发病机制目前尚未完全明确[1]。目前,Arnold-Chiari畸形的诊断标准:单侧或双侧小脑扁桃体最下缘超过枕骨大孔下方≥5 mm。并发症有脊髓空洞、脑干下疝、脑室扩张、枕骨大孔区骨性畸形(颅底凹陷、颅底扁平、寰枢脱位等)、椎体融合畸形(Kippel-Feil综合征)、脊柱侧弯、关节病等。治疗该病的手术方式多样,目的多为缓解枕骨大孔区和(或)颈椎对脑干、小脑、脊髓及后组脑神经受到的压迫。哪种术式为最佳外科治疗方法,目前仍无定论。本次研究总结郑州市第一人民医院2012-07—2017-06采取后颅窝小骨窗骨性减压术+硬脑膜扩大修补枕大池重建术治疗的Arnold-Chiari畸形43例患者的临床资料。
1 资料与方法
1.1一般资料本组43例患者,男24例,女19例;年龄17~66岁,平均37岁;发病年龄15~63岁,平均31岁;病程2个月~300个月,平均58个月。
1.2临床表现(1)外观畸形:斜颈、脖颈粗短4例。(2)脑干受压症状:病理反射8例。(3)后组脑神经、颈神经根受压症状:呛咳7例,吞咽功能障碍6例,声音嘶哑5例,颈部疼痛、活动受限19例。(5)小脑症状:共济失调13例,步态不稳17例,眼震2例。(6)合并脊髓空洞症36例,感觉分离21例,双上肢肌肉萎缩23例,肢体麻木19例。其中单一症状者10例(23.26%),合并症状33例(76.74%)。
1.3影像学资料43例患者给予X平片(颈部正侧位片、颈部过伸、过曲位片及张口位片),颅颈交界区CT三维重建及MRI检查,在确诊Arnold-Chiari畸形的同时排除寰枢关节脱位,确诊标准采用MEADOW等[2-4]的诊断标准:MRI示小脑扁桃体下疝在矢状位上低于枕骨大孔边缘5 mm以上。43例患者中合并脊髓空洞症36例(83.72%),脑干下疝10例(23.25%),颅底凹陷5例(11.62%),寰枕融合3例(6.98%),脑室扩张6例(13.95%)。
1.4手术方法全麻+气管插管成功后,左侧卧位,头钉头架固定妥当。取枕外粗隆下方1 cm至C4椎体棘突后正中直切口,依次切口皮肤、皮下,游离筋膜后取下2.5 cm×2.5 cm大小备用。垂直于中线切开并向两侧分离项枕肌,自动牵开器扩开肌肉,完全暴露枕鳞部、C1、C2椎体后弓和棘突。开颅钻于枕鳞部钻一孔,咬骨钳沿钻孔四周咬除枕鳞部骨质,咬除骨窗大小(2.5~3)cm×(2.5~3)cm,枕骨大孔开放后,咬骨钳将C1椎体后弓咬开1.5~2.0 cm。彻底止血后生理盐水冲洗术区,更换无菌手套。连接置于无菌保护膜中的术中彩超探头,将无菌探头放在硬膜外探测,可见蛛网膜下腔极狭窄,未见明显枕大池显示(图1A)。此时可见寰枕筋膜增厚明显(图2)。然后上手术显微镜。锐性切除已增厚的寰枕筋膜,显微剪刀“Y”字型剪开小脑和枕骨大孔处硬膜,此时应特别注意保持蛛网膜的完整性。打开硬膜后见脑压可,脑搏动可。硬膜四周各悬吊一针备用。取备用筋膜在硬膜悬吊状态下修补,以最大范围的重建枕大池。严密缝合后,再次置入无菌彩超探头,于硬膜外探测,可见蛛网膜下腔已恢复,测量蛛网膜下腔的间隙≥3 mm,枕大池重建满意(图1B)。清点物品彻底止血,取4 cm×4 cm免缝人工硬脑膜于硬膜外贴附以加固。不放置创腔引流管,清点物品,逐层缝合切口。
1.5随访方法术后1周、3个月、9个月、21个月及24~36个月随诊复查MRI,进行体格检查并咨询了解患者临床症状的改善情况,按复诊时间进行登记。按照TALOR等[5-7]的标准对手术疗效进行评估,症状明显改善为优,症状无明显变化为良,术后病情进展为差。
2 结果
本组无死亡病例。术后6例体温高于38.5 ℃且持续1周以上,腰穿证实颅内感染后给予抗感染治疗后痊愈;2例因脑脊液漏合并颅内感染给予腰穿置管外引流后痊愈;术后头痛11例,切口脂肪液化1例,给予对症治疗后均痊愈。无假性脑膜脑膨出、脑积水等手术并发症。术后平均随访24个月,根据Talor评估标准,其中35例(81.40%)为优,6例(13.95%)为良,2例(4.65%)为差。合并脊髓空洞症的36例患者,脊髓空洞明显缩小23例(63.89%),脊髓空洞无显著变化13例(36.11%),无加重病例。术前脑室扩张的6例病例,术后脑室扩张未进一步加重,给予动态复查。所有病例术后彩超测量显示,蛛网膜下腔间隙均≥3 mm,且术后MRI显示枕大池均重建满意(图3)。总有效率95.35%。
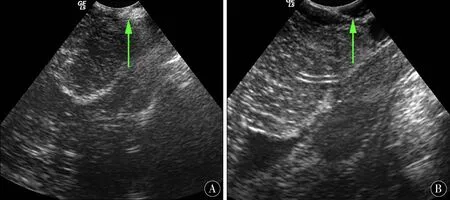
图1 A:未见明显枕大池(术前);B:枕大池重建后蛛网膜下腔间隙出现(术后)Figure 1 A:No obvious occipital pool;B:Subarachnoid space appears afterreconstruction of the occipital pool
3 讨论
Arnold-Chiari畸形(Arnold-Chiari malformation,ACM)是小脑扁桃体向下疝进椎管上段,可伴延髓及部分四脑室的疝入。据报道,在接受MRI检查的病人中,达到ACM诊断标准的可占0.5%~0.77%,起病较缓慢,女性多于男性,男∶女=1∶1.3~2.0。目前的诊断标准:单侧或双侧小脑扁桃体最下缘超过枕骨大孔下方≥5 mm;然而,部分学者认为,小脑扁桃体的下极若下移超过枕大孔3 mm即可诊断[8-11]。至CHIARI首次描述本病至今已有一百余年历史,尽管目前的诊断及治疗已取得很大进步,但该病的病因、发病机制目前尚未完全明确。目前多认为是脑在发育过程中后颅窝的容积相对较小,脑组织发育过度所致部分脑组织疝出枕大孔[1,12-15]。ACM有原发性和继发性,继发性ACM多发生在颅内占位性病变、腰大池腹腔分流术后,通常所说的ACM是指原发性ACM。ACM产生临床症状的根源:后颅窝容积有限,
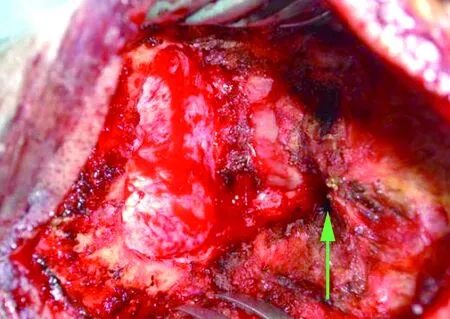
图2 咬除骨窗的大小及增厚的寰枕筋膜Figure 2 The size of the bone window and the thickened sacral fascia

图3 A:术前MRI;B:术后3个月复查可见,枕大池明显扩大,脊髓空洞消失Figure 3 A:Preoperative MRI;B:3 months after re-examination,the occipital pool is significantly enlarged and the syringomyma disappears
小脑扁桃体被挤进椎管内,导致枕骨大孔区阻塞;其发病机制按照后颅窝形态学上的研究,可推测为先天枕骨发育不良(后颅窝容积狭小),但脑组织正常发育,致后颅窝拥挤,从而引起小脑扁桃体下疝。ACM所导致脊髓空洞症的原因:小脑扁桃体被挤进椎管上段后压迫脊髓中央管,脑脊液循环通路障碍而导致的中央管扩张和积水[16-19]。ACM发病的基因学研究目前尚无确切结论,但目前已知的可疑基因有FGF2、PAX1 (20p11.2)、PAX2、PAX3等,基因学上的研究也在一定程度上支持ACM具有家族遗传因素。ACM的并发症较多,包括脊髓空洞、脑干下疝、脑室扩张、枕骨大孔区骨性畸形(颅底凹陷、颅底扁平、寰枢脱位等)、椎体融合畸形(Kippel-Feil综合征)、脊柱侧弯、关节病等。
ACM的临床分型:Ⅰ型:小脑扁桃体受挤压变形向下疝入枕骨大孔及椎管上端,延髓与四脑室位置正常,多伴脊髓空洞。该型最多见,多见于儿童及成年人。Ⅱ型:在小脑扁桃体下疝的基础上,合并脑干、四脑室及小脑蚓部向下移位。该型常伴不同类型的脑和脊髓发育不良以及脊髓脊膜膨出和脑积水。该型较少见,多见于儿童。Ⅲ型:小脑扁桃体下疝合并低枕部和(或)高颈段脑膨出。该型较罕见,为最严重的类型,多见于胚胎及新生儿,病死率极高。Ⅳ型:严重小脑的发育不全(先天无小脑扁桃体)。近年来,亦有学者在上述临床分型及基础上提出ACM0型:无小脑扁桃体下疝或达不到ACMⅠ型的诊断标准,但具有Arnold-Chiari畸形典型的症状,合并脊髓空洞症(影像学已排除导致脊髓空洞的其他原因),且行后颅窝减压术治疗后脊髓空洞症状明显好转,脊髓空洞明显缩小;ACM1.5型:在ACMⅠ型的基础上合并脑干下疝,但无小脑蚓部及四脑室下疝。对于小脑扁桃体下疝程度分级,即CTD分级为:CTD Ⅰ级:小脑扁桃体下疝超过枕大孔下方5 mm,但未到第一颈椎(C1)后弓上缘;CTD Ⅱ级:小脑扁桃体下疝下缘达到C1后弓水平;CTD Ⅲ级:小脑扁桃体下疝超过C1后弓下缘以下。
目前对于ACM出现临床症状的原因已达成共识,即后颅窝容积有限,小脑扁桃体被挤进椎管内,导致枕骨大孔区的阻塞,脑脊液循环通路被破坏。围绕着该原因得出手术治疗ACM的原则,即扩大后颅窝的容积,缓解枕骨大孔区的阻塞,恢复脑脊液的正常循环通路,解除脑干、小脑、脊髓及后组脑神经所受到的压迫从而恢复脑、神经、脊髓的功能。治疗方法首选后颅窝减压术。手术方法多样[20-22],包括单纯骨减压、后颅窝骨性减压+硬脑膜外层切开术、后颅窝骨性减压+硬脑膜扩大修补、后颅窝骨性减压+蛛网膜下腔粘连松解+硬脑膜扩大修补、后颅窝骨性减压+小脑扁桃体切除+枕大池重建术、后颅窝骨性减压+硬脑膜扩大修补+空洞-蛛网膜下腔分流术、空洞-蛛网膜下腔分流术、神经内镜手术治疗[23-27]。究竟哪种具体的手术操作为最佳外科治疗手段,目前的争论多在于减压骨窗的大小;是否应打开硬膜及蛛网膜;是否需要探查四脑室出口;是否需要切除小脑扁桃体;是否需要行空洞分流;同时进行扩大硬脑膜成形术是否更有效。目前多数学者认为,后颅窝大骨窗减压(骨窗可达6 cm×6 cm)[28-31],短期内压力得到充分缓解,手术效果明显,但手术使小脑扁桃体失去了骨性支撑作用,可造成远期小脑、脑干的进一步下疝,致临床症状复发甚至加重,而小骨窗减压不但保持了骨性结构对后颅窝内容物及硬脑膜的支撑作用,而且防止了后颅窝内组织的进一步下疝。目前颅颈交界区畸形诊疗专家共识[32-38]不主张采取后颅窝大骨窗减压,骨性减压窗建议采用小骨窗[高(2~3 cm)×宽(2.5~3 cm)];下疝的小脑扁桃体根据术中情况选择不处理或电凝使之皱缩或切除[39-42];硬脑膜成形术(枕大池重建)能显著改善临床症状,减少再手术率。
后颅窝小骨窗骨性减压术+硬脑膜扩大修补枕大池重建术的优势:(1)与传统的后颅窝减压相比(骨窗范围为上项线至枕骨大孔区,两侧乳突的根部),小骨窗骨性减压,局限范围内仅咬除枕骨大孔后唇和增厚的枕骨内嵴,即可达到使上段颈髓和延髓减压的目的,一定程度上缓解了后颅窝的拥挤,且后颅窝脑组织所受的支撑未收到影响。长期来看,小骨窗最低处将颈1椎体后弓仅咬开1.5~2.0 cm(第2颈椎后弓未波及),保持了第1颈椎、第2颈椎后弓的生理完整性,对颅颈交接区稳定性无影响,不会引起医源性寰枢关节脱位,且骨源性创伤较小,术后病人不需佩戴颈托保护颈椎并能早期下床活动,减少了卧床引起的一系列并发症,并缩短了平均住院周期。(2)硬脑膜扩大修补枕大池重建术能使蛛网膜下腔间隙恢复。硬脑膜显微镜下“Y”型剪开,剪开后颅窝脑组织及脑干所受的压迫即可以缓解,在剪开硬膜后(尽量剪至骨窗边缘)对硬膜四周各悬吊一针(最大范围悬吊起硬膜),再在硬膜被悬吊的状态下取备用自体筋膜扩大修补,因此状态下硬膜扩大修补范围最大且最松弛,最大范围地达到减张缝合目的,最大程度重建枕大池。此种缝合硬膜的方法,操作简易且不易损伤蛛网膜,耗时较短,缝合紧密,能有效避免血液渗入蛛网膜下腔。而使用自体筋膜则能避免人工硬膜直接附着于蛛网膜表面,引起术后的刺激性高热,且能更好地预防术后枕大池区粘连。枕大池重建成功后,蛛网膜下腔间隙恢复,脑脊液循环通畅,这也是手术是否成功的标志。本组病例均未打开蛛网膜,未切除小脑扁桃体,因考虑到切除小脑扁桃体后小脑后下动脉暴露在脑脊液中,可能会导致痉挛从而导致小脑梗死。
随着“精准医学”时代的来临,目前包括基层医院在内,神经外科均已配置了手术显微镜,肉眼下对脑和神经进行操作的时代已成为历史。后颅窝小骨窗骨性减压术+硬脑膜扩大修补枕大池重建术,切口较小,对颈部肌肉的损伤小,术中出血少,最大程度保持了生理性的骨性支撑,对颈部的稳定性无影响;采用显微镜下对增厚的寰枕筋膜进行处理,硬膜的缝合更加严密且创伤小。
