氘重氧水液相催化交换法氢正常化工艺研究
2019-03-14蒋琮琪
蒋琮琪,刘 严,肖 斌
(1.上海化工研究院有限公司,上海 200062;2.苏州联清生物科技有限公司,江苏 215434)
重氧水是重氧同位素的氢化物,物理和化学性质与普通水相似。重氧元素可以作为示踪剂广泛用于核医学显像、生物医药、环境监测、生命科学等领域。目前,重氧水广泛应用于核医学诊断领域,是PET正电子显像药物18F-FDG的主要合成原料,该药物通过回旋加速器轰击18O生成18F-,再经自动药物化学合成静脉注射剂。
国内重氧水的主要生产方法是水精馏法,该方法在富集重氧(18O)元素的同时富集氘(D)元素,得到含氘重氧水(HD18O)。氘元素是常用的减速剂,在回旋加速器内轰击重氧元素时,如果有氘元素存在,会使产品产率大大降低。而且在精馏生产18O的过程中,氘含量增加会引起氧-16/氧-18分离系数显著减小,增加分离难度[1]。所以需要将氘重氧水中的氘元素变成氢元素,去除氘元素的过程为氢正常化。
目前,国内重氧水氢正常化通过电解装置使氘重氧水产生重氧气体和重氢气体,去除重氢气体后将重氧气体经分离、冷却、干燥后与高纯氢气经催化化合反应生成重氧化氢气体,再冷凝成产品重氧水。该方法对装置的气密性要求极高,流程复杂、极易发生爆炸。利用电解使重氧水氢正常化生产成本高,安全风险大,有待开发一种流程简单,安全经济的方法。
液相催化交换法(LPCE)是气态氢同位素与液态水之间进行氢同位素交换,从水中分离氢同位素的有效方法之一,目前主要用于含氚重水提氚、重水升级、含氚废水脱氚以及重水生产等领域[2]。利用液相催化法进行含氘重氧水氢正常化研究还未见相关报道。本研究采用LPCE处理含氘重氧水,将含氘重氧水通过装有疏水催化剂Pt/C/PTFE与亲水填料的反应交换柱,与高纯氢气体进行同位素交换反应,使含氘重氧水氢正常化。本实验系统研究了低氘浓度下的氘重氧水液相催化交换法氢正常化工艺,为进一步开展高氘浓度氘重氧水液相催化交换法氢正常化工艺研究提供依据。
1 主要材料与仪器
1.1 主要仪器
兰格蠕动泵-BT300-2J、耐热石英交换柱-Φ32 mm×1 500 mm、朗凡MF4008气体质量流量计、GC8800H气相色谱仪:上海科创色谱仪器有限公司;DHFY-10/10恒温反应浴:上海科兴仪器有限公司。
1.2 主要材料
自制1%(重量百分比)Pt/C/PTFE疏水催化剂、Φ2 mm×2 mm Dixon填料、蓝色硅胶干燥剂、氘重氧水(18O:97%,D:1%)、高纯氢(99.999%)。
2 实验方法
2.1 实验原理
氢水同位素液相催化交换法操作方便、安全、节能,其核心是疏水催化剂,常用的疏水催化剂有Pt/C/PTFE和Pt/SDB。氢水同位素液相催化交换的工艺关键设备是催化交换柱,催化交换过程分为气液相转变和气相催化交换,以H2-HD18O同位素交换为例,催化交换过程[3]为:

(a)
该过程可分为两步:

(b)

(c)
反应式(b)为气液相转变过程;反应式(c)为气相催化交换反应,是总反应过程的速率控制步骤。g代表气相,l代表液相,v代表蒸汽相。
2.2 实验流程
实验反应流程图示于图1。将含氘重氧水经预热器预热后从交换柱顶部进入交换柱内,高纯氢气体经预热器预热后从交换柱底部进入交换柱内,高纯氢与含氘重氧水在交换柱内进行催化交换反应,分析交换柱顶部氢气中的氘含量。每组实验开始前和结束后,用高纯氮气吹扫交换柱20 min。
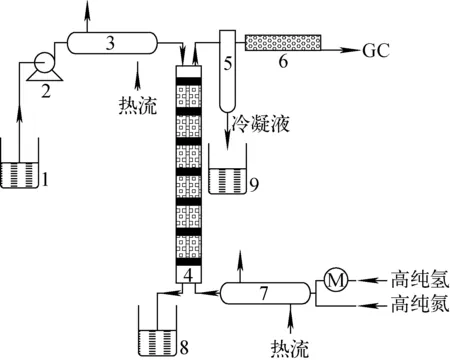
1——原料储罐;2——恒流泵;3、7——预热器;4——催化交换柱;5——气液分相罐;6——干燥管;7——预热器;8——产品收集罐1;9——产品收集罐2 图1 实验流程图1——Material tank;2——The constant flow pump;3、7——Preheater;4——Catalytic exchange column;5——Gas-liquid split tank;6——Drying tube;8——Product collecting tank1;9——Product collecting tank2Fig.1 Flow diagram of the experiment
2.3 实验条件
含氘重氧水(18O:97%,D:1%;L=0.1 kg/h)通过预热器进入交换柱,交换柱内径32 mm,长1.5 m,由耐热石英加工而成,交换柱中装填7段疏水催化剂(Pt/C/PTFE)和亲水填料(Dixon填料),装填比30%,每段疏水催化剂高65 mm,交换柱外设有加热套控制反应温度,反应温度30~70 ℃,高纯氢气(D:0.015%)通过预热器从交换柱底部进入交换柱,气液摩尔比0.5~3.0。交换柱出口氢气经气液分离后,取样经GC8800H分析氘含量。
3 结果与讨论
3.1 理论关系推导
总体积传质系数(Kya)是液相催化交换反应进行的量度(即氢同位素与液态水间发生同位素交换的总量)表征方法之一。Kya表示在固定体积的催化交换柱中单位时间单位催化床体积转移某种氢同位素的量。逆流交换柱中:
(1)
式中:F为氢气线速度,m·s-1;h为催化层的有效高度,m;NTU为传质单元数。
(2)
G*(yt-yb)=L*(xt-xb)
(3)
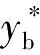
Kya在工艺技术方面的实用性强,通过Kya衡量重氧水液相催化交换法氢正常化工艺的技术参数(温度和气液比)对除氘效果的影响,Kya值越大,单位时间单位催化床体积转移某种氢同位素的量越多,催化转化的效果越好,氘重氧水氢正常化的效果也越好。
分离系数α为液相中氘和氢的摩尔数比与气相中氘和氢的摩尔数比的比值:
(4)
以H2-HD18O交换反应为例:
(5)
式中:K为平衡常数;x为液相中的氘含量;y为气相中的氘含量。理想状态下,反应物和生成物浓度:[HD]=2y(1-y),[H218O]=(1-x)2,[H2]=(1-y)2,[HD18O]=2x(1-x),则有:
(6)
根据平衡常数和分离系数的定义,两者存在一定区别,仅在每种分子中只有一个可交换原子的氢同位素交换反应时,α=1/K成立,在高温或较低氘浓度时,分离因子α=1/K[4]。
对于H2-HD18O气相催化交换反应(c),催化交换平衡常数Kv-g由统计热力学计算出与温度的关系式[5]:
(7)
对于HD18O-H218O气液相反应(b),根据其定义以及拉乌尔公式,得出:
(8)

Hook给出的三参数数据列于表1[6],方程如公式(9):
(9)

表1 Hook三参数数据[6]Tabel 1 W. Alexander Van Hook A, B, C value[6]
由公式(9)及表1数据可得:
(10)
(11)
K=Kg-v*Kv-l=1.363 9*
(12)
(13)
温度-分离系数曲线示于图2。分离系数α随温度升高而降低,α在283.15~353.15 K的变化趋势结果表明,交换温度越高,氘元素越容易向气相中转移。

图2 温度-分离系数曲线图Fig.2 Influence of temperature on α
3.2 温度对总传质系数的影响
温度与总体积传质系数的关系示于图3。从理论上分析,温度升高,分离系数越小,氘越容易向气相转移。从图3结果可知,温度较低时,总体积传质系数随温度升高而升高,此时不论是气液相转变过程还是气相催化交换过程,升高温度均能提高交换过程的平衡常数,所以交换柱内的总体积传质系数增大。在实际操作条件下,总体积传质系数不仅受温度影响,同时也受其他因素影响,温度超过60 ℃后,Pt/C/PTFE催化剂达到最佳使用温度,继续升高温度,水相的汽化量增加,阻碍液体水的下流及均匀分布,影响传质效果,故H2-HD18O催化交换反应温度以60 ℃为宜。
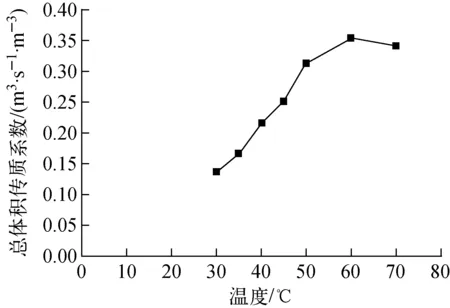
图3 温度-总体积传质系数图Fig.3 Influence of temperature on Kya
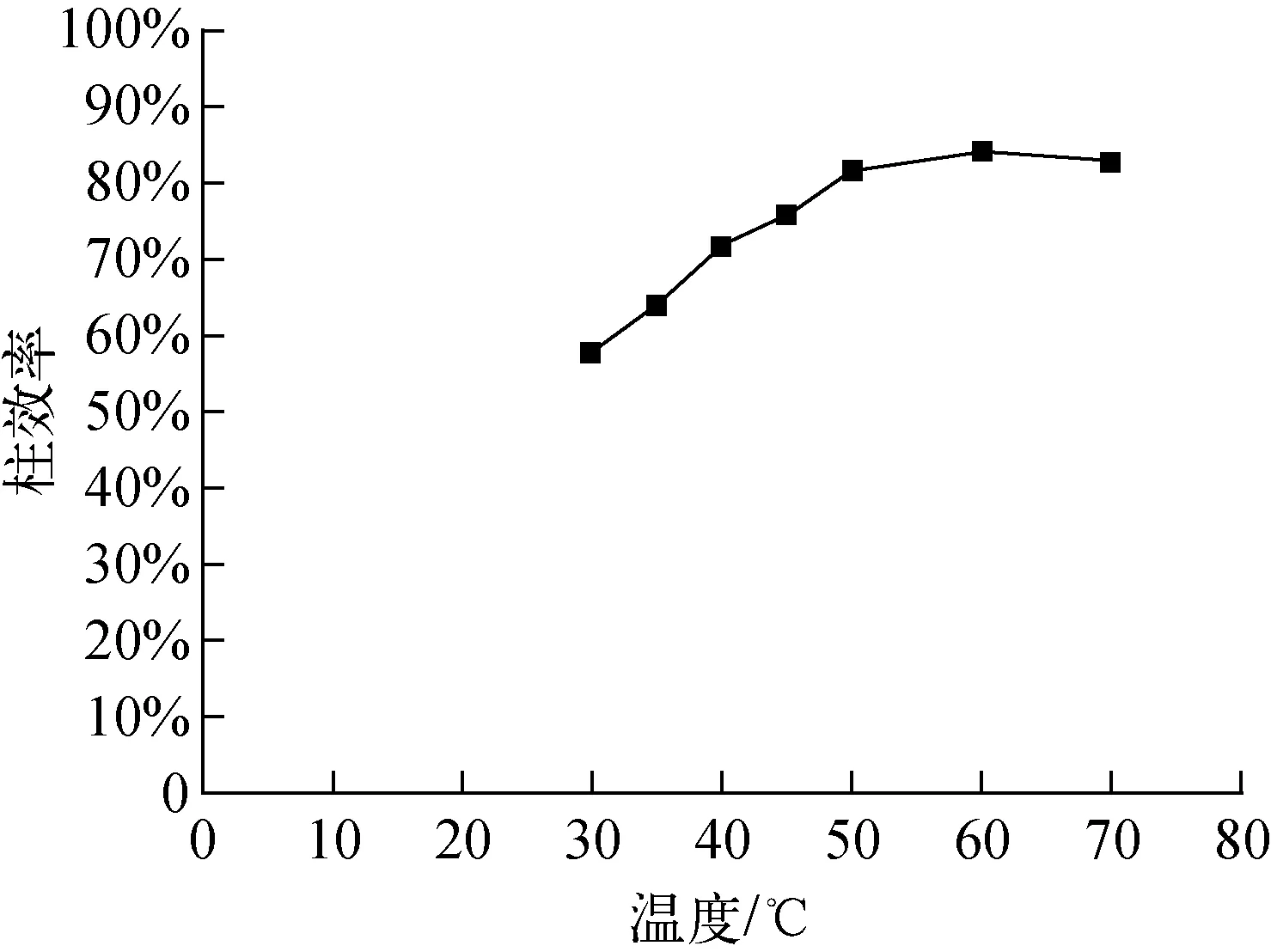
图4 温度-柱效率曲线图Fig.4 Influence of temperature on η
3.3 气液比对总体积传质系数的影响
液体流量为0.1 kg/h,气液比对Kya的影响结果示于图5。由图5结果可知,当气液比大于2,总体积传质系数的增长速度减缓。这是因为气液比的增大能够提升总体积传质系数,但不能任意加大气液流量,对于一个固定直径的交换柱,它对液体处理量的大小由交换柱的液泛系数决定,而液泛系数跟交换柱装填的填料比表面积、装填方式、空塔气速有关,如果盲目增大气液流量,一是会导致气液流速过快,交换柱内气液接触时间过少,交换效率降低;二是气液流速越大,水汽夹带现象越严重,交换柱内会发生液泛,交换柱的传质效率就会大大下降。从实验结果分析,在不发生液泛的前提下,气液比越大,氘重氧水氢正常化效果越好。
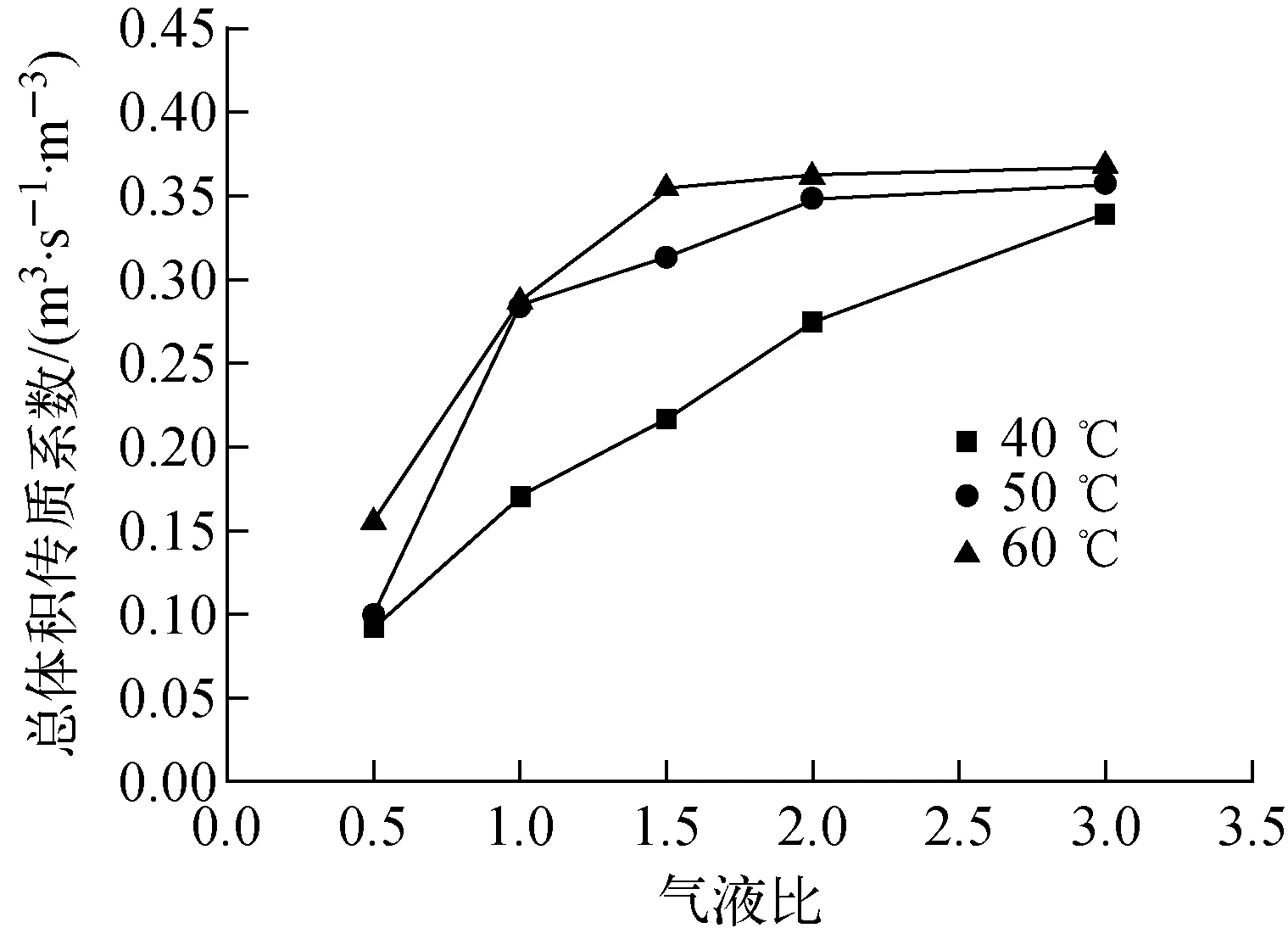
图5 气液比对Kya的影响Fig.5 Influence of G/L ratio on Kya
4 小结
(1) 随着温度升高,含氘重氧水除氘过程的总体积传质系数Kya值先变大后变小。温度超过60 ℃后,水相的汽化量增加,阻碍液体水的下流及均匀分布,从而影响H2-HD18O传质效果,故最优交换温度为60 ℃。
(2) 气液比越大,H2-HD18O总体积传质系数Kya越大,氘重氧水的除氘效果越好,但不能盲目增大气液比,气液比越大越容易造成液泛,同时过大的气液比会减少气液两相接触时间,降低交换效率。
致谢:感谢高级工程师秦川江在液相催化交换理论方面给予的指导;感谢工程师池毅在实验装置搭建的过程中给予帮助;感谢高级工程师李猷在样品检测方面提供的方便。
