偕胺肟聚丙烯腈对铀酰离子吸附热力学及动力学过程分析
2019-03-14马福秋矫彩山
韩 磊,马福秋,薛 云,矫彩山
(哈尔滨工程大学 核科学与技术学院,黑龙江 哈尔滨 150001)
目前除铀技术包括离子交换、膜分离、反渗透、化学沉淀等。离子交换法会产生过量的再生废液、周期较长、耗盐量大,有机物的存在会污染离子交换树脂,排出大量含盐废水易引起管道腐蚀,此外,对于溶液中存在多种离子时,需要针对不同的目标离子选用不同的树脂,普遍适用性差。膜在压力下会被栓塞、污染、断丝,必须定期舒塞、清洁、检查,后期运营成本高,且容易二次污染。化学沉淀法的净化效率受废水pH、沉淀剂用量、沉淀剂混合均匀程度等影响较大,适用于处理盐度和活度低,净化要求不高的大体积低放射性废水,其去污因子和浓度倍数较低,产生的污泥体积较大时需进一步处理以防止二次污染[2]。在物理化学处理中,吸附法易于操作,并且在高溶质负载或稀释浓度下从流出物中去除吸附质非常有效[2]。近年来,研究者将注意力集中在具有金属结合能力和低成本的各种吸附剂上,如壳聚糖,沸石,粘土或某些具有吸附能力的物质[3]和偕胺肟聚丙烯腈(AO-PAN)[4]。据报道,AO-PAN由于其高含量的偕胺肟官能团而具有高吸附金属离子的潜力[5]。从纯化、环境和放射性废物处理的角度来看,将U(Ⅵ)吸附到AO-PAN可行[6-7]。
研究初始浓度,吸附时间和吸附温度对AO-PAN吸附U(Ⅵ)的影响。通过系统的吸附实验研究AO-PAN对U(Ⅵ)的吸附,进行等温线、热力学、动力学以及吸附速率控制机理模型分析,了解AO-PAN在吸附U(Ⅵ)过程中的相关特性。在三个温度条件下进行吸附实验,系统研究在不同温度条件下的等温线、动力学特征,在三个温度条件下分别研究吸附的速率控制机理,比较系统的分析吸附过程的控制步骤,研究结果可为动态吸附实验以及实际处理废水提供参考。
1 实验装置和材料
1.1 实验装置
电感耦合等离子体发射光谱仪(ICP-AES):Thermo Fisher公司;TS-111C卧式恒温振荡器:上海安竞实验设备有限公司;元素型1840A摩尔∑H2O超纯水机:上海库勒科学仪器有限公司;KQ5200E超声清洗器:昆山市超声仪器有限公司;pHS-3E雷磁pH计:上海精科仪器厂;T-214分析天平:北京赛多利斯仪器系统有限公司。
1.2 实验材料
聚丙烯腈:大庆石化公司腈纶厂;羟胺溶液:萨恩化学技术(上海)有限公司;六水合硝酸铀酰:湖北楚盛威化工有限公司;氨水、硝酸:国药集团化学试剂有限公司;甲醇:天津市富宇精细化工有限公司。以上试剂均为分析纯。
2 实验方法
2.1 AO-PAN制备
将羟胺溶液加入纯水中,添加一定量的甲醇,然后缓慢倒入一定质量的聚丙烯腈(PAN)粉末。将该体系置于恒温(50 ℃)摇床中反应。将得到的混合体系过滤、洗涤、干燥得到偕胺肟聚丙烯腈(AO-PAN)粉末。
2.2 吸附材料表征
利用扫描红外光谱与扫描电子显微镜对AO-PAN进行表征。将改性前的PAN与改性后的AO-PAN分别进行表征,并进行对比。
2.3 吸附实验
将六水合硝酸铀酰固体溶解在去离子水中配成指定浓度的铀酰离子溶液,用氨水和硝酸调节溶液pH,最后将给定浓度,pH和体积的硝酸铀酰溶液加入含有AO-PAN的螺口锥形瓶中,在卧式恒温振荡器中进行吸附,通过电感耦合等离子体原子发射光谱法(ICP)测定溶液中U(Ⅵ)的浓度,AO-PAN对U(Ⅵ)的吸附量通过下式计算:
(1)
式中:qe为吸附量,mg/g;C0和Ce分别为初始和平衡时U(Ⅵ)的液相浓度,mg·L-1;V为溶液的体积,L;m为所用干燥吸附剂的质量,g。
2.4 吸附热力学
吸附等温线是在一定温度下溶液中吸附质平衡浓度与吸附剂表面累计吸附量之间的关系曲线。应用较广泛的吸附等温线模型主要有朗格缪尔(Langmuir)模型、弗罗因德利希(Freundlich)模型。
2.4.1Langmuir模型
Langmuir模型是在设定温度下分子在吸附剂表面覆盖至聚集的程度,主要基于如下假设:仅发生单分子层吸附,每个分子只占据一个吸附位;吸附质分子之间不存在相互作用;吸附剂表面具有均匀的吸附能,吸附过程中具有相等的能量和焓,表面的各个吸附点之间没有吸附质的转移运动;达到平衡状态时,吸附和脱附速率相等。其方程形式如下[7-9]:
(2)
式中:Ce为平衡时U(Ⅵ)的液相浓度,mg·L-1;qe为吸附平衡时的吸附容量,mg·g-1;qm为最大吸附容量,mg·g-1;kL为与吸附有关的Freundlich吸附平衡常数,L·mg-1。
2.4.2Freundlich模型
Freundlich模型假设吸附剂表面吸附位点是非均匀分布的,适用于描述中低浓度吸附质的吸附过程,在极低或极高浓度时该模型不适用。Freundlich等温方程是一经验方程,其适用范围较广泛,能够描述有机、无机化合物在许多吸附剂包括生物吸附剂上的吸附情况。方程如下[10-12]:
(3)
式中:Ce为平衡时U(Ⅵ)的液相浓度,mg·L-1;qe为吸附平衡时的吸附容量,mg·g-1;kF为与吸附有关的Freundlich吸附平衡常数,mg·g-1;n为非线性系数,n值大小代表吸附剂对吸附质的吸附强度。
2.5 吸附焓变
结合热力学平衡常数和反应吉布斯自由能ΔG、焓变ΔH、熵变ΔS之间的基本关系,可以计算相关的热力学数据[8-9]:
(4)
其中:
(5)
式中,C0和Ce分别为初始和平衡时U(Ⅵ)的液相浓度,mg·L-1;V为溶液的体积,L;m为所用干燥吸附剂的质量,g。
2.6 吸附动力学
为了研究吸附剂的吸附机理及可能的速控步骤,利用动力学模型对实验数据进行分析和拟合[13-15]。
2.6.1准一级动力学
准一级动力学模型(物理吸附):
ln(qe-qt)=lnqe-k1t
(6)
式中:k1为准一级动力学常数,h-1;t为反应时间,h;qe为平衡吸附量,mg·g-1;qt为t时刻的吸附量,mg·g-1。以ln(qe-qt)对吸附时间t作图,得一条直线,直线斜率的倒数为准一级动力学常数k1,在纵轴上的截距为吸附剂平衡吸附量的自然对数。
2.6.2准二级动力学
准二级动力学模型(化学吸附):
(7)

2.7 吸附速率控制机理
2.7.1液膜扩散模型
液膜扩散模型[13,15]可以确定吸附质从液相到达吸附剂边界的传质过程,假设吸附阻力全部集中在吸附剂的边界,方程描述如下:
ln(1-F)=-kt
(8)
式中:F=qt/qe,为t时刻的吸附程度;k为液膜扩散速率,h-1。
2.7.2颗粒内扩散模型
颗粒内扩散模型[13,15]假定液膜扩散阻力可以忽略或只在吸附初始阶段起作用,且作用时间很短,吸附过程为颗粒内扩散过程,方程如下:
qt=Kdt1/2+y
(9)
式中:Kd为内扩散速率,mg·g-1·h1/2;y为拟合直线截距,代表吸附剂表面的界面层厚度。
若上述两种模型中任一种模型的线性拟合曲线通过原点,则该模型代表吸附过程的速率控制步骤[15]。
3 结果与讨论
3.1 吸附材料表征
实验得到红外谱图示于图1。由图1结果可知,在2 245 cm-1处存在很强的吸收峰,为PAN粉末中的—C≡N,而在AO-PAN中该处吸收峰强度减弱,表明改性后—C≡N在粉末中的含量变小。在1 651 cm-1与930 cm-1处很强的吸收峰对应AO-PAN粉末中的—C=N和—N—O官能团的伸缩振动。以上红外谱图的变化说明PAN中的—C≡N与羟胺反应生成了偕胺肟官能团。

图1 PAN与AO-PAN的红外谱图Fig.1 FT-IR spectra PAN and AO-PAN
扫描电子显微镜图示于2。从图2结果可以看出,改性后聚丙烯腈的微观直径明显大于改性前的聚丙烯腈微观直径,这在动态吸附实验过程中会减少流体阻力,有利于柱子连续运行。虽然改性后的微观颗粒变大,但直径在微米范围内,保证了材料与溶液的接触面积,使吸附可以有效进行。
3.2 吸附实验
3.2.1吸附温度
不同温度下AO-PAN对U(Ⅵ)的吸附量列于表1。由表1数据可以看出,随着吸附温度升高,AO-PAN对铀酰离子的吸附量逐渐升高,表明该吸附反应需要一定的活化能,只有当溶液中铀酰离子运动的平均能量超过活化能,该反应才能够进行。该吸附反应的温度变化在298~343 K范围内,可以近似认为在该反应区间内活化能是与温度无关的常数。温度越高溶液中铀酰离子运动越剧烈,超过活化能的铀酰离子数越多,反应进行的程度越大,AO-PAN对铀酰离子的吸附量随温度升高而逐渐增大。吸附时间足够长(120 h),不同温度下的吸附量存在很大差别,温度越高吸附量越大。

a——AO-PAN 5 000倍图像;b——PAN 3 000倍图像;c——PAN 5 000倍图像图2 PAN与AO-PAN的扫描电子显微镜图像a——AO-PAN scanning of 5 000 times;b——PAN scanning of 3 000 times;c——PAN scanning of 5 000 timesFig.2 Scanning electron microscope image of PAN and AO-PAN

温度/K298303313323333343累积吸附量/(mg·g-1)99.84 117.7 122.4 146.6 153.3 201.6
注:溶液pH=2.5,初始U(Ⅵ)为100 mg·g-1,溶液体积100 mL,吸附时间48 h。
3.2.2吸附时间
溶液pH=2.5,初始U(Ⅵ)为100 mg·g-1,溶液体积150 mL时,不同温度条件下AO-PAN对U(Ⅵ)的吸附量随时间的变化曲线示于图3。由图3结果可知,不同温度条件下AO-PAN对U(Ⅵ)的吸附容量随吸附时间的增加而逐渐增加,其中在303 K和298 K温度条件下的吸附量差别很小,可能是温度差较小,吸附容量差别较小。初始吸附时AO-PAN并没有铀酰离子,溶液中铀酰离子浓度较高,吸附速率较快;随着吸附逐渐进行,AO-PAN不断吸附铀酰离子,已经吸附上去的铀酰离子对溶液中的铀酰离子具有一定的排斥作用,使吸附速率逐渐降低,在吸附48 h时吸附趋于平衡。
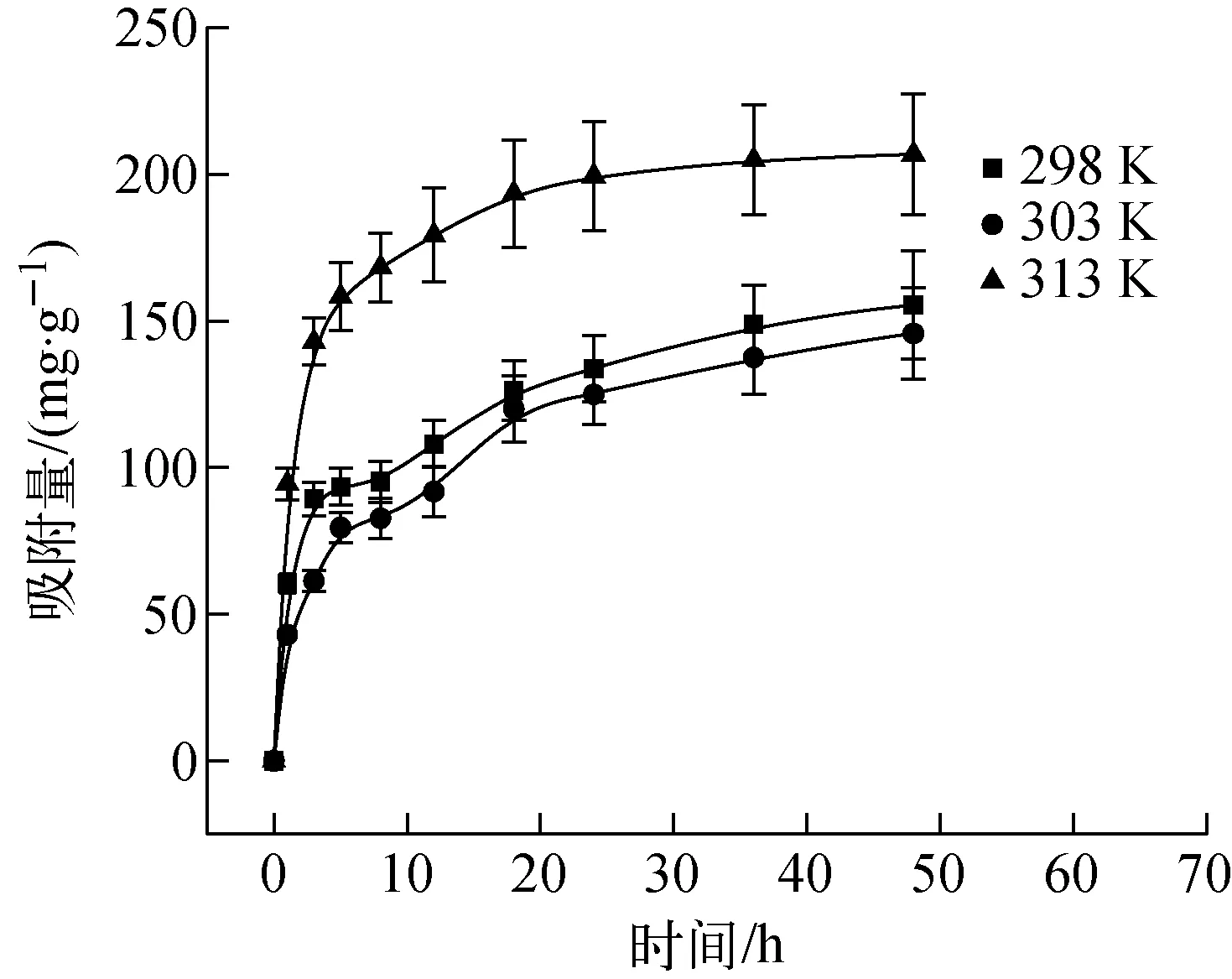
图3 不同温度条件下AO-PAN对U(Ⅵ)的吸附量随时间的变化曲线Fig.3 Curve of adsorption of U(Ⅵ) by AO-PAN with time under different temperature conditions
3.2.3溶液中初始U(Ⅵ)浓度
溶液pH=2,溶液体积100 mL,吸附时间48 h,初始吸附浓度0~500 mg/L时,不同温度条件下AO-PAN对U(Ⅵ)的吸附量随溶液中初始U(Ⅵ)浓度的变化曲线示于图4。由于测定不同初始浓度时,为了避免铀酰离子沉淀,因此采用的是比较低的pH。从图4结果可以看出,不同温度条件下AO-PAN对U(Ⅵ)的吸附容量随初始U(Ⅵ)浓度增加而增加,表明随着初始U(Ⅵ)浓度增加,溶液中自由移动的铀酰离子也增多,铀酰离子与AO-PAN之间碰撞的频率逐渐增加使得铀酰离子更容易与AO-PAN的活性位点结合,有利于AO-PAN对U(Ⅵ)的吸附。在303 K时,AO-PAN对铀的吸附量大于313 K时的吸附量,与温度影响的实验结论矛盾,可能是研究溶液中初始浓度影响时溶液pH为2,其他实验因素溶液的pH为2.5,溶液中H+浓度较高,当温度达到313 K时氢离子的运动加剧,会和溶液中铀酰离子形成竞争吸附,AO-PAN对铀酰离子的吸附量低于303 K时的吸附量。
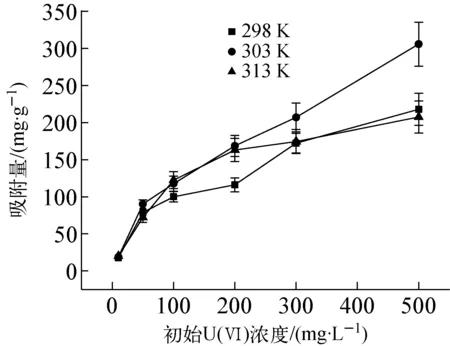
图4 不同温度条件下AO-PAN对U(Ⅵ)的吸附量随初始U(Ⅵ)浓度的变化曲线Fig.4 Curve of adsorption of U(Ⅵ) by AO-PAN with initial U(Ⅵ) concentration under different temperature conditions
3.2.4吸附pH
当溶液浓度约100 mg/L时,溶液pH为5时,会出现沉淀,进行icp(电感耦合等离子体发射光谱)测量时沉淀会堵塞设备进料孔,材料对铀的吸附容量利用溶度差计算法,而icp测量溶液的主体溶度。无法测量沉淀下来的铀,根据溶度差计算材料对铀的吸附量时会得到错误结论。考虑上述因素,进行补充pH影响实验时,采用低浓度溶液进行实验。初始U(Ⅵ)为1 000 μg/L,溶液体积500 mL,吸附时间48 h时,不同温度条件下AO-PAN对U(Ⅵ)的吸附量随溶液pH的变化曲线示于图5。

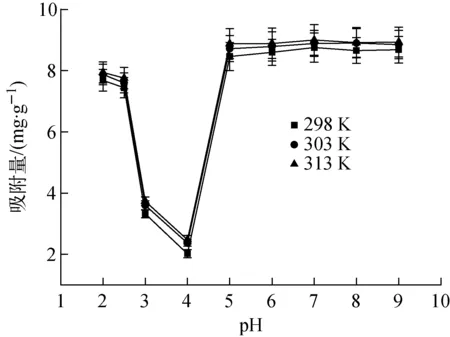
图5 不同温度条件下AO-PAN对U(Ⅵ)的吸附量随初始溶液pH的变化曲线Fig.5 Curve of adsorption of U(Ⅵ) by AO-PAN with pH value of initial solution under different temperature conditions
3.3 吸附热力学
AO-PAN吸附U(Ⅵ)在298、303、313 K条件下的模型拟合参数列于表2。当n为1~10时,吸附容易进行,且n值越大吸附剂与吸附质的相互作用越强。当n=1时,吸附剂所有吸附位具有相同的吸附能,此时吸附过程为线性吸附。由表2数据可知,Langmuir模型和Freundlich模型拟合相关系数较大,表明其对模型的拟合程度较好,Langmuir方程对AO-PAN吸附U(Ⅵ)的拟合相关系数高于Freundlich模型,且其理论吸附容量qm更接近实验值,说明AO-PAN对U(Ⅵ)的吸附更倾向于单分子层吸附。
3.4 吸附焓变
在不同温度条件吸附实验的基础上,计算吸附过程的ΔH、ΔG、ΔS,结果列于表3。由表3数据可知,ΔH>0表明吸附是吸热过程,ΔS>0表明吸附熵增过程,随着吸附进行,体系的混乱程度增加,ΔG<0(298 K)表明吸附反应自发进行,根据吉布斯自由能计算式ΔG=ΔH-TΔS,其中ΔH>0,ΔS>0,表明随着吸附温度的升高反应自发性程度更高。
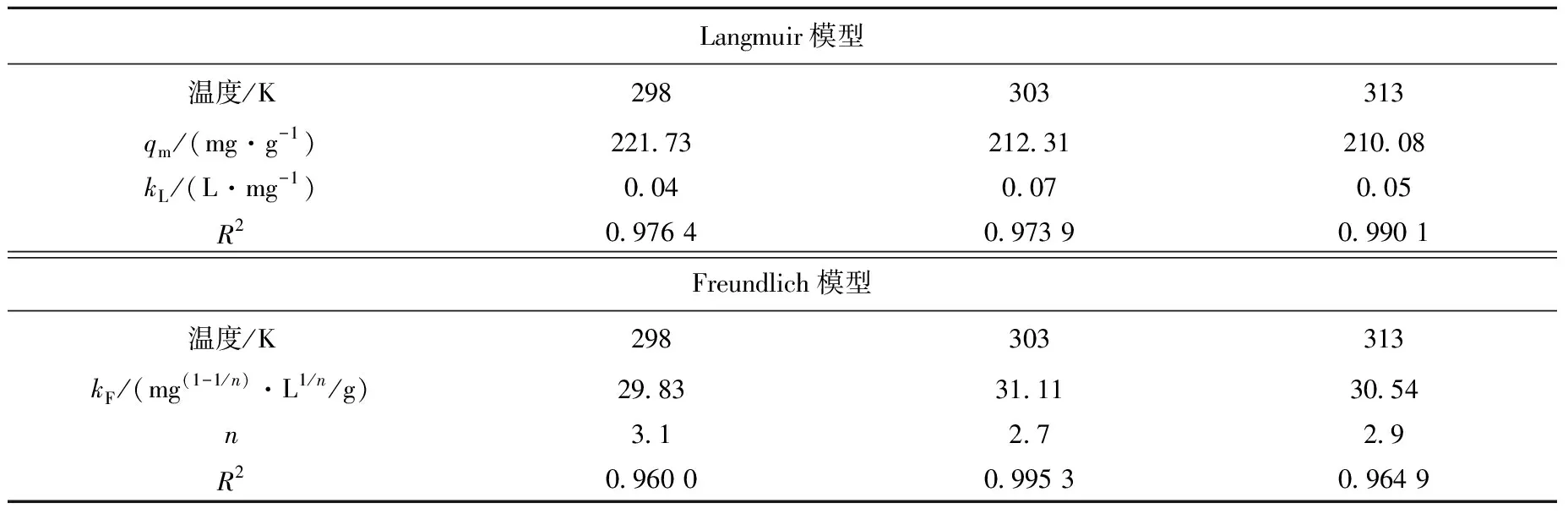
表2 AO-PAN在不同温度下吸附U(Ⅵ)的等温吸附方程拟合参数Table 2 Isothermal adsorption equation fitting parameters of AO-PAN adsorbed U(Ⅵ) at different temperatures

表3 AO-PAN吸附U(Ⅵ)过程的焓变过程拟合参数Table 3 Fitting parameters of the enthalpy change-process of the AO-PAN adsorption U(Ⅵ) process
3.5 吸附动力学
AO-PAN吸附U(Ⅵ)在298、303、313 K温度条件下的动力学模型拟合参数列于表4。由表4数据可见,三个温度条件下准二级方程的拟合程度较高,并且饱和吸附量与实验结果相近,更加适合描述AO-PAN对U(Ⅵ)的吸附行为,AO-PAN对U(Ⅵ)的吸附速率受化学吸附控制而不是质量传输控制。
3.6 吸附速率控制机理
AO-PAN吸附U(Ⅵ)在不同温度条件下吸附速率控制机理模型拟合示于图6,拟合模型参数列于表5。
由图6结果可知,两种模型拟合曲线均不通过原点,表明AO-PAN对U(Ⅵ)的吸附受液膜扩散和颗粒内扩散共同作用。在颗粒内扩散过程的拟合参数y表示AO-PAN表面的界面层厚度,从表5中数据可以看出,随温度升高y值逐渐增加,表明温度升高溶液内部分子越易于覆盖在吸附剂表面,形成传质。
在进行吸附速率控制机理拟合时需要分段进行,在AO-PAN吸附U(Ⅵ)的初始阶段和吸附进行一段时间时,吸附过程可能会被不同的扩散过程进行控制。298 K温度条件下AO-PAN吸附U(Ⅵ)可以分为两个过程。颗粒内扩散过程控制对吸附初始吸附过程拟合程度较好,因为在吸附初始时U(Ⅵ)通过液膜扩散到AO-PAN颗粒表面,液膜扩散过程不断进行,而颗粒内扩散过程进行很慢,成为该过程的控制过程,随着吸附不断进行,越来越多的U(Ⅵ)扩散到AO-PAN颗粒表面,使得颗粒内扩散速率逐渐加快,由于溶液主体中U(Ⅵ)浓度变化很小,液膜扩散速率不会再加快,使得液膜扩散过程成为此时的控制过程。

表4 AO-PAN对U(Ⅵ)在不同温度下的动力学模型拟合参数Table 4 AO-PAN kinetic model fitting parameters of U(Ⅵ) at different temperatures

图6 AO-PAN对U(Ⅵ)的吸附在298、303、313 K温度下吸附速率控制机理模型拟合Fig.6 Modeling of AO-PAN adsorption mechanism control model for U(Ⅵ) at 298, 303, 313 K temperature respectively

颗料内扩散过程液膜扩散模型温度/K298303313温度/K298303313Kd(mg·g-1·h1/2)52.1034.8775.81k/h-1-0.066-0.074-0.068y2.4902.6457.303截距理论值000R20.987 40.988 20.983 4截距计算值-0.321-0.143-1.211R20.996 60.980 00.979 2
4 结论
通过AO-PAN对U(Ⅵ)的静态吸附实验,吸附热力学实验表明Langmuir模型可以更好的对该吸附过程进行拟合,表明AO-PAN对U(Ⅵ)的吸附更加倾向于单分子层吸附;从吸附过程ΔH、ΔG、ΔS分析结果可知,AO-PAN对U(Ⅵ)的吸附是一个吸热、熵增、自发过程。吸附动力学实验表明,准二级方程对该吸附过程拟合程度较高并且饱和吸附量与实验结果相近,更加适合描述AO-PAN对U(Ⅵ)的吸附行为,AO-PAN对U(Ⅵ)的吸附速率受化学吸附控制而不是质量传输控制。吸附速率控制机理分析表明,AO-PAN对U(Ⅵ)的吸附初始时受颗粒内扩散过程控制,随着吸附不断进行吸附过程逐渐由颗粒内扩散控制变为液膜扩散过程控制。通过进行AO-PAN对U(Ⅵ)的吸附实验,表明AO-PAN是有利的吸附剂,在进行模型相关计算时探讨了吸附模型的适用性,可以为吸附实验提供模型理论参考。同时吸附速率控制机理模型的研究可以确定吸附过程的控制过程是粒子内扩散过程还是膜扩散过程控制,对工程上设备的设计、计算与实际应用有一定的指导意义。
