血管内栓塞治疗软脑膜动静脉瘘的临床观察
2019-03-13姜宗飞佟献增叶明
姜宗飞 佟献增 叶明
软脑膜动静脉瘘是一种罕见的脑血管畸形,占颅内血管畸形的1.6%~7.3%[1],多为先天性,其是位于软膜下动静脉的直接沟通,通常有引流静脉曲张,不伴有畸形血管团。Lasjaunias等[2]将其归为一独立病种,也有与创伤、静脉血栓、神经外科手术等有关的报道[3-5]。国内文献中仅有个案报道[6],尚未有软脑膜动静脉瘘介入治疗的大宗病例相关报道。笔者就连续收治的采用血管内介入栓塞治疗的软脑膜动静脉瘘患者的临床资料进行分析如下,以探讨软脑膜动静脉瘘的临床和影像学特点及治疗策略。
1 对象与方法
1.1 对象
回顾性连续纳入2013年1月至2017年12月首都医科大学宣武医院神经外科收治的软脑膜动静脉瘘患者12例,均经脑血管造影确诊。12例中,男9例,女3例;年龄4~48岁,中位年龄20.0(16.5,28.0)岁;以头痛为表现6例,颅内出血2例,癫痫发作3例,耳鸣1例;发生于幕上者10例,幕下者2例;供血动脉包括大脑前动脉4例,大脑中动脉8例,小脑后下动脉2例,大脑后动脉4例,小脑上动脉1例,小脑前下动脉1例,椎动脉2例;经大脑皮质静脉向上矢状窦引流10例,向小脑皮质静脉引流2例,向脊髓静脉引流1例。本研究方案经首都医科大学宣武医院伦理委员会审核批准,患者或其家属签署手术知情同意书。
纳入标准:(1)术前脑血管造影符合软脑膜动静脉瘘诊断标准[2];(2)行介入栓塞治疗;(3)临床及影像学资料完整。排除标准:(1)合并动静脉畸形、Galen区硬脑膜动静脉瘘、颈动脉海绵窦瘘及其他颅内血管畸形的患者;(2)碘对比剂过敏或严重肝肾功能障碍者;(3)既往有血液系统疾病、严重颅脑外伤史、颅脑手术史、静脉窦血栓病史、心肌梗死等严重心血管疾病患者;(4)难以随访的病例。
1.2 资料收集
收集所有患者的一般资料如性别、年龄、病史等,临床资料如症状、体征、治疗方式、治疗时间、治疗结果、并发症及影像学检查如CT、MR、DSA,以及随访资料如随访时间、方式及随访结果等。
1.3 治疗方法
采用全身麻醉,右侧股动脉置鞘,将6 F导引导管置入颈内动脉岩骨段或椎动脉V3段,全身肝素化(首剂量为每千克体质量给予静脉1/3 mg肝素,后每隔1 h静脉注射前次剂量的1/2,直至剂量达10 mg时,即每隔1 h静脉注射10 mg)。本组患者应用Glubran2(Gem SRL公司,意大利)、弹簧圈+Glubran2或Onyx18栓塞治疗,其中6例患者在球囊辅助下完成。首先在微导丝导引下将Marathon (美敦力公司,美国)或Magic (Balt Extrusion公司,法国)或 Echelon-10(EV3公司,美国)微导管送至供血动脉远端近瘘口处,近端Hyperform球囊(EV3公司,美国)辅助5例,Scepter-c球囊(MicroVention公司,美国)辅助1例。充盈球囊,经微导管造影见远端血流明显变慢甚至停顿后,应用Glubran2(浓度17%~66%)在空白路图下栓塞瘘口。术中注意栓塞剂的弥散方向。若有Glubran2反流,在1~2 s内快速注入更多Glubran2,形成塞子,然后快速撤出微导管,栓塞中多次造影,明确瘘口栓塞程度,直至瘘口完全闭塞。2例患者在引流静脉近端,尤其是在静脉湖内填塞弹簧圈,以降低脑血流,然后注入Onyx18或不同浓度的Glubran2栓塞瘘口,达到闭塞瘘口的目的。术后严密监测患者血压并控制血压低于正常水平20~30 mmHg。
1.4 疗效评定标准
完全栓塞为瘘口及引流静脉完全消失;次全栓塞为仅有小部分的血流而流量及流速明显下降;部分栓塞为大的残存血流而流量及流速仅轻微减少或减少不明显[7]。
1.5 并发症观察
通过术后仔细询问患者症状、体格检查、影像学检查(头部CT、头部MR)观察患者的并发症发生情况。
1.6 随访
术后3~35个月对所有患者进行随访,随访方式包括门诊或电话方式,或住院复查脑血管造影,随访内容包括患者临床症状缓解情况及影像学治愈(复查脑血管造影瘘口无显影)情况。
2 结果
所有患者的一般资料及临床资料见表1。
2.1 手术结果及术后并发症
栓塞术后即刻造影,11例患者瘘口均完全闭塞,1例患者瘘口次全栓塞;术后1例左侧肢体肌力下降至Ⅳ级,复查头部CT示脑肿胀,术后3个月恢复至正常水平。
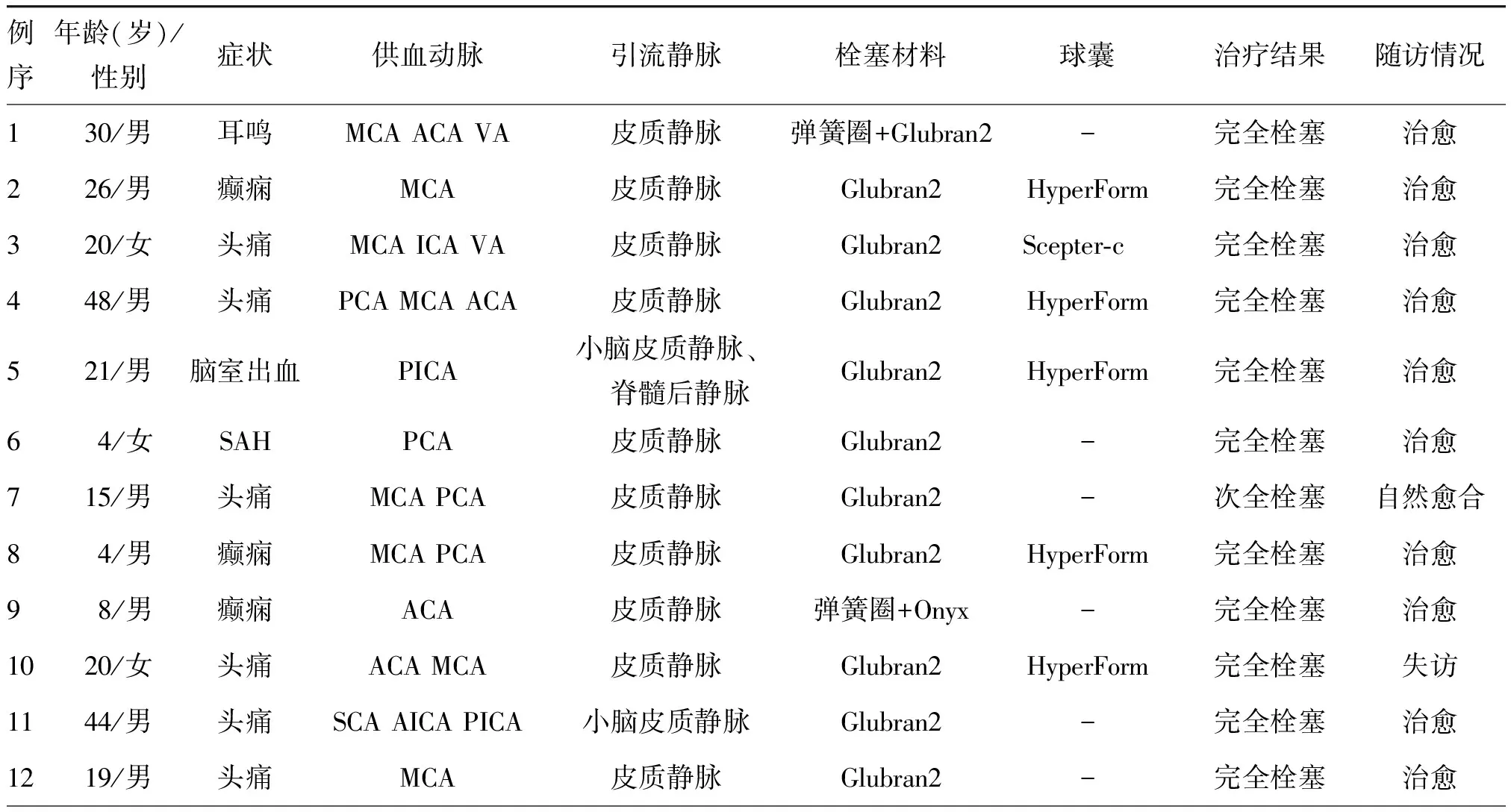
表1 12例软脑膜动静脉瘘患者介入治疗及随访资料
注:SAH为蛛网膜下腔出血,MCA为大脑中动脉,ACA为大脑前动脉,VA为椎动脉,ICA为颈内动脉,PCA为大脑后动脉,PICA为小脑后下动脉,AICA为小脑前下动脉;“-”表示未采用球囊操作
2.2 随访结果
12例中,完成DSA随访11例,中位随访时间13.4(5.2,26.7)个月。11例患者瘘口均未显影,但1例患者出现上矢状窦区、直窦及窦汇区硬脑膜动静脉瘘及动静脉畸形,经栓塞治愈[8]。9例患者症状完全缓解,1例患者仍有头痛症状,1例患者需口服抗癫痫药物控制癫痫发作。
典型病例1男性,30岁,主因“耳鸣3个月”于2013年3月22日就诊于首都医科大学宣武医院神经外科。入院前3个月,患者因耳鸣影响工作生活就诊于当地医院,无头痛、头晕,无恶心、呕吐,无癫痫发作,行脑血管造影诊断为软脑膜动静脉瘘,未予以特殊治疗,后转来本院治疗。入院时神经系统体格检查无阳性体征。既往无颅脑外伤、静脉窦血栓等病史。行全脑血管造影示:由右侧大脑中动脉、右侧大脑后动脉及左侧大脑前动脉供血软脑膜动静脉瘘,经皮质静脉向上矢状窦引流。先经左侧大脑前动脉使用Glubran2栓塞瘘口,后经右侧大脑中动脉应用弹簧圈加Glubran2栓塞,最后经椎动脉超选至右侧大脑后动脉使用Glubran2栓塞,术后造影见瘘口完全闭塞。术后患者耳鸣症状完全消失。术后4个月复查脑血管造影示瘘口无显影。手术前后及随访时DSA成像见图1a~1l。
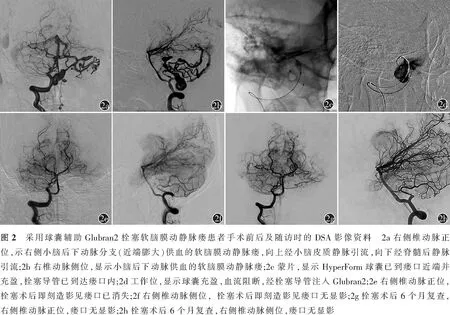
典型病例2男性,21岁,主因“突发头痛呕吐6 d”于2015年4月22日入诊首都医科大学宣武医院神经外科。入院6 d前,患者因突发头痛、呕吐,于当地医院就诊,无癫痫发作、意识丧失。头部CT检查提示:脑室出血;脑血管造影提示右侧小脑后下动脉分支扩张膨大并动静脉瘘,未予以特殊治疗。患者既往无颅脑外伤、静脉窦血栓等病史。入院时神经系统体格检查示:颈部抵抗感。全脑血管造影示:由右侧小脑后下动脉分支供血的软脑膜动静脉瘘,小脑后下动脉近瘘口处明显膨大,向上经小脑皮质静脉引流,向下经脊髓后静脉引流,脊髓后静脉可见动脉瘤样结构。于全身麻醉下行HyperForm球囊辅助Glubran2栓塞治疗。术后即刻造影见瘘口完全闭塞。术后6个月复查脑血管造影见瘘口无显影,患者头痛症状完全缓解。手术前后及随访时DSA成像见图2a~2h。
3 讨论
软脑膜动静脉瘘是一种罕见的脑血管畸形,是由一支或多支供血动脉与一支引流静脉形成的直接沟通,无畸形血管团,具有高血流量的特点。其治疗方式包括介入栓塞、手术切断瘘口、介入与手术联合及放射外科等[9-12]。

3.1 发生机制
Padget[13]的开创性工作有助于我们对软脑膜动静脉瘘发生机制的理解。大脑的静脉系统是最早发育的血管系统,其中大的静脉通道首先发育,在11~14 mm阶段发育出较小的原始静脉通道,且能够辨认出Wills环的分支。在20 mm阶段,软膜动脉和静脉仅是以各种角度彼此交叉的内皮管道。角度越小,内皮管之间交叉的表面积越大,形成动静脉分流概率越大。在胚胎学上,异常扩张的毛细血管网可能解释瘘管的形成,其将血液从发育中的动脉直接分流至静脉。这种瘘管在发育期间短暂出现是常见的,它们随着毛细血管网的发育和血管壁的成熟而退化。毛细血管网发育及血管壁的成熟障碍,将会导致动静脉瘘的形成。
由于缺乏毛细血管的“阻力缓冲”作用,动静脉之间的异常血流导致出血风险增加。尽管不能得出确切的结论,但是瘘口通常位于动脉与静脉之间,或者位于动脉与随后扩张的毛细血管或小动脉之间。无大量毛细血管提供的阻力作用,动脉与静脉之间交通变得直接、阻力低,使得动脉异常扩张,并逐渐失去张力,变得松弛、脆弱,而静脉接受本应分散在毛细血管系统的过多血液,导致扩张、膨大。这进一步导致了通过瘘口的血流量增加,供血动脉及静脉更加扩张,同时由于血流速度增快,血管壁不能从血流中获得足够的能量,血管壁失去其收缩性,也逐渐扩张,并且静脉扩张更为明显,导致恶性循环,逐渐加重,最终形成典型的供血动脉增粗、引流静脉曲张并多伴有静脉球的软脑膜动静脉瘘[14]。
3.2 自然史
由于软脑膜动静脉瘘发病率极低,其自然史及出血风险尚不清楚。软脑膜动静脉瘘导致出血的确切位置尚不明确,但是曲张的引流静脉管壁厚薄不均,在异常血流冲击下容易出血[13]。既往研究报道8例患者在保守治疗中,5例因脑出血而死亡[15]。Satow等[16]报道2例软脑膜动静脉瘘患者,在行脑血管造影后瘘口自然愈合。Lyons等[17]报道1例脊柱手术患者,术后出现蛛网膜下腔出血并诊断为软脑膜动静瘘,在2周后行脑血管造影时瘘口消失。本组有1例高流量软脑动静脉瘘患者行次全栓塞治疗,在术后半年复查脑血管造影时瘘口已完全闭塞。尽管机制不明,但是以上报道均为低流量患者。因此对于低流量的软脑膜动静脉瘘,通过改变局部血流、诱导血栓形成,甚至观察随访有自愈可能。但是对于高流量病变,为避免致死性出血风险,仍需要积极治疗。
3.3 治疗策略
软脑膜动静脉瘘的治疗方法包括介入栓塞及手术以阻断瘘口。既往研究报道介入栓塞治愈率86.5%,手术治愈率为96.8%[12]。本组患者栓塞瘘口完全闭塞率为11/12。栓塞术后除1例患者出现左侧肢体肌力下降,经康复恢复正常外,无其他并发症发生,无死亡病例。
由于本病具有高血流量的特点,本组中6例患者在球囊辅助下成功闭塞瘘口。既往文献多报道使用Onyx闭塞瘘口的安全性及有效性[9,18-19],同时也有多项研究报道了Glubran2栓塞的优越性[20-22]。Onyx胶浓度相对固定,且难以仅封堵瘘口,易闭塞扩张的静脉端,术后占位效应不能消除,以致临床症状不能缓解,而Glubran2具有相对容易推注、良好的渗透性、弥散好、聚合速度可调节及永久闭塞瘘口的特点。本组11例患者应用Glubran2栓塞,术中根据血流速度、球囊临时阻断等因素,使用碘油灵活调节Glubran2的浓度,本组Glubran2浓度17%~66%;术后10例患者瘘口均完全栓塞,1例患者瘘口次全栓塞;随访时,除1例失访外,10例均治愈;1例患者使用了Onyx治疗;2例患者使用了弹簧圈以减少Glubran2栓塞前的血流量。何时使用Onyx或Glubran2,我们的经验是:Onyx作为非黏附性栓塞材料,栓塞术后尤其是撤掉球囊后发生移位的可能性大,特别对于高流量病变;Glubran2为黏附性栓塞剂,栓塞后发生移位的概率较小,因此Glubran2在栓塞软脑膜动静脉瘘,尤其是高流量瘘时可作为首选。本组 1例患者在术后出现硬脑膜动静脉瘘[8],可能与软脑膜动静脉瘘栓塞术后局部血栓形成、静脉高压及血流动力学改变有关。Paramasivam等[23]报道软脑膜动静脉瘘栓塞术后有4例(4/16)患者发生硬脑膜动静脉瘘,强调了脑血管造影长期随访的重要性。
本组1例患者使用了Scepter-c球囊,5例患者使用了Hyperform球囊,无球囊相关并发症发生。笔者认为球囊辅助栓塞能够提高栓塞成功率,降低并发症。其优点是在靠近瘘的动脉端充盈球囊,使血流停顿,将高风险高流量的病变转变成无流量低风险的病变,能够达到安全、可控、治愈性栓塞的目的[8]。既往曾有栓塞材料异位到曲张静脉、肺、脑皮质引流静脉的报道[24],球囊辅助可使血流停顿,避免以上并发症的发生。但是球囊的过度充盈可导致血管损伤,同时球囊导管较硬,通过颅内远端血管充满挑战,应用“漂浮”球囊技术,能够降低血管损伤风险,提高安全性[10]。
尽管本组患者介入栓塞治疗取得了较好疗效,但有些情况不利于介入栓塞治疗,手术治疗可能是最佳选择,如供血动脉细小,微导管不能通过;或引流静脉存在正常的静脉引流功能,闭塞后可导致静脉性出血;或栓塞太靠近瘘口,仅能部分闭塞瘘口,可通过“招募”新的供血动脉导致复发[11]。但手术具有损伤大、静脉动脉化、术中难以准确定位瘘口等缺点,尤其对于位置深在或位于功能区的瘘口其应用受到限制[10,25]。因此充分理解病变的血管构筑特点,选择最佳的治疗方式,是患者最大获益的关键。
由Spetzler等[26]首次提出的正常灌注压突破现象,是软脑膜动静脉瘘口栓塞后的潜在并发症。有学者认为,栓塞术后突发的静脉窦或引流血栓形成是栓塞术后正常灌注压突破现象的原因,因此建议分期栓塞,且术后应用肝素以预防静脉端血栓形成,防止该并发症发生[17]。本组1例患者在瘘口闭塞后出现脑水肿、左侧肢体肌力下降,经脱水、康复治疗后恢复正常,考虑可能与正常灌注压突破有关。本组病例均一期栓塞,未出现血栓事件,我们认为术后严密监测血压并控制低于正常水平20~30 mmHg是预防此并发症的关键。
软脑膜动静脉瘘是一种罕见的疾病,多表现为头痛、癫痫发作、脑出血等,及时治疗,患者预后良好。尽管有一些不利于血管内治疗的因素存在,在充分理解病变血管构筑的基础上,血管内治疗是一安全有效的治疗方式。本研究为单中心、小样本的回顾性研究,有一定的局限性,尚需大样本、多中心研究进一步证实。
