葫芦[7]脲与抗癌药物甲氨蝶呤的包合作用研究
2019-03-11吕爱军常银霞张向梅
吕爱军, 常银霞, 张向梅, 齐 萌
(1.临汾职业技术学院,山西临汾 041000; 2.山西中医药大学,山西太原 030619; 3.山西师范大学现代文理学院,山西临汾 041000)
甲氨蝶呤(MTX)是一种叶酸类似物的抗叶酸制剂,广泛用于治疗白血病和骨肉瘤等恶性肿瘤[1 - 2],其结构式见图1。测定MTX的方法已有多种,如荧光偏振免疫法[3]、毛细管电泳法(CE)[4 - 5]和高效液相色谱法(HPLC)[6 - 7]。然而,这些方法都有一定的局限性,CE法精确度差,HPLC法需要复杂的样品制备过程。荧光分光光度法简单实用且具有高的灵敏度,广泛用于检测一些无机和有机分子[8 - 9]。目前,荧光光谱法检测MTX未见文献报道。

图1 MTX、CB[7]和BER的化学式Fig.1 The Structures of MTX,CB[7] and BER
葫芦[n]脲(CB[n])是一类大环化合物[10],具有疏水的空腔和环绕的羰基氧原子组成的端口,空腔两端的多个羰基可通过离子-偶极/氢键作用与客体分子结合[11 - 12],因此CB[n]及其衍生物的研究引起越来越多人的关注。而CB[7](图1)具有很好的水溶性以及可与很多有机化合物和阳离子形成络合物[13 - 14],具有化学稳定性高、生物毒性低等特点,在药物分析及药物转运等方面具有潜在的应用价值。
本文中我们把小檗碱(BER)(图1)作为荧光探针检测生物流体中的MTX。MTX的水溶液几乎没有荧光,当BER加入到CB[7]溶液中时,荧光强度显著增强,当一定量的MTX加入到CB[7]-BER体系中时,体系的荧光强度显著猝灭。基于荧光强度变化和MTX的浓度之间的线性关系,提出了一种简单的测定MTX的荧光测定新方法。并通过紫外-可见光谱、1H NMR和理论计算对其作用机理进行探究。
1 实验部分
1.1 仪器及试剂
Agilent Cary Eclipse型荧光分光光度计(美国,安捷伦科技公司);U-3010型紫外-可见分光光度计(日本,日立公司);pHS-3C型pH计(上海天达仪器有限公司)。
葫芦[7]脲(CB[7])按文献方法[15]合成。盐酸小檗碱(BER)、甲氨蝶呤(MTX)、5-氟尿嘧啶和亚叶酸钙均为色谱纯,购自中国药品生物制品检定所。用二次蒸馏水配成浓度分别为100、250和200 μg·mL-1的MTX、5-氟尿嘧啶和亚叶酸钙的储备液。CB[7]和BER分别用二次蒸馏水配成0.9×10-4mol·L-1的储备液。工作液用二次蒸馏水稀释而得。实验所用其它试剂均为分析纯,水为二次蒸馏水。
1.2 实验方法
1.2.1荧光光谱测定在10 mL比色管中,依次加入1 mL 0.9×10-4mol·L-1CB[7]溶液,1 mL 0.9×10-4mol·L-1BER,1 mL pH=2.0的三酸缓冲溶液,随后移入一定量的MTX标准溶液,用水定容,并在室温下振荡15 min。用1.0 cm的石英池,激发和发射光谱的狭缝均为5.0 nm,扫速为1 200 nm·min-1,以344 nm为激发波长,在496 nm处测量溶液的荧光强度(FBER-CB[7]-Drug),同时测定空白溶液的荧光强度(FBER-CB[7])。获得荧光猝灭值:ΔF=FBER-CB[7]-FBER-CB[7]-Drug。
1.2.2血浆样品分析取2.0 mL血浆样品于离心管中,移入0.1 mL的药物溶液、适量的5-氟尿嘧啶和亚叶酸钙溶液,搅拌,再加入6.0 mL甲醇,以10 000 r·min-1离心15 min,脱蛋白,然后取5.0 mL的上清液用水定容到50 mL,随后按荧光光谱测定步骤进行测定。
2 结果与讨论
2.1 CB[7]-MTX包合物的荧光光谱特征
MTX表现出较弱的荧光发射,当向MTX溶液中加入CB[7]时,MTX的荧光强度没有明显的改变(图2(A))。BER也表现出弱的荧光发射,当向BER溶液中加入CB[7]时,观察到荧光强度显著增加;向CB[7]-BER体系中加入MTX时,观察到荧光强度显著猝灭(图2(B))。荧光强度随MTX浓度的增大而减小,这可能是由于MTX和BER客体竞争CB[7]主体分子的空腔,使BER分子离开CB[7]的空腔进入水溶液,因此,CB[7]-BER体系的荧光强度减少是由于CB[7]和MTX之间形成了新的包合物。
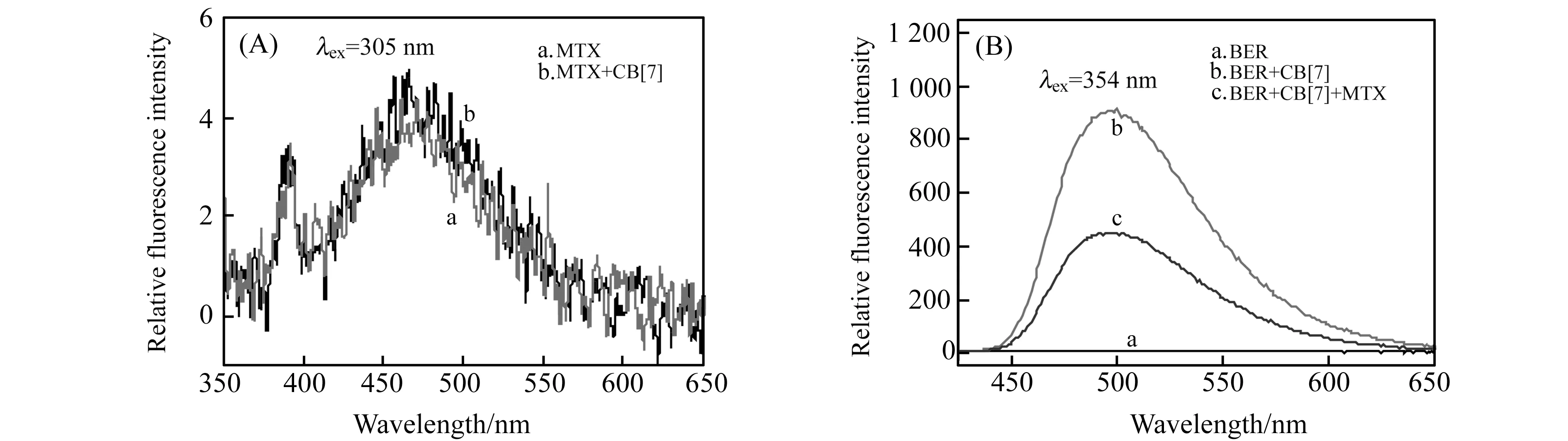
图2 (A)MTX和MTX+CB[7]的荧光光谱图;(B)BER、BER+CB[7]和BER+CB[7]+MTX荧光光谱图Fig.2 (A)Fluorescence spectra of MTX and MTX+CB[7];(B)Fluorescence spectraof BER,BER+CB[7] and BER+CB[7]+MTX Excitation and Emission slit 5 nm;Scanning speed:1 200 nm ·min-1.1 cm quartz cell,cMTX=15.0 μg·mL-1,cCB[7]=CBER=0.9×10-5 mol·L-1,pH=2.0.
2.2 CB[7]和MTX的包合比
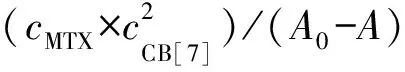

图3 (A)在MTX溶液中滴加不同浓度CB[7]的吸收光谱;(B)吸光度vs.NCB[7]/NMTX曲线(插图为ΔA vs.[NMTX/(NCB[7]+NMTX)]曲线)Fig.3 (A)Absorption spectrum of MTX(4.1 μg·mL-1) in the presence of CB[7];(B)Absorbance vs.NCB[7]/NMTX curve(Insert:ΔA vs.[NMTX/(NCB[7]+NMTX)] curve)cMTX=4.1 μg·mL-1.
2.3 1H NMR和2D NOESY谱
通过1H NMR研究了CB[7]和MTX的相互作用。从图4可以看出,当把CB[7]加到MTX溶液中时,MTX对应的质子的化学位移都发生了不同程度的移动,蝶啶环上质子H7的移动最大(1.0 ppm),这表明蝶啶环可能位于CB[7]腔内。而且从氢谱中观察到CB[7]和MTX的化学计量比达到2∶1时,药物分子上的质子几乎不发生移动了。这表明一个MTX分子会与两个CB[7]分子相互作用,这结果与前面紫外-可见光谱得出的结果一致。证明了CB[7]和MTX发生了相互作用。


图4 MTX(0.25 mmol·L-1)和CB[7]的 1H NMR谱图Fig.4 1H NMR spectra(600 MHz) of MTX(0.25 mmol·L-1) with CB[7] in D2O MTX∶CB[7](a)1∶0;(b)2∶1;(c)1∶1;(d)1∶1.5;(e)1∶2;(f)1∶3.

图5 MTX(0.5 mmol·L-1)和CB[7](1 mmol·L-1)在D2O(0.01 mol·L-1 DCl)中的部分NOESY谱图Fig.5 Partial NOESY spectrum(600 MHz,295 K) of MTX(0.5 mmol·L-1) with CB[7](1 mmol·L-1) in D2O (containing 0.01 mol·L-1 DCl)
2.4 pH的影响
在pH=1~12范围内考察了pH值对所形成包合物的影响。发现所有的包合物在pH为2.0时显示最大变化。因此,确定pH值等于2.0的三酸缓冲溶液用于整个实验。
2.5 灵敏度与选择性
往BER-CB[7]溶液中加入MTX时,荧光强度降低,在一定的范围内,荧光猝灭值(ΔF)和MTX的浓度呈很好的线性。线性范围是0.2~15 μg·mL-1,线性方程为:ΔF=30.385c+21.974(c:μg·mL-1),相关系数为0.9988,检测限为0.06 μg·mL-1,说明此方法有很高的灵敏度。
甲氨蝶呤、5-氟尿嘧啶(5-FU)和亚叶酸钙(LV)用于联合治疗晚期胃癌和结肠癌。在CB[7]-BER溶液中加入适量的5-氟尿嘧啶、亚叶酸钙时,荧光强度几乎无变化。当CB[7]-BER-MTX溶液中加入适量的5-氟尿嘧啶、亚叶酸钙时,荧光强度也几乎没有改变。因此,所提出的方法具有良好的选择性。
2.6 加标血浆样品的测定
血浆中的蛋白对测定有一定的影响,用适量甲醇去蛋白后,即可消除干扰。通过对5种浓度药物加标回收率进行测定,每个浓度平行测定5次,回收率达到97.6%~101.7%,表明该探针可用于检测生物流体中MTX,并且有较好的精密度和准确度。数据如表1所示。
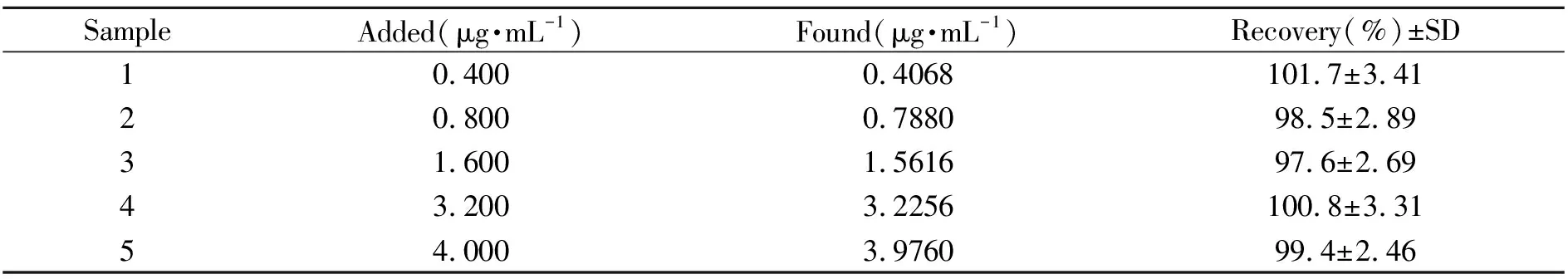
表1 加标血浆样品MTX的测定(n=5)
2.7 分子模型的理论计算
采用Gaussian 09程序包,用半经验方法PM6对MTX-CB[7]包合物的结构进行了优化(图6)。在能量最低结构中观察到,MTX中的OH/NH2基团与CB[7]的羰基氧原子之间形成O-H…O/N-H…O氢键,使结构处于稳定状态。MTX中的蝶啶环钻进了CB[7]的空腔,芳香环接近于主体分子的宽边缘。这个结果与1H NMR和2D NOESY的实验结果一致。
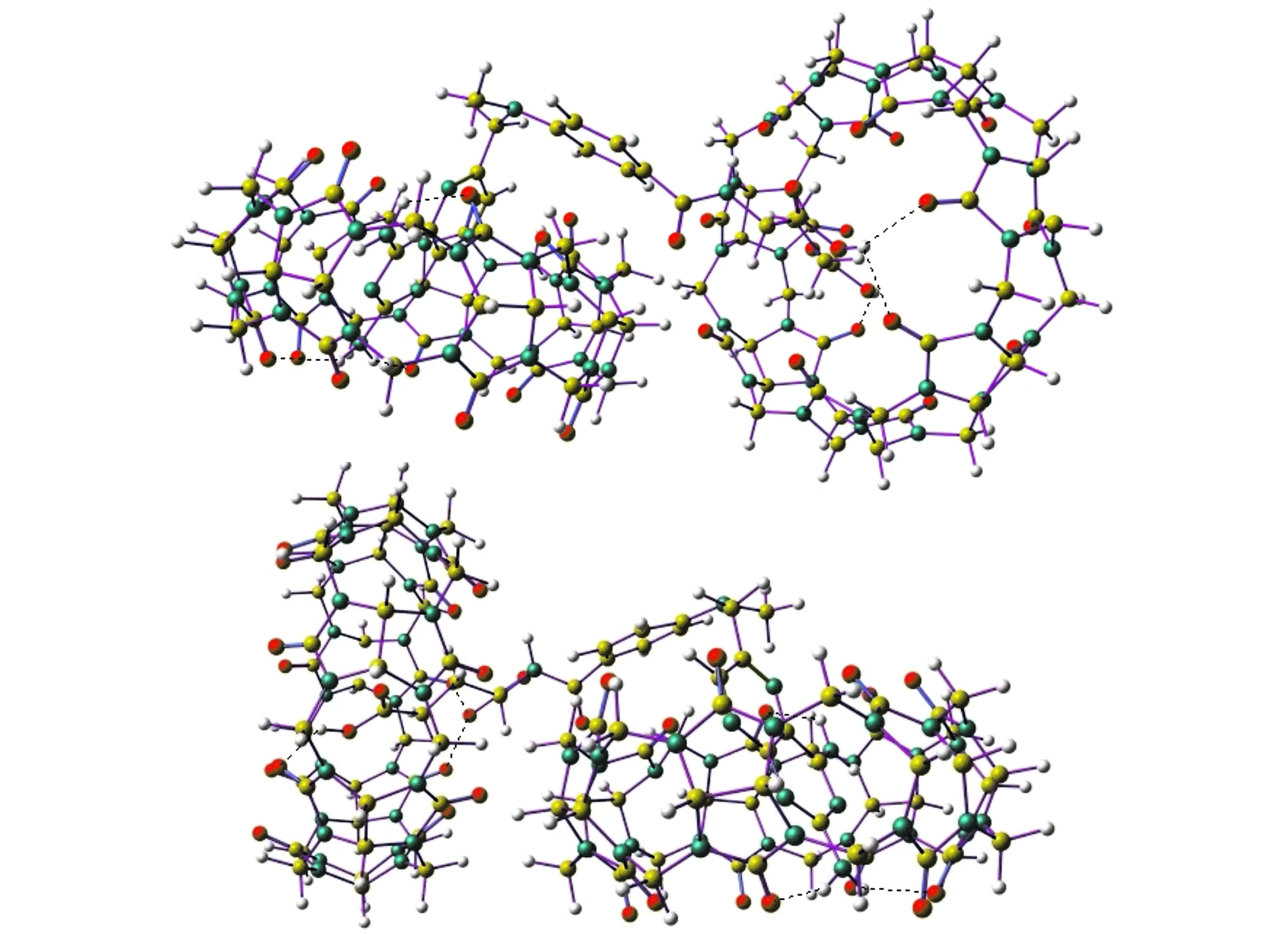
图6 CB[7]-MTX包合物的能量最低结构的模型图(两个视角) Fig.6 Optimized Structures of CB[7]-MTX Complex(two points of view) Colour codes:oxygen,red;carbon,yellow;nitrogen,blue;hydrogen,grey.
3 结论
建立了一种检测甲氨蝶呤的新的荧光方法,此方法灵敏度高,选择性好,经济,易操作,并成功地应用于生物流体中药物的测定。通过荧光光谱、紫外-可见光谱、1H NMR、2D NOESY和理论计算相互佐证,证实MTX与CB[7]可以形成稳定的包合物,包合作用的形成有望降低抗癌药物甲氨蝶呤的毒性,提高药物的疗效。
