基于酶促信号放大的氧化石墨烯生物传感器快速检测金黄色葡萄球菌的研究
2019-03-11贺气志陈珂珂陈伶利
贺气志, 唐 亮, 周 吉, 陈珂珂, 陈伶利, 宁 毅*
(1.长沙医学院基础医学院,湖南长沙 410219; 2.湖南中医药大学医学院,湖南长沙 410208)
金黄色葡萄球菌(Staphylococcusaureus)是一种常见的致病性和致死性的病原菌,它可引起局部化脓感染,坏死性肺炎、心包炎、食物中毒等一系列疾病,甚至出现脓毒症、败血症等全身感染[1 - 3]。随着科技的发展,目前各种新技术包括免疫学方法、电化学法、PCR等方法已被应用于金黄色葡萄球菌的检测[4 - 7]。但是这些方法存在易污染、选择性弱、操作繁琐、所需设备昂贵等缺点,难以满足临床快速诊断治疗和食品检测的需要。因此,建立一种简单快速,成本低廉,灵敏性高,特异性强的新方法已迫在眉睫。
氧化石墨烯(GO)是一种非常高效的荧光猝灭剂,它具有良好的水溶性以及生物低毒性[8],并且能保护吸附在其表面的单链DNA(ssDNA)不被降解,因此被广泛应用于传感器、基因诊断等领域[9 - 12]。脱氧核糖核酸酶Ⅰ(DNase Ⅰ)在Mg2+存在时能随机降解单、双链DNA形成小DNA片段,而对RNA无降解作用,DNase Ⅰ的这一特性为设计生物传感器对RNA进行检测提供了新的思路[13 - 14]。由于细菌的16S rRNA 具有高度的保守性和特异性,以此作为靶标设计探针非常快捷简便且选择性高,因此成为检测病原菌的重要标记物[15 - 16]。本研究利用一段特异性识别的金黄色葡萄球菌16S rRNA为靶标设计探针,基于荧光叠加原理构建两个羰基荧光素(FAM)标记的探针(TFP),并与GO形成TFP/GO纳米生物传感器,并利用DNase Ⅰ的特性使RNA靶标循环从而放大荧光信号,提高生物传感器的灵敏度。
1 实验部分
1.1 仪器与试剂
LS55型荧光分光光度计(美国,PerkinElmer公司);Milli-Q型纯水仪(美国,Millipore公司); PL203型电子天平和DELTA-320 pH计(瑞士,梅特勒-托利多公司)。
氧化石墨烯(GO)(南京先锋材料科技有限公司);DNase Ⅰ(Thermo Fisher Scientific);UNIQ-10柱式Trizol总RNA提取试剂盒(上海生工生物科技有限公司);pH=7.4 Tris-HCl缓冲溶液(25 mmol/L Tris-HCl,5 mmol/L MgCl2)(天根生化科技有限公司)。实验菌种:金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、大肠杆菌K88、铜绿假单胞菌均由湖南中医药大学提供。本研究所用的核苷酸均由上海生工生物科技有限公司合成。金黄色葡萄球菌的16S rRNA来自于核糖体数据库项目Ⅱ数据库,取其中25个碱基作为靶标序列。设计新的ssDNA在与靶标互补序列两侧延伸6个碱基分别与探针1、探针2互补。探针1、探针2分别在3′端和5′端用FAM荧光标记,如表1。

表1 体系中所用到的核苷酸
Note:the underlines are complementary sequence of probe 1 and probe 2,respectively.
1.2 实验方法
1.2.1核苷酸序列的设计从核糖体数据库项目Ⅱ中获得所有的金黄色葡萄球菌的16S rRNA。这些序列被酶切成多片段并通过多重比对。选取与原始菌匹配度大于90%,而与其他菌的匹配度小于10%的片段连接起来。本研究采用的靶标序列如表1所示,根据标靶序列设计互补的ssDNA探针,该探针包含16S rRNA互补序列(捕捉探针)和羧基荧光素(FAM)标记的探针1、探针2(信号探针),两者通过碱基互补组装成双FAM标记的检测探针TFP。
1.2.2GO溶液和荧光探针的制备称取100 mg GO,溶于100 mL超纯水后,将其置于300 W超声波破碎仪下冰浴超声120 min,使其充分均匀分散,制备成1 mg/mL的GO溶液,室温保存备用。首先将50 nmol/L的探针1、探针2与ssDNA分别在95 ℃水浴下变性5 min,然后冰浴10 min后,将三者在室温下混合孵育30 min,组装成两个FAM标记的探针(TFP)。采用上述相同的方法将50 nmol/L ssDNA分别与探针1、探针2组装成单荧光探针1(SFP1)、单荧光标记探针2(SFP2)。本研究反应体积均为100 μL,所有物质浓度均为终浓度。
1.2.3检测条件的优化为了优化荧光受体GO与荧光供体TFP比例,设置从0到 0.12 mg/mL的13种不同的GO浓度。将不同体积的1 mg/mL GO溶液分别与TFP溶液混合,用pH=7.4的Tris-HCl缓冲溶液定容至100 μL,TFP终浓度为50 nmol/L,室温孵育20 min。在激发波长495 nm,发射波长520 nm下测定TFP原始荧光值(F0)和TFP/GO混合溶液荧光值(F)。此外,将40 nmol/L靶标序列和1 U DNase Ⅰ同时加入到TFP/GO混合体系中室温孵育,每5 min监测一次荧光强度,确定体系的最佳荧光恢复反应时间。此外DNase Ⅰ的浓度也是影响传感器的重要因素。将DNase Ⅰ从0~1.25 U设置6个不同浓度梯度,将60 nmol/L靶序列和DNase Ⅰ同时加入TFP/GO混合体系中,总体积为100 μL,室温孵育50 min后,分别测定各反应液的荧光强度。本研究所有实验都做3次平行实验。
1.2.4可行性分析为了验证该生物传感器的可行性,设置了以下8组溶液:(1) TFP;(2) TFP+DNase Ⅰ;(3) TFP+GO;(4) TFP+GO+DNase Ⅰ;(5) TFP+GO+target;(6) TFP+GO+DNase Ⅰ+target;(7) SFP1+GO+DNase Ⅰ+target;(8) SFP2+GO+DNase Ⅰ+target。各组溶液均用Tris-HCl缓冲溶液(pH=7.4)定容至100 μL,GO浓度为0.09 mg/mL,荧光探针SFP1、SFP2、TFP的浓度为50 nmol/L,GO分别和3种荧光探针室温孵育10 min。靶标RNA浓度为60 nmol/L,1 U DNase Ⅰ同时加入检测体系,室温孵育50 min,充分反应后,分别测定各组混合溶液的荧光强度。
1.2.5TFP对16SrRNA靶标序列的检测将TFP/GO复合物与不同浓度(0、10、20、30、40、50、60 nmol/L)的靶标序列室温孵化50 min,充分反应后,在激发波长495 nm,发射波长520 nm下分别测定各组混合溶液的荧光强度。为探究酶切放大效果,分别将浓度为0、0.3、1、10、20、30、40、60、70 nmol/L的靶标序列RNA与DNase Ⅰ同时加入到TFP/GO中,室温孵育50 min后,测定各混合溶液的荧光强度。
1.2.6TFP/GO生物传感器对金黄色葡萄球菌的灵敏性分析为了评价TFP/GO生物传感器在实际样品中对金黄色葡萄球菌的灵敏度,准备浓度为0、50、102、103、104、105、106、107、108CFU/mL的靶细菌菌液,冷冻离心(1 700g)收集菌体,用试剂盒提取总RNA。然后将总RNA和DNase Ⅰ同时加入到TFP/GO复合溶液中,室温孵育50 min后,分别测定混合溶液的荧光值。
1.2.7TFP/GO生物传感器对金黄色葡萄球菌的特异性分析为考察该生物传感器的特异性,以金黄色葡萄球菌为实验组,以表皮葡萄球菌、腐生葡萄球菌、铜绿假单胞菌、大肠杆菌为对照组,所有菌种的浓度均为105CFU/mL,提取它们的总RNA,按上述方法测定该体系的荧光值。
2 结果与讨论
2.1 生物传感器的设计原理
TFP/GO传感器设计的原理是基于DNase Ⅰ介导的酶切靶标循环的荧光信号放大反应,如图1所示。设计的ssDNA包含能捕捉16S rRNA靶标的DNA序列,序列5′-端、3′-端各有6个碱基分别与探针1、探针2互补。ssDNA与探针1、探针2互补配对形成两个荧光分子标记的探针(TFP)。当无靶标时,TFP通过π-π键吸附在GO表面,由于共振能量转移,荧光被猝灭,如图1(a)。当加入靶标RNA时,TFP与靶标RNA互补配对使其从GO表面解离下来,因此体系荧光恢复。当核酸分子从GO表面解离下来后,DNase Ⅰ随机降解单、双链DNA分子从而释放靶标RNA参与下一轮反应,同时产生更多游离的FAM,体系荧光信号进一步增强,如图1(b)。因此该过程能有效的提高传感器的灵敏度,有望在低浓度下进行定量分析。
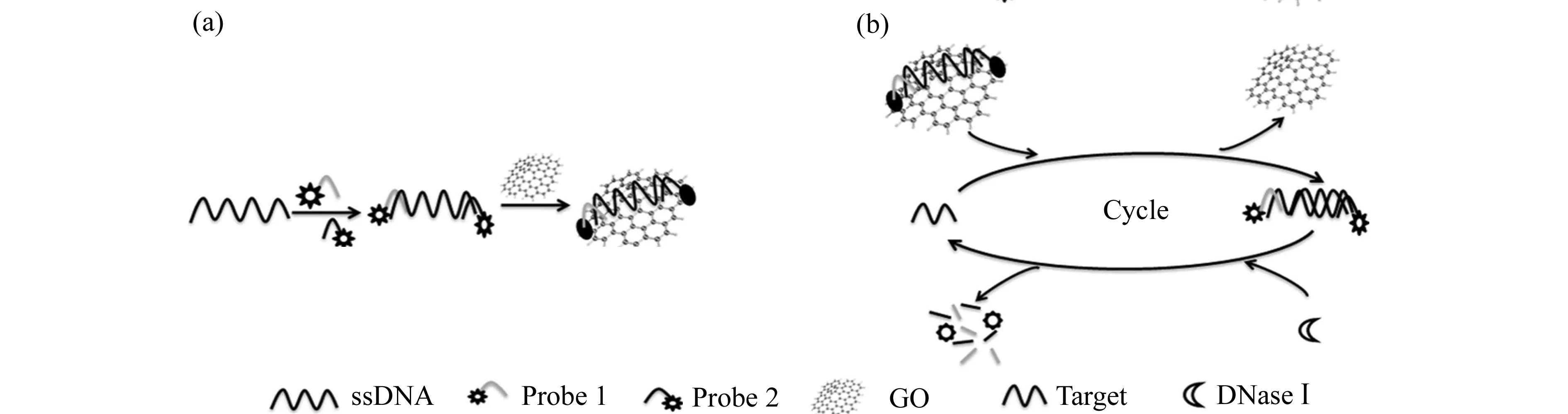
图1 TFP/GO生物传感器检测金黄色葡萄球菌的原理图Fig.1 Schematic representation of the TFP/GO biosensor for S.aureus detection (a) Constructions of TFP and preparation of TFP/GO complexes;(b) DNase Ⅰ-mediated target recycling and fluorescent signal amplification occurred.
2.2 检测条件的优化
TFP与GO的供受比例、荧光恢复的反应时间及DNase Ⅰ的用量是影响传感器检测效率以及灵敏性的重要因素,因此对这三个条件进行了优化。图2(a)显示了TFP加到不同浓度GO溶液中的荧光猝灭率的变化。随着GO浓度的增大,荧光强度降低,荧光猝灭率迅速上升,当GO浓度达到0.09 mg/mL时,荧光猝灭率超过95%,继续增加GO浓度,猝灭率基本不变。因此最终确定GO最佳浓度为0.09 mg/mL,后续实验均采用此比例。检测时由于DNase Ⅰ的作用,时间越长产生的游离荧光分子越多,为提高检测效率对荧光恢复时间进行优化,如图2(b)所示。当靶标加入体系后,荧光强度逐渐恢复。反应50 min后,荧光值基本趋于平缓不再显著增加。因此将50 min作为最佳的荧光恢复反应时间。为确定最佳的DNase Ⅰ浓度,考察反应体系中加入不同浓度的DNase Ⅰ的荧光值的变化,如图2(c)所示。随着DNase Ⅰ浓度的增大,其荧光值增大,当DNase Ⅰ用量达到1U后继续增加用量,其荧光值基本趋于平缓不再显著增加,因此体系中DNase Ⅰ的最佳用量为1 U。
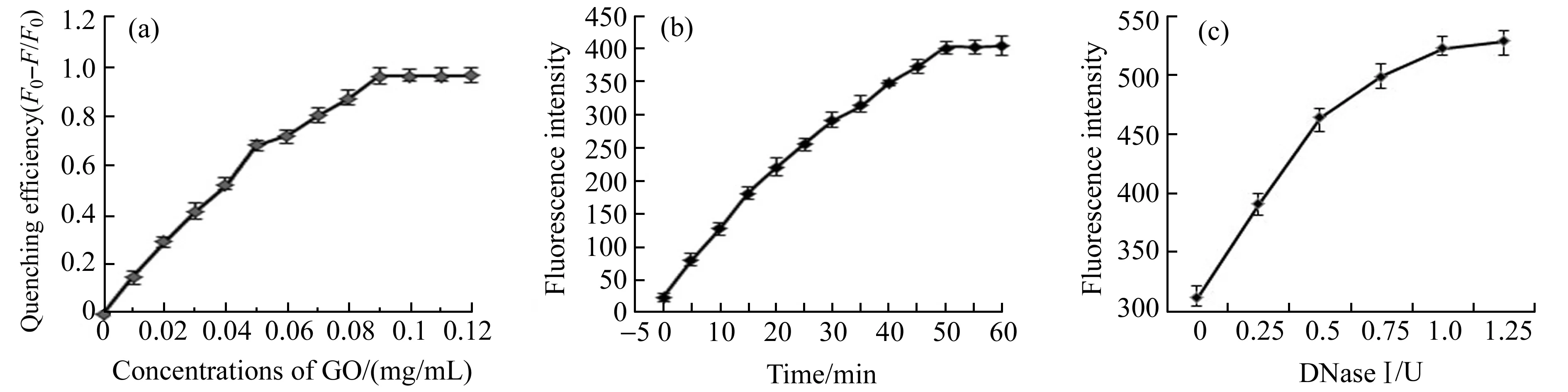
图2 检测条件的优化Fig.2 Optimization of detection system(a) Optimization of the concentration ratio of GO to TFP;(b) Optimization of fluorescence restoration time;(c) Optimization of the concentration of DNase Ⅰ.
2.3 可行性分析
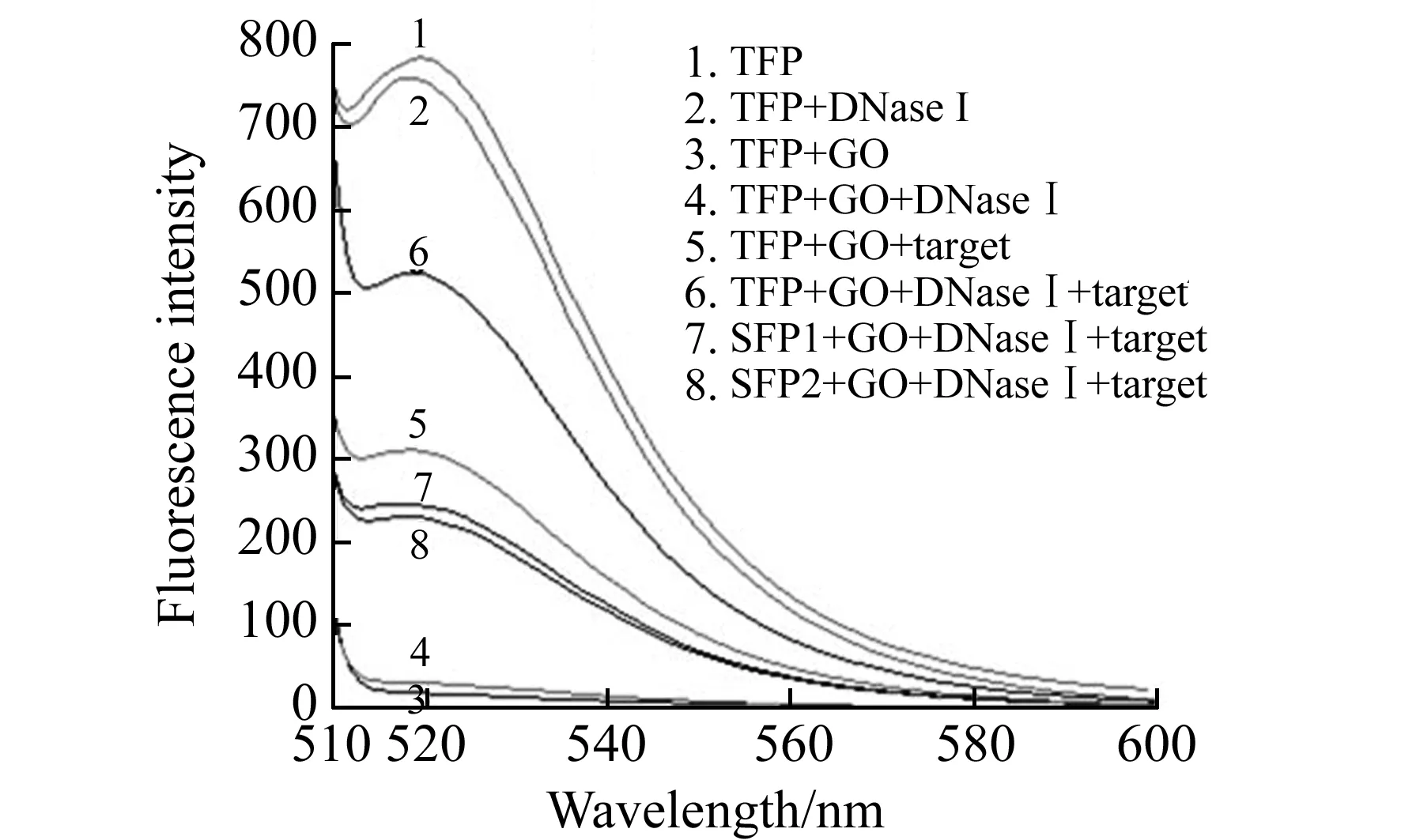
图3 可行性分析Fig.3 Feasibility assay
在不同条件下考察该生物传感器的可行性,如图3所示。无GO时,TFP的荧光强度要远大于其它组(图3曲线1);当DNase Ⅰ加入到TFP(图3曲线2)的荧光强度与TFP(图3曲线1)单独存在时相近,说明DNase Ⅰ对FAM基本没有影响。然而当GO加入该体系后,荧光猝灭效率达到95%以上,表明TFP吸附在GO表面已达到饱和状态,由于共振能量转移荧光被猝灭(图3曲线3);当DNase Ⅰ 加入到TFP/GO中,荧光信号几乎不产生变化,表明GO能够保护TFP而不被DNase Ⅰ降解(图3曲线4);当加入60 nmol/L的靶标,荧光信号恢复(图3曲线5),表明TFP通过捕捉探针与靶标RNA特异性结合,使得探针从石墨烯上脱离下来;当在检测体系中加入DNase Ⅰ(图3曲线6),检测到的荧光值远远高于曲线5,表明DNase Ⅰ随机裂解了体系中自由存在的ssDNA、dsDNA,靶标被释放参与到下一个循环,同时产生更多游离的FAM;与曲线6相比,当探针1(图3曲线7)与探针2(图3曲线8)单独存在时,荧光值增加并不显著,表明两个FAM标记的探针能极大的提高检测的荧光强度。基于以上结果,新构建的生物传感器用于检测金黄色葡萄球菌,不仅能成功的检测靶标还能显著提高检测的灵敏度,因此该体系是可行的。
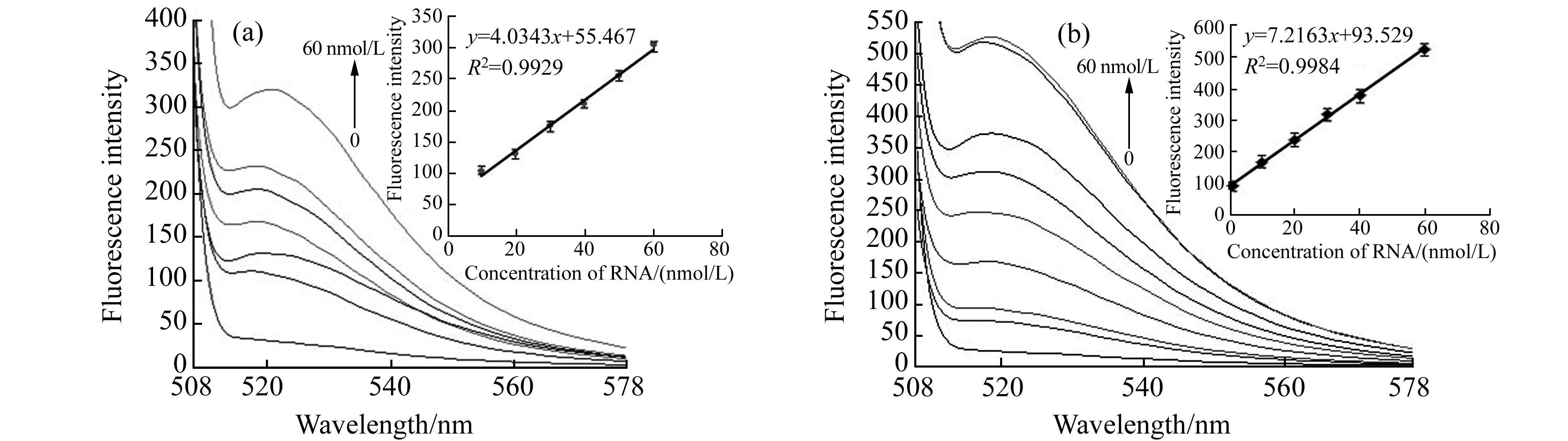
图4 加入DNase Ⅰ前(a)、后(b)TFP对不同靶标RNA序列浓度的检测Fig.4 Detection of target RNA at different concentrations by TFP/GO without (a) and with (b) DNase Ⅰ
2.4 对16S rRNA靶标序列的检测
为考察TFP对序列的检测限及DNase Ⅰ的放大效果,将TFP/GO复合物在不加入和加入DNase Ⅰ两种条件下,分别对不同靶标RNA浓度进行了荧光测定,结果如图4所示。当不存在DNase Ⅰ时,在靶序列浓度为10~60 nmol/L的范围内,荧光值与靶序列呈现良好的线性关系,如图4(a)所示,其检测限为10 nmol/L。当DNase Ⅰ和靶序列同时加入TFP/GO复合物,室温孵化后检测其荧光值,如图4(b)所示,在0.3~60 nmol/L的浓度范围内,随着靶标浓度的不断增加,荧光值也不断增大,当靶标浓度大于60 nmol/L时荧光值无明显增加,说明60 nmol/L靶标与50 nmol/L探针的结合达到饱和。RNA浓度在1~60 nmol/L的范围内,荧光值与靶标RNA浓度呈现良好的线性关系,检测限可达0.3 nmol/L。可见DNase Ⅰ的加入使得检测限大幅度下降,显著提高了该传感器的灵敏度。
2.5 对金黄色葡萄球菌的灵敏度和特异性分析
传感器对靶标RNA的检测限低并不意味着它在实际菌种检测中的性能好。因此我们使用该生物传感器检测了不同浓度的金黄色葡萄球菌,如图5所示。在50~107CFU/mL的浓度范围内,荧光强度随着菌体浓度的增大而增大,当菌体浓度大于107CFU/mL时荧光值已无明显增加,说明探针与菌中靶标RNA的结合已达饱和。在102~107CFU/mL浓度范围内,荧光值与菌体浓度呈良好的线性关系,且检测下限低至50 CFU/mL。结果表明该传感器能在总RNA组中捕捉16S rRNA,而且具有很高的灵敏性,因此在实际样品分析中具有很大的应用前景。
此外,我们还对该传感器的特异性进行了探究,向制备好的TFP/GO体系中,分别加入相同浓度的6种菌的16s rRNA,在相同条件下反应后测定荧光值。如图6所示,1号菌为靶标金黄色葡萄球菌,其检测到的信噪比为10.37,而表皮葡萄球菌、腐生葡萄球菌、铜绿假单胞菌、大肠杆菌的信噪比分别为2.37、2.17、1.4、1.27。表皮葡萄球菌、腐生葡萄球菌检测到的信噪比略高于铜绿假单胞菌和大肠杆菌,可能由于这两种菌与金黄色葡萄球菌均属于葡萄球菌属,存在一定的同源性。但是其信噪比远低于靶标菌,而且一般来说,只有当信噪比大于3才有检测意义,结果说明该生物传感器对金黄色葡萄球菌具有高度选择性,能够区别同属不同种的细菌,因此在临床病原菌的检测中具有良好的应用前景。

图5 TFP/GO传感器对不同浓度靶标菌的检测Fig.5 Detection of target bacteria at different concentrations
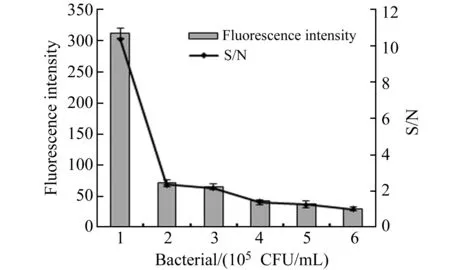
图6 生物传感器的特异性分析Fig.6 Specific detection of biosensor 1.S.aureus;2.S.epidermidis;3.S.saprophyticus; 4.P.aeruginosa;5.E.coli;6.Black.
3 结论
本研究根据共振能量转移、荧光叠加原理,以金黄色葡萄球菌的16S rRNA为靶标,构建了基于酶促信号放大GO与16S rRNA核酸探针纳米生物传感器。该生物传感器采用了双荧光标记法,使荧光强度增大,并通过DNase Ⅰ降解DNA的特性,靶标分子能被循环检测,同时产生多个荧光分子,从而大幅降低了该生物传感器的检测限。将靶标与DNase Ⅰ同时加入,检测时一边识别靶标,一边进行酶切作用,大大提高了检测效率,检测所需时间不到2 h。方法兼具选择性强、操作简单、成本低廉等优势,有望应用于临床诊断、食品检验等领域。此外更换基于16S rRNA的探针还可应用于其他病原菌、癌细胞、寄生虫等其他生物靶标的检测。
