中国绿水螅抗坏血酸过氧化物酶基因的克隆、抗体制备及表达分析
2019-03-11田晓晓董文芳王茹梦潘红春
张 行 田晓晓 董文芳 王茹梦 潘红春
(安徽师范大学生命科学学院, 重要生物资源保护与利用研究安徽省重点实验室,生物环境与生态安全安徽省高校省级重点实验室, 芜湖 241000)
即使在最适条件下, 植物的叶绿体、线粒体以及与生物膜偶联的电子传输系统都能产生活性氧(Reactive oxygen species, ROS)[1—3], 根据是否含有静电荷可分为自由基ROS (含静电荷)和非自由基ROS(不含静电荷), 其中H2O2是相对稳定的非自由基ROS。在正常生理状态, 包括H2O2在内的ROS作为光合氧化碳循环及光呼吸作用等代谢途径副产物在植物细胞中不断合成[4, 5]; 而在病原体感染、植株被外力伤害、紫外线辐射、强光辐射、干旱、盐碱腐蚀及温度剧烈变化等生物或非生物压力胁迫时, 植物细胞内ROS含量会明显增加即所谓的氧化迸发[6]。ROS在细胞内的累积会引起氧化压力, 从而对蛋白质、DNA和脂质等生物大分子产生氧化性损伤, 因此ROS的产生和清除之间的平衡对于保持植物细胞正常生理功能非常关键[7, 8]。植物细胞内的抗氧化酶系统是抵抗ROS的主要因子, 其中APX是植物细胞清除H2O2代表性的抗氧化酶[9]。APX利用抗坏血酸(Ascorbate, AsA)作为特殊电子供体将H2O2还原为H2O, 同时伴随着单脱氢抗坏血酸(Monodehydroascorbate, MDAsA)的产生。植物细胞有2种途径可以把MDAsA还原成AsA。第一种途径是通过NAD (P)H依赖的单脱氢抗坏血酸还原酶(MDAsA reductase)的作用直接把MDAsA还原成AsA; 第二种途径是MDAsA可以自发地转变成AsA和脱氢抗坏血酸(Dehydroascorbate, DAsA), 接着脱氢抗坏血酸还原酶(DAsA reductase)利用谷胱甘肽(Glutathione, GSH)把DAsA还原成AsA, 而被氧化的GSH再通过GSH还原酶的作用被还原成GSH[10]。因此, 植物细胞清除H2O2主要赖以APX与AsA-GSH循环的协同作用。
综上所述, APX是植物细胞内重要的抗氧化酶,还由于目前已鉴定的APX酶蛋白或克隆到的APX基因绝大部分来自植物界物种[11], 所以一般认为APX是植物界特有的蛋白。尽管如此, 在非植物界的少量物种中也发现了APX蛋白或APX基因[12, 13],Mathews等[12]通过生物化学方法测定到了棉铃虫(Helicoverpa zea)整体匀浆液具有APX活性, 这是在动物体中首次发现APX, 但未见后续关于棉铃虫APX基因克隆的相关研究; 随着核酸测序技术特别是高通量测序技术的发展, 获得的各类动物表达序列标签(Expressed Sequence tags, ESTs)及基因组数据呈现爆发式增长, 通过生物信息学分析陆续在鞭毛虫(Thecamonas trahens)、堡礁海绵(Amphimedon queenslandica)、2种水螅(H. vulgaris及H. viridissima)[14, 15]、3种寄生于鲑鱼体内的甲壳纲动物(Caligus clemensi,C.rogercresseyi和Lepeophtheirus salmonis)及腕足动物海豆芽(Lingula anatina)中发现了APX基因序列, 但目前对非植物界物种的APX基因的来源及其编码蛋白的生理功能知之甚少。基于此, 本研究基于刺胞动物门两种水螅(H.vulgaris及H. viridissima)APX基因比对后保守区序列数据设计引物[14, 15], 运用RACE技术克隆了中国绿水螅(H. sinensis)APX基因全长cDNA序列, 并进一步利用原核表达系统表达了重组APX蛋白, 再把该重组蛋白作为抗原免疫新西兰兔制备APX多克隆抗体。在此基础上, 采用实时定量PCR及免疫印迹方法对中国绿水螅APX表达模式进行了初步分析。因此, 本研究为探讨水螅APX基因的来源和进化、以及进一步了解APX在水螅生理活动过程中的作用等方面提供基础资料。
1 材料与方法
1.1 实验材料
中国绿水螅(H. sinensis)原种采集于广东省惠州市东江流域, 从野外采集的水螅活体标本中选取1只个体单独培养, 据此建立中国绿水螅单克隆无性繁殖系。每天用丰年虫(Artemiasp.)幼虫喂食水螅1次, 喂食后及时更换培养液。水螅培养液由冷却后充氧的单蒸水配制(配方为: 1 mmol/L NaCl,1 mmol/L CaCl2, 1 mmol/L KCl, 0.1 mmol/L MgSO4,1 mmol/L Tris, pH 7.4)。中国绿水螅单克隆无性繁殖系长期保持在培养条件稳定的光照培养箱内[温度(25±0.5)℃, 光照度2000 lx, 每天光照12h]。
1.2 中国绿水螅SMART RACE cDNA文库的制备
挑取50只中国绿水螅, 饥饿2d后采用RNA抽提试剂盒(Sangon, 中国)提取总RNA, 再使用mRNA分离提纯试剂盒(Sangon, 中国)从总RNA中纯化mRNA。以mRNA为模板, 采用SMART RACE cDNA文库构建试剂盒(Clontech, 美国)制备RACE cDNA文库[16],cDNA文库冻存于-80℃低温冰箱备用。所有实验操作参照试剂盒说明书。
1.3 5′RACE及3′RACE
根据GenBank中2种水螅(H. vulgaris, XM_002158468;H. viridissima, AY608909)APX基因cDNA序列, 运用Clustal 2.0软件[17]比对二者序列数据以分析保守序列, 再采用Oligo 7.0软件设计两条引物5′APX及3′APX(表 1)。其中引物5′APX与试剂盒接头引物5′adapter primer(表 1)配对进行5′ RACE;引物3′APX与试剂盒接头引物3′ adapter primer(表1)配对进行3′ RACE。RACE PCR反应体系及反应程序参照SMART RACE cDNA文库构建试剂盒说明书。扩增产物经1.0%琼脂糖凝胶电泳, 然后在凝胶成像系统上检测。PCR产物经切胶纯化后与pMD 18-T克隆载体连接, 连接液转化E. coliJM109菌株。菌落PCR方法筛选阳性克隆, 阳性克隆送往上海生工生物工程技术服务有限公司进行双向测序。
1.4 APX基因全长cDNA序列的克隆
根据5′RACE和3′RACE PCR产物测序结果设计用于扩增中国绿水螅APX基因全长cDNA序列的特异性引物APX-F及APX-R(表 1), PCR反应体系含10×buffer 5.0 μL, 25 mmol/L MgCl26.0 μL, 2.5 mmol/L dNTP 1.2 μL, 上、下游引物(10 μmol/L)各1 μL,TaqDNA聚合酶1.2 μL(5 U/μL), 模板(中国绿水螅SMART RACE cDNA文库)3 μL, 使用灭菌去离子水将反应总体积补至50 μL。反应体系在94℃预变性5min, 然后进入如下循环: 94℃变性30s, 48℃退火30s, 72℃延伸60s, 循环次数为35, 循环结束后再72℃延伸8min。扩增产物经1.0%琼脂糖凝胶电泳,然后在凝胶成像系统上检测。PCR产物经切胶纯化后与pMD18-T克隆载体连接, 连接液转化E. coliJM109菌株。菌落PCR方法筛选阳性克隆, 阳性克隆送往上海生工生物工程技术服务有限公司进行双向测序。再采用质粒抽提试剂盒(Sangon, 中国)提取重组质粒pMD18-T-APX。
1.5 APX基因编码区全长DNA序列的克隆
挑取50只中国绿水螅, 饥饿2d后采用动物细胞总DNA抽提试剂盒(Sangon, 中国)提取总DNA, 再使用DNA纯化试剂盒(Sangon, 中国)纯化总DNA。以总DNA为模板, 使用Long PCR试剂盒(Sangon, 中国)扩增APX基因编码区全长DNA。Long PCR实验操作参照试剂盒说明书。PCR产物经切胶纯化后送往上海生工生物工程技术服务有限公司进行测序。

表 1 本文所用引物序列Tab. 1 PCR primers used in the study
1.6 生物信息学分析
将测得的中国绿水螅APX基因全长cDNA序列通过DNAClub软件进行编码蛋白的氨基酸序列的预测, 在SOPMA (https://npsa-prabi.ibcp.fr/cgibin/secpred_sopma.pl)网站在线分析蛋白质二级结构, 在SWISS-MODEL网站(http://swissmodel.expasy.org/interactive)通过同源建模方法预测蛋白质三级结构。蛋白质高级结构3-D图像文件通过生物图像分析软件AntheProt_3D进行解析。
将预测的中国绿水螅APX氨基酸序列在NCBI网站进行蛋白质BLAST在线分析, 获得相应的同源序列; 再将中国绿水螅APX氨基酸序列与其同源蛋白质氨基酸序列数据通过Clustal 2.0软件[17]进行比对。基于APX氨基酸序列数据进行分子系统发生分析时, 内群包括不同来源的44个同源序列, 外群为来自于真菌界的3个同源序列。使用Modeltest 3.7检验序列数据并选择合适的建树参数模型[18]。通过PAUP 4.0b10软件[19], 基于Jones-Taylor-Thornton模型用最大似然法(Maximum-likelihood, ML)重建分子系统发生树。ML系统发生树中各节点的置信度由全部运算1000次自引导法重复检验。另外, 使用MrBayes 3.2.3软件[20], 基于Jones-Taylor-Thornton模型并同时启动4条马尔可夫链(包括冷链1条, 热链3条)。以随机树为起始树, 运行3×106代, 每100代对系统树进行重新取样构建贝叶斯树(Bayesian inference tree, BI), 系统发生树各节点的置信度通过后验概率(Posterior probability, PP)检测。
1.7 APX基因的原核表达及重组蛋白的纯化、浓缩与鉴定
为制备中国绿水螅APX重组蛋白, 根据原核表达质粒pET-GST的多酶切位点种类及目的基因核苷酸序列特征设计及合成引物PE-APS-F(含BamHⅠ酶切位点)及PE-APS-R(含EcoR Ⅰ酶切位点)(表 1)。但中国绿水螅APX基因编码区的586—591位点有一个BamH Ⅰ酶切位点, 1044—1049位点有一个EcoR Ⅰ酶切位点。为人工突变(核苷酸位点突变但对应的氨基酸位点不变化)这2个酶切位点, 我们设计了APS-OEP-1, APS-OEP-2及APSOEP-3等3条引物用于重叠延伸PCR(表 1)。引物PE-APS-F和引物APS-OEP-2配对、以本研究制备的重组质粒pMD18-T-APX为模板扩增PCR产物Ⅰ;引物APS-OEP-1和引物APS-OEP-3配对、以质粒pMD18-T-APX为模板扩增PCR产物Ⅱ; 再以上述的PCR产物I和PCR产物Ⅱ为引物(50 μL PCR反应体系中各加1 μL)、无需添加模板进行重叠延伸PCR反应扩增PCR产物Ⅲ; 最后引物PE-APS-F和引物PE-APS-R配对、以PCR产物Ⅲ为模板扩增PCR产物Ⅳ。
采用高保真PCR试剂盒(TaKaRa, 日本)进行上述的系列PCR反应, PCR反应体系及反应程序参照试剂盒说明书。PCR产物Ⅳ及原核表达质粒pETGST[21]分别用BamH Ⅰ及EcoR Ⅰ双酶切, 酶切产物各自经切胶纯化后连接, 再通过分子克隆方法制备重组质粒pET-GST-APS。重组质粒pET-GSTAPS转化E. coliBL21 (DE3)菌株, IPTG诱导表达重组蛋白。诱导表达后的E. coliBL21 (DE3)菌体经超声破碎后采用Ni-NTA His-Band树脂亲和层析柱试剂盒(Qiagen, 德国)纯化重组蛋白, 再使用蛋白质浓缩管通过离心方法浓缩重组蛋白。浓缩后的重组蛋白先进行SDS-PAGE电泳, 然后再电转移至PVDF膜上, 再按照潘红春等[22]的方法测定重组蛋白N末端10个氨基酸残基的序列以鉴定重组蛋白。
1.8 多克隆抗体制备
用于免疫的新西兰兔分为免疫组(1只)与对照组(3只), 免疫组被注射弗氏佐剂与重组APX蛋白的乳化剂, 对照组被注射弗氏佐剂和PBS的乳化剂。每组动物在第0、第2、第4及第6周各免疫1次, 共4次。第1次基础免疫使用弗氏完全佐剂, 后3次加强免疫均使用弗氏不完全佐剂, 采用背部皮下多点注射免疫方法。分别于第0、第2、第4、第6及第8周静脉采血, 共5次。通过ELISA方法确定抗血清针对抗原蛋白的效价, 采用Protein A sepharose CL-4B亲和层析试剂盒(PrimeGene, 中国)从抗血清中分离纯化APX多克隆抗体[23]。
1.9 APX基因表达分析
在不同光照时长条件下培养中国绿水螅 准备7台光照培养箱[温度(25±0.5)℃, 光照度2000 lx],光周期分别设置为0 L∶24D(在1个24h周期内光暴露0h、黑暗24h)、4 L∶20D、8 L∶16D、12 L∶12D、16 L∶8D、20 L∶4D及24 L∶0D。每个培养箱放3个培养盒, 每盒放中国绿水螅200只。每天喂食1次,喂食后30min时换培养液。连续培养水螅30d。
qPCR分析 在不同光照时长条件下培养中国绿水螅的实验结束后, 从每个培养盒中挑取50只中国绿水螅, 饥饿2d后采用RNA抽提试剂盒(Sangon, 中国)提取总RNA。以总RNA为模板, 采用Prime Script™ 1st Strand cDNA Synthesis Kit (TaKaRa, 日本)试剂盒合成第一链cDNA。具体实验操作按试剂盒说明书进行。
根据本研究得到的中国绿水螅APX基因编码区序列设计用于qPCR的引物Q-APX-F及Q-APXR(表 1), 再根据3种刺胞动物Actin基因cDNA序列(AY423388, XM_002154426及M32364)比对后结果选取其中完全保守区序列设计引物Q-Actin-F及QActin-R(表 1)。采用SYBR®Premix ExTaq™(TliRNaseH Plus)试剂盒(TaKaRa, 日本)和CFX96实时定量PCR检测系统(Bio-Rad, 美国)进行qPCR反应。具体qPCR反应体系及反应程序参照试剂盒说明书。同一样品重复3个反应, 以actin作为内参基因。反应结束后导出各样本的Ct (threshold cycle)值, 随后采用2-ΔΔCt法[24]进行数据分析和表达差异分析。采用SSPS 22.0 进行单因素方差分析, 使用Duncan’s multiple-range test进行相对表达分析,P<0.05表示存在显著性差异。
Western blotting分析 采用Western Blotting检测试剂盒(Baiaolaibo, 中国)进行Western Blotting分析[25], 实验操作参照试剂盒说明书。实验所用一抗为本研究制备的APX多克隆抗体, 二抗为辣根过氧化物酶标记山羊抗兔IgG (H+L)(Baiaolaibo,中国)。另外, 本实验以Actin为内参蛋白, 实验重复3次, 所用中国绿水螅Actin多克隆抗体为本实验室自备。在实验结束后, 采用Tanon全自动化学发光成像分析系统(Tanon, 中国)对PVDF膜进行图像采集和密度扫描分析。采用SSPS 22.0 进行单因素方差分析, 使用Duncan’s multiple-range test进行相对表达分析,P< 0.05表示存在显著性差异。
2 结果
2.1 中国绿水螅APX基因cDNA序列及DNA序列分析
依据近缘种APX基因序列设计引物, 进行了3′RACE及5′RACE, 再根据RACE产物的测序结果设计特异性引物通过分子克隆方法克隆了中国绿水螅APX基因cDNA全长序列(GenBank登录号:KU981066)。中国绿水螅APX基因cDNA序列总长1357 bp, 包括5′非编码区107 bp, 3′非编码区146 bp及开放阅读框(Open reading frame, ORF)1104 bp,共编码367个氨基酸, 预测蛋白质分子量为40.79 kD,等电点为8.36。BLAST分析显示中国绿水螅APX氨基酸序列中第50—229位点的区域属于植物性APX结构域同源片段。SOPMA在线分析显示中国绿水螅APX二级结构组成为α-螺旋占比38.42%, β-折叠15.26%, β-转角6.81%及无规则卷曲线39.51%。基于中国绿水螅APX氨基酸序列数据首先在SWISSMODEL网站上在线筛选用于建模的合适模型(5amm.1.A), 再基于这个模型进行蛋白质三级结构同源建模和检验。该蛋白三级结构主体框架和内核主要由α-螺旋构成, 而β-折叠主要分布在蛋白质的表面(图 1)。
为探讨中国绿水螅APX基因在基因组水平上的基因结构, 本研究依据其cDNA编码区两端序列设计一对引物(DNA-APX-F及DNA-APX-R, 表 1),以水螅总DNA为模板扩增了APX基因DNA序列,PCR产物的测序结果表明APX基因在基因组中没有内含子。
2.2 APX蛋白系统发生树的重建
基于中国绿水螅APX氨基酸序列进行BLAST分析时发现与之同源的蛋白质序列绝大部分属于植物界物种, 少数序列属于真菌界及动物界(涉及原生动物门、海绵动物门、刺胞动物门、节肢动物门及腕足动物门)物种。46个代表性同源序列与中国绿水螅APX氨基酸序列比对后进行分子系统发生分析, 结果表明, 以真菌界3个物种APX序列为外群, 植物界物种的APX序列聚为一单系群, 而动物界物种的APX序列聚为另一单系群(图 2)。
2.3 中国绿水螅APX基因的原核表达及多克隆抗体制备
通过在引物DNA序列中加入酶切位点的方法在中国绿水螅APX基因编码区两端加上酶切位点EcoR Ⅰ及BamHⅠ, 采用重叠延伸PCR方法优化了APX基因编码区cDNA序列, 再通过分子克隆方法制备了原核表达重组质粒pET-GST-APX, 测序及双酶切方法显示中国绿水螅APX基因的编码区cDNA序列成功插入原核表达质粒pET-GST。原核表达重组质粒pET-GST-APX被转化进大肠杆菌表达菌株E. coliBL21(DE3)中, 经IPTG诱导后成功表达重组融合蛋白GST-APX, 其分子量与预期大小(69.36 kD)接近, 并且该重组蛋白在诱导温度为32℃时主要以可溶性形式表达(图 3A—E)。先通过亲和层析方法纯化重组蛋白(图 3F), 再经浓缩后其浓度约为410 μg/mL。重组蛋白N末端10个氨基酸残基的序列测定结果(MSPILGYMKI)也直接证实了本研究成功表达了重组融合蛋白GST-APX。
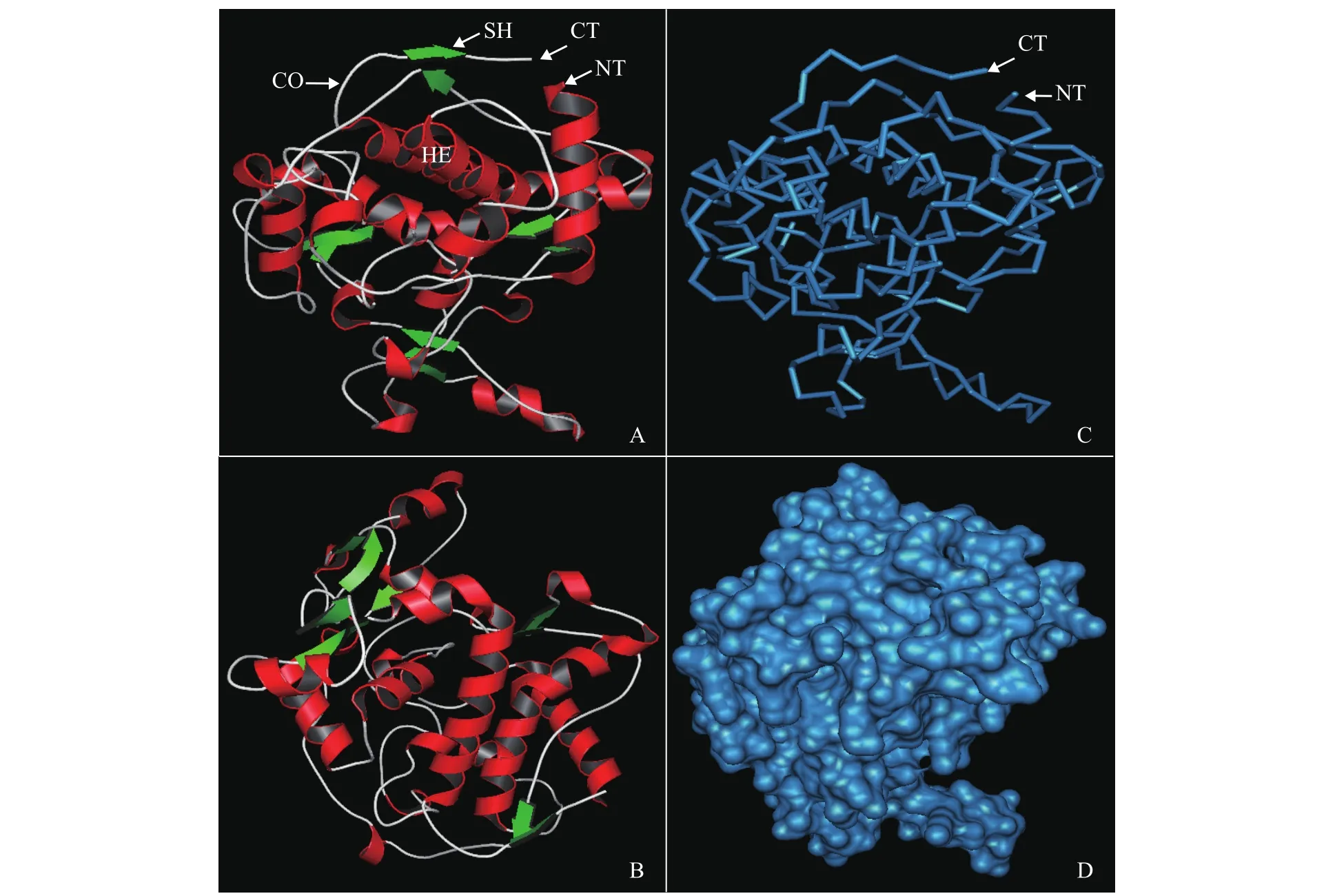
图 1 中国绿水螅APX三级结构的预测Fig. 1 The deduced tertiary structure of APX from H. sinensis
以上述纯化及浓缩后的重组蛋白GST-APX为抗原, 对实验兔进行了4次免疫。以1∶500起始稀释度按3倍的稀释倍率逐级稀释抗血清用于ELISA实验, 其中以首次免疫之前的兔血清(1∶500稀释)为阴性对照组, 以第4次免疫后的兔血清(1∶500稀释)为阳性对照组, 以样品稀释液为空白对照组。结果表明, 得到的兔抗血清效价为1∶1093500(图 4)。
2.4 中国绿水螅APX基因表达分析
在不同光照时长梯度(光强度恒定)下培养中国绿水螅30d, qPCR结果表明, 每天光照0、4h及8h实验组之间水螅APX基因转录水平差异不显著, 每天光照12h实验组转录水平开始明显升高, 每天光照16h、20h及24h实验组转录水平约为每天光照0实验组的2.5倍(图 5)。WB检测结果表明光照时间较长时(每天光照12h以上)绿水螅APX表达水平呈现明显的上调(图 6)。
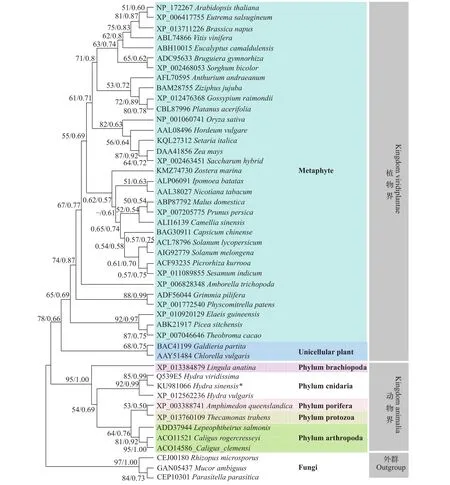
图 2 基于APX结构域氨基酸序列数据重建的ML树及BI树Fig. 2 Maximum likelihood tree and Bayesian inference tree based on amino acid sequences of APX domains
3 讨论
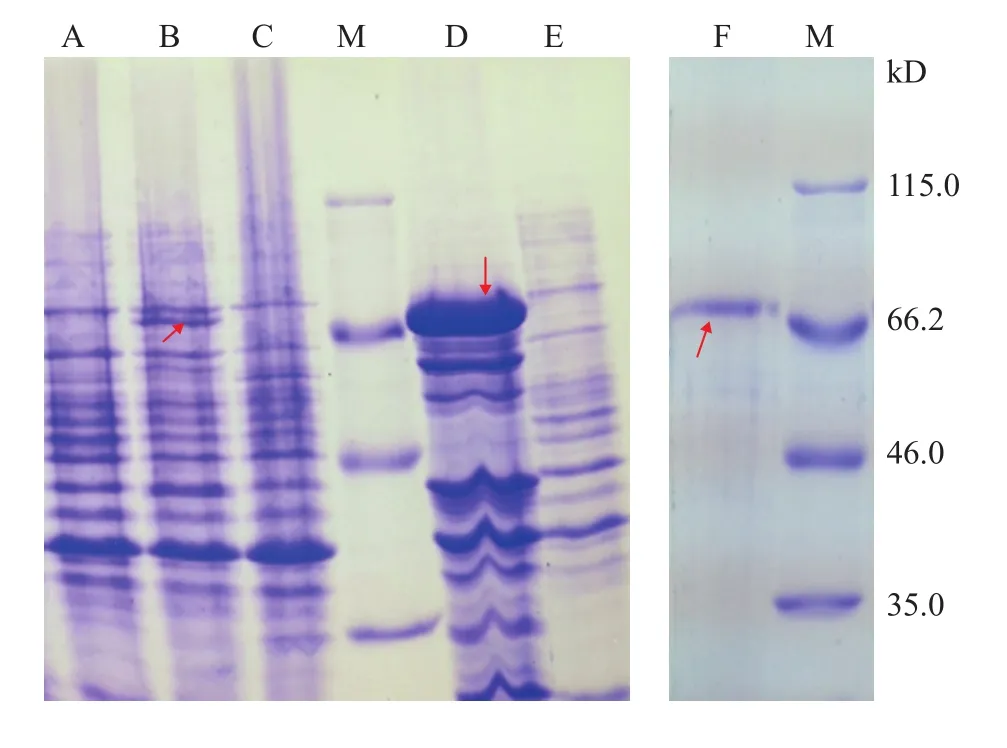
图 3 融合蛋白GST-APX的SDS-PAGE分析Fig. 3 SDS-PAGE of recombinant fusion protein GST-APX
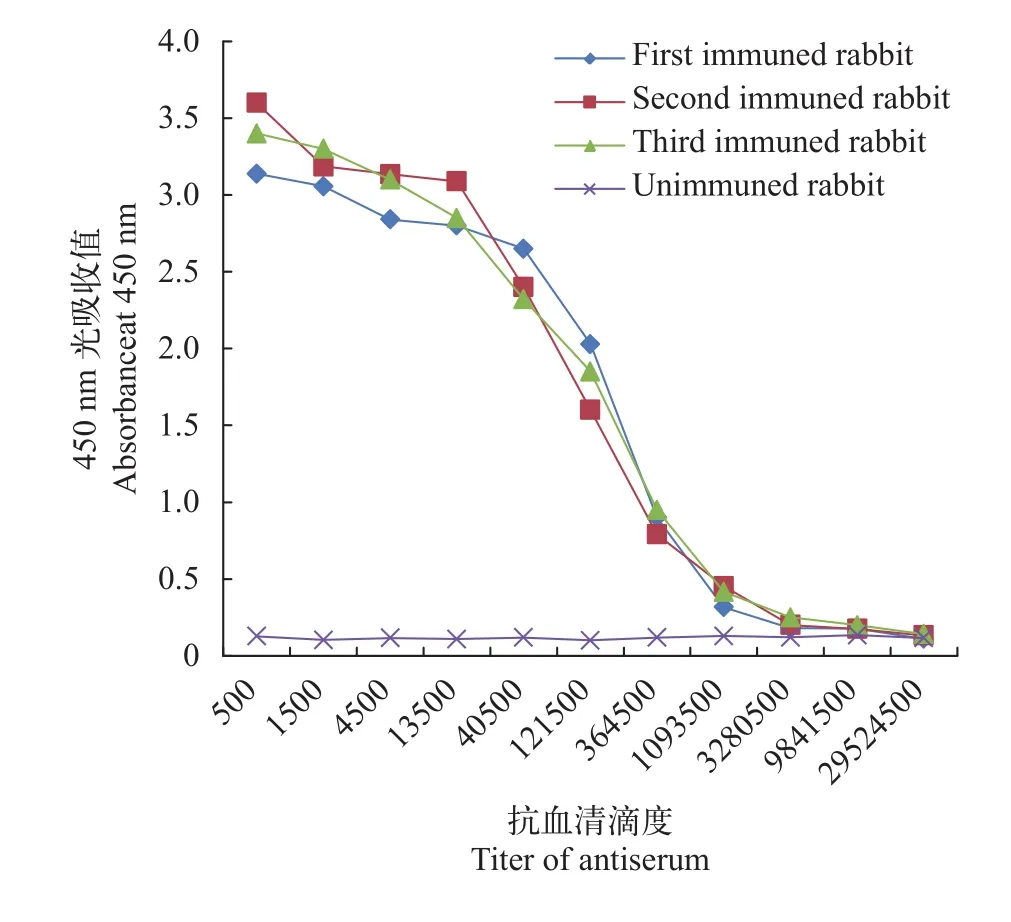
图 4 基于ELISA方法的融合蛋白GST-APX抗血清效价测定结果Fig. 4 Titration of antiserum to recombinant fusion protein GSTAPX using indirect enzyme-linked immunosorbent assay (ELISA)
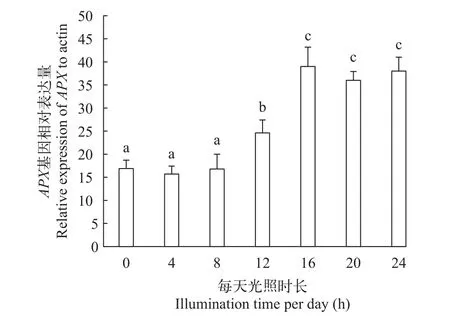
图 5 基于实时定量PCR分析显示的中国绿水螅在不同光照时长条件下APX基因相对表达水平Fig. 5 Relative expression levels of APX gene of H. sinensis under different illumination times
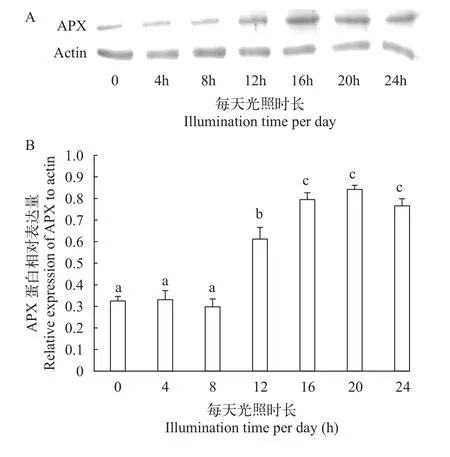
图 6 基于免疫印迹分析显示的中国绿水螅在不同光照时长条件下APX蛋白表达模式Fig. 6 APX protein level of H. sinensis under different illumination times
本研究从中国绿水螅中克隆到了APX基因, 该基因共编码367个氨基酸, 其中长度为180个氨基酸位点的区域为植物APX蛋白结构域同源片段。目前绝大部分已发现的APX酶蛋白或APX基因均来自植物界物种[26], 这主要是因为APX生理功能决定的。含有叶绿体的光合生物细胞中光合氧化碳循环及光呼吸作用等生理过程的副产物H2O2能引起细胞内生物大分子的氧化性损伤, 而APX能利用抗坏血酸(作为电子供体)、同时协同AsA-GSH循环将H2O2还原为H2O, 从而防止H2O2在光合生物体中的毒性堆积, 所以APX是植物细胞中不可或缺的抗氧化体系重要组成部分[26]。问题是包括本研究实验材料中国绿水螅在内的非植物界的少量物种(主要涉及真菌界及动物界)中也发现了APX蛋白或APX基因[12, 13], 特别是动物界中的原生动物门、海绵动物门、刺胞动物门、腕足动物门及节肢动物门等类群的一些物种中发现了APX基因存在[7](图 2)。这些动物APX基因的起源及进化历程值得深入探讨, 目前有以下3个方面的线索: 首先, APX前体或相关蛋白的编码基因可能在早期生命体中普遍存在, 植物类群由于光合氧化碳循环副产物H2O2的压力而保留了APX基因, 但大部分动物细胞由于没有光合作用产生H2O2的压力、因而可能在进化过程中逐渐舍弃了APX相关基因。如果是这样, 海绵和水螅等低等无脊椎动物尚且保留APX基因容易理解, 因为有许多低等无脊椎动物体内有单细胞藻类共生; 但进化地位较高等的节肢动物和腕足动物还保留APX基因可能有特别的原因、或者这些动物类群APX蛋白的功能可能进行了相应转变, 值得深入探讨。
其次, 有观点认为海绵动物和刺胞动物等低等无脊椎动物的祖先可能是许多不同类型单细胞生物“组合”而成[27], 动物APX基因的起源可能是这些不同单细胞生物早期融合的结果。本研究基于APX结构域氨基酸序列重建的系统发生树中单细胞动物和海绵动物聚为一支在一定程度上支持了这个假说(图 2)。最后, 海绵和水螅等一些低等无脊椎动物细胞中有单细胞绿藻共生, 这些动物的APX基因也有可能是从共生绿藻水平转移而来[28]。从基因组扩增的中国绿水螅APX基因DNA大小和序列看, 在基因组水平上中国绿水螅APX基因没有内含子, 欧洲绿水螅(H. viridissima)APX基因也没有内含子[15], 而植物APX基因具有内含子[29], 共生绿藻APX基因可能是通过RNA途径水平转移到了水螅细胞。但绿水螅APX基因不是来自现在的共生绿藻, 因为欧洲绿水螅与其共生绿藻之间APX结构域氨基酸序列的相似性较低(36%)[15], 这个现象说明绿水螅APX基因的来源及进化经历了相当复杂的历程, 不含共生绿藻的普通水螅(H. vulgaris)具有APX基因也映衬这个推测[14]。值得注意的是, 本研究基于APX结构域氨基酸序列重建的系统发生树中植物界物种聚为一单系群, 而动物界物种聚为另一单系群(图 2), 这说明动物界的APX基因有一共同起源。如果动物中的APX基因真是从共生的植物界物种水平转移而来, 在该系统树中具有APX基因的动物物种应该与植物界物种混杂排列。综上所述, 从现有证据看, 动物APX基因的起源目前尚难有定论, 有待进一步研究。
为探讨中国绿水螅APX蛋白的生理功能, 本研究在不同光照时长梯度下培养中国绿水螅, qPCR和WB检测结果均表明光照时间较长时(每天光照12h以上)绿水螅APX表达呈现一定程度的上调(图 5、图 6)。中国绿水螅是一个由动物与单细胞绿藻组成的典型共生系统[30], 即每个水螅内胚层皮肌细胞内共生20—30个绿藻个体, 宿主细胞为藻类提供CO2、含氮物质、矿物质、水及庇护所, 而绿藻利用光合作用为宿主提供O2、碳水化合物、氨基酸和其他有机物营养[31, 32]。中国绿水螅原种生活在华南热带及靠近热带的地区[30], 水温较高时水螅的食物水蚤等小型甲壳动物数量较少, 绿水螅此时面临食物缺乏的压力, 在这种情况下水螅体内共生绿藻向水螅细胞输送的来自光合作用的碳水化合物等营养物质是绿水螅维持正常生命活动和保持存活的关键。但是, 共生绿藻对于水螅细胞来说是双刃剑, 一方面共生绿藻能通过光合作用给水螅细胞补充营养物质, 另外一方面共生绿藻光合作用产生包括H2O2在内的活性氧也能直接危害水螅细胞, 所以水螅体内共生绿藻在长时间光辐射下其连续进行光合作用累积的大量活性氧一部分扩散到水螅细胞内[33—35], 此时水螅体内表达上调的APX可能参与清除细胞内的活性氧。
致谢:
感谢深圳大学生命与海洋科学学院汪安泰先生协助采集实验材料。
