微囊藻与水体细菌相互关系的研究进展
2019-03-11张蔚珍
张 佳 张蔚珍 王 欢 陈 隽 沈 宏
(1. 中国科学院水生生物研究所东湖湖泊生态系统试验站, 淡水生态与生物技术国家重点实验室, 武汉 430072;2. 中国科学院大学, 北京 100049)
近几十年来, 随着淡水水体富营养化程度的日益加剧, 有毒蓝藻水华在发生频率和数量上越来越严重。微囊藻是形成蓝藻水华的优势种属之一[1],其水华发生、发展及衰亡、降解机制一直是研究热点。目前普遍认为有害蓝藻水华发生的主要原因是蓝藻独特的形态和生理生化机制与外界环境因素共同作用的结果[2, 3]。
微囊藻为多细胞群体, 呈不规则形状, 群体胶被均质无色, 常具颗粒和伪空泡[4]。根据其形态学特征[5—7], 微囊藻可分为铜绿微囊藻Microcystis aeruginosa、放射微囊藻M. botrys、坚实微囊藻M.firma、水华微囊藻M. flos-aquae、鱼害微囊藻M.ichthyoblabe、挪氏微囊藻M. novacekii、假丝微囊藻M. pseudofilamentosa、史密斯微囊藻M. smithii、绿色微囊藻M. viridis、惠氏微囊藻M. wesenbergii等种类。微囊藻对环境因子的生理适应优势使其易在与浮游植物竞争中成为优势种[8, 9]。群体微囊藻对营养盐[9—11]、温度[12]、溶解氧[13]等具有较广的适应范围; 微囊藻具有独特的伪空胞结构, 可以调节自身在水层中的浮力, 以适应不利环境的胁迫[14, 15]; 微囊藻的胶鞘能保护自身抵御浮游动物捕食, 病毒和细菌的攻击等不利环境因素[17—19]; 某些微囊藻能通过分泌毒素抵御浮游动物和鱼类的觅食[20]。然而, 近些年越来越多的研究[21—23]表明, 水体中细菌对维持微囊藻群体的稳定性以及在蓝藻的腐烂降解过程中起着不可忽视的作用。
在水生态系统中, 细菌是最为敏感并极易受环境影响的生物类群。细菌不仅是水体中浮游生物的重要组成部分, 而且影响水体中物质循环和能量流动过程[24, 25]。在海洋和淡水环境中, 浮游植物和细菌都是微生物环中最主要的成分[26—28]。细菌是浮游植物无机氮的主要提供者, 也是无机磷的重要提供者。细菌既可将颗粒有机碳(POC)分解转化为溶解性有机碳(DOC), 并进一步矿化为营养盐供浮游植物利用, 又可吸收DOC合成自身成分, 所形成的细胞颗粒通过浮游动物的摄食进入上一营养级。水体中浮游细菌的生存及生命活动决定着其中食物链基本环节的发展[29]。湖泊营养水平不同,水体中细菌的种群结构和数量也明显不同[30]。
由此可见, 在富营养化水体中细菌与微囊藻的相互关系十分复杂, 细菌对微囊藻水华的形成和衰退起着重要作用。微生物群落在水生态系统中的结构和功能演替受到越来越多的关注, 有关水生态系统中微囊藻与细菌在不同时空尺度的耦合关系,微囊藻与微生物的相互作用与反馈关系等已有大量研究。本文综述了国内外微囊藻与细菌相互关系的研究进展, 不仅有助于了解富营养化水体中藻-菌相互作用关系及蓝藻水华生消机制的理论问题, 而且将为水体富营养化治理、微生物控藻等技术提供新的思考。
1 水体中藻-菌群落结构特征
在水体中, 细菌群体根据生态位的不同可分为两种类型: 浮游菌群和附着菌群。在富营养化水体中, 微囊藻藻际空间中的附着细菌生活在一个独特的微环境中[31, 32], 这有别于浮游菌群和其他的颗粒附着菌群。虽然三种不同栖息场所的菌群都以变形杆菌门、拟杆菌门、放线菌门为主, 但是微囊藻附着菌群的多样性指数显著低于其他两大类群[33]。微囊藻附着菌群中占据优势的是α-、β-、γ-变形杆菌纲[34]。由此认为, 不同的可附着基质和噬藻压力可能是引起水体中浮游细菌与附着细菌在生物量、生产力、活性和群落组成上都存在较大差异的原因[31, 35—37]。
即使在相似的环境条件下, 富营养化水体中不同蓝藻水华的附着细菌群落结构既具有相似性, 又具有差异性[38]。研究结果表明, 这些附着细菌群落结构在丰度和多样性上相似, 都由变形杆菌门、拟杆菌门、放线菌门、疣微菌门、浮霉菌门五大类为主[39, 40], 然而在可操作分类单元OUT水平上差异显著, 表明了不同蓝藻基质上附着菌群在系统发生上的多样性[41]。此外, 不同的微囊藻种与其附着细菌之间也具有专一性。研究发现, 鞘酯单胞菌是微囊藻附着细菌中最常见的种类[42]。单胞菌属、沙雷氏菌属、屈挠杆菌科分别是与惠氏、水华、铜绿微囊藻表型相关的优势菌[43]。
有研究认为浮游植物群落演替是改变细菌群落组成的重要原因之一。水体中细菌群落结构与浮游植物群落演替之间具有一致性, 其中拟杆菌门中的黄杆菌科与硅藻密切相关, 放线菌门与微囊藻水华中浮游菌群关系密切[44]。此外, 对硅藻门拟菱形藻属和其微生物群落的相互作用研究发现细菌与本地宿主之间表现出互利共生的关系, 与外来宿主之间表现出偏利共生和寄生的关系, 暗示了藻菌之间的共进化关系, 这为进一步解释浮游植物与细菌在微生物环中的相互作用提供了依据[45]。
无论在水体还是底泥中, 微囊藻胶鞘都是附生细菌栖息的热点区域[46]。与水体中类似, 底泥中附着细菌群落具有高度的多样性, 种系型的多样性是典型的湖泊细菌, 包括潜在的致病菌和代谢毒素的细菌, 以及一些与环境中有机碎屑降解相关的不可培养微生物[47]。在富营养化浅水湖泊表层底泥(0—10 cm)中, 微囊藻占据总微生物量的60%—90%。在全年中, 底泥中的微囊藻群体生物量均大于或等于浮游微囊藻的生物量, 表明在一定的时期,底泥中的微囊藻群体能够对水体中进行补充[48, 49]。在夏季底泥微囊藻群体胶鞘中包含大量的非光合细菌, 约占40%, 且底泥中微囊藻附着细菌生产力显著高于水体中的微囊藻附着细菌[50]。
2 藻-菌相互作用
在富营养化水体中, 藻类大量繁殖, 在藻细胞的周围聚集着大量的细菌, 由此产生了藻细胞微环境[32, 51]。在藻细胞周围组成了一个独特的栖息场所, 其中的附着细菌可能与藻细胞的分解、营养循环有着直接或间接的联系。一方面, 光合自养的蓝藻为细菌增殖提供有机质, 细菌也可以为蓝藻提供非必需的生长因子; 另一方面, 细菌和藻类可以产生各种物质, 释放于水体中, 如抗生素、毒素、抗病毒物质等以利于对方的生长代谢或增强其抵抗能力[52]。一些学者对微环境的存在进行了研究[53, 54],表明在水体混合较差的环境中, 如温跃层, 浮游植物细胞的周围可形成微环境, 且藻细胞的大小影响其微环境的形成, 单个细胞只能在长度或者宽度大于20 μm时才能产生微环境; 较小的细胞聚合成大于20 μm的多聚体后, 也能形成微环境。
在藻-菌微环境中, 细菌的存在会影响藻类的聚集和解散[55]。一般研究认为, 细菌群落不会使健康的浮游植物细胞聚集, 而是在藻类衰老或聚集在一起时容易附生在藻类群体上, 并且它们能分解浮游藻类, 将颗粒有机碳分解成溶解有机碳[17]。然而,在蓝藻中的情况有些特殊。在野外水体中微囊藻一般以群体形态存在, 藻细胞被胶状基质黏在一起,基质中含有大量附生细菌。在衰老的群体微囊藻基质中, 其附生细菌往往能利用腐烂的微囊藻细胞中的营养供其生长; 而在健康的群体微囊藻胶被基质中, 其附生细菌则对宿主无毒害作用[46, 56]。目前关于微囊藻附着细菌功能的研究已有许多报道, 表 1简要总结了在藻细胞微环境中附着细菌对微囊藻生长的促进或抑制作用, 细菌在微囊藻群体的形成和维持过程的作用, 细菌参与的微囊藻水华的聚集和降解过程, 细菌对微囊藻毒素的降解作用等。
2.1 细菌促进微囊藻的生长
在藻际空间中, 大量附着细菌栖息在藻细胞的周围, 与微囊藻进行着密切的相互作用[51]。细菌不仅可以通过再矿化溶解有机碎屑促进微囊藻生长,也能够通过直接释放维生素等促生长因子促进微囊藻生长; 还能够通过营养物再生或微生物相互作用(例如资源竞争)等刺激作用间接促进微囊藻生长[57, 58]。Shi等[34]发现微囊藻附着细菌不仅能够作为微囊藻群体化的基质, 还可作为能量的来源。此外, 在微囊藻细胞和假单胞菌之间进行着磷转移,这一作用使得微囊藻胶鞘中附着细菌具有充足的磷。由此推断附着细菌可作为临时的磷储备库, 以满足微囊藻的生长[59]。还有研究表明, 微囊藻能够分泌较复杂的胞外有机碳, 有利于附着细菌的生长,并且能够通过刺激附着细菌分泌胞外酶, 释放无机磷, 加速微囊藻细胞的生长[60]。
随着宏基因组学的发展, 利用生物信息学的分析手段, 进一步揭示了附着异养细菌与微囊藻之间可能存在代谢途径互补等相互作用, 具体体现在氮代谢、硫代谢、脂肪酸代谢、维生素代谢以及芳香族化合物降解等方面[61]。此外, 具体的研究表明附着异养细菌依赖于微囊藻为其提供碳源和能源,细菌为微囊藻合成其生长必须的维生素B12, 这一相互作用有利于微囊藻的生长[62]。
2.2 细菌抑制微囊藻的生长
在水体中, 许多细菌都能够通过分泌灵菌红素PG, 达到强烈的杀藻效果。PG能够通过过氧化损伤细胞膜上的脂质和光合系统, 使细胞内代谢机制紊乱, 导致细胞坏死或凋亡[63]。沙门氏菌是一类溶藻细菌, 河氏菌属中也能够提取出同样的物质[63, 64]。此外, 基于这些基因组进行代谢组学分析还表明个别细菌能够参与完整的苯甲酸盐的降解代谢途径, 而该代谢物能抑制微囊藻的生长[62]。许多细菌, 如芽孢杆菌属、假单胞菌属、弧菌属、不动杆菌属和产碱杆菌, 都能够抑制微囊藻的生长[40, 57, 64]。近年来, 关于生物防治控制蓝藻水华的发生已受到广泛关注, 研究微生物与微囊藻之间产生的化感作用, 为用生物方法防治藻华的发生奠定了理论基础。
2.3 细菌参与微囊藻群体的形成和维持
研究表明, 自然水体中的微囊藻常以群体的形态存在。但是, 在实验室无菌传代多次后, 群体微囊藻逐渐解聚为单细胞微囊藻[65]。即使将室内培养的单细胞微囊藻再放置于富营养化水体中进行原位培养, 单细胞往往仍不聚集成群体[66]。然而,Shen等[67]将分离自野外微囊藻群体中的附着细菌与单细胞微囊藻共培养, 发现附着细菌能够促进单细胞微囊藻聚集形成群体。Wang等[68]进一步分离出能够促进微囊藻群体聚集的5株可培养附着细菌,发现异养细菌在促进微囊藻群体聚集方面具有种间特异性。以上研究表明附着细菌在微囊藻群体的形成和维持中占据着至关重要的位置。
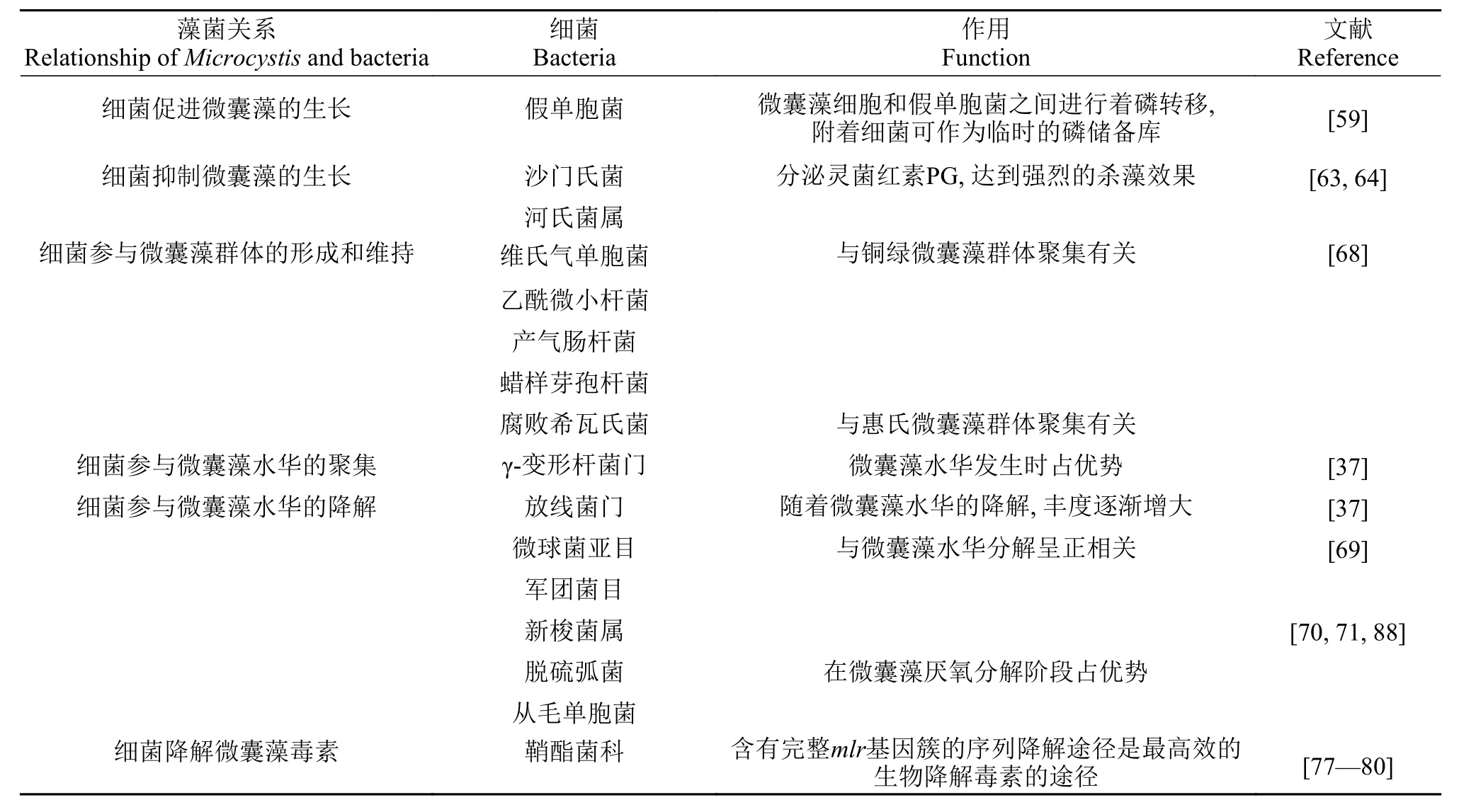
表 1 藻菌关系中微囊藻附着细菌的作用Tab. 1 The role of attached bacteria in the relationship of Microcystis and bacteria
2.4 细菌参与微囊藻水华的聚集和降解
微囊藻水华从聚集到降解的过程中, 浮游菌群和附着菌群动态差异显著。Parveen等[37]发现微囊藻水华在放线菌存在时显著减少, 而在γ-变形杆菌存在下显著增加。随着微囊藻水华的分解, 微球菌亚目和军团菌目都显著增加, 它们与微囊藻水华分解呈正相关[69]。由此推测某些细菌能促进微囊藻水华解聚。Xing等[70]从太湖微囊藻水华中分离到8株与微囊藻细胞厌氧降解有关的新梭菌属, 这些细菌参与了微囊藻水华的降解。Xie等[71]在太湖的原位围格实验研究中发现了某些与微囊藻水华分解密切相关的特殊细菌类群, 其中拟杆菌门的黄杆菌科的一个类群在微囊藻厌氧分解阶段占优势。
2.5 细菌降解微囊藻毒素
水体和底泥中的许多种类的细菌都具有降解毒素的能力, 包括变形杆菌门[72—74]、放线菌门、拟杆菌门、腐霉菌门和厚壁菌门[74—76]中的一些细菌。水体中细菌降解毒素的代谢途径有两种: 在鞘酯菌科中发现的由完整mlr基因簇介导的序列降解途径[77]和不具备mlr基因簇的替代降解途径[78]。通过比较这两种代谢毒素的途径, 发现含有完整mlr基因簇的序列降解途径是最高效的生物降解毒素的途径[79, 80]。此外, 底泥中也存在大量可降解毒素的细菌, 且具有较高的生物量和多样性, 因此, 底泥中的微囊藻毒素水平显著低于水体中的[81—83]。
3 藻-菌群落受环境因素的影响
水体中的细菌群落结构容易受到温度、溶解性有机碳(DOC)、溶解氧(DO)、氮磷营养盐浓度[84, 85]和pH等非生物因子以及生物因子如-浮游动物和鱼类觅食作用等的影响。在富营养化水体中, 微囊藻自身形态的变化与水体中DOC、Chl.a、DO、pH等环境因子的变化有着密切的联系, 细菌群落和浮游植物群落动态变化对环境因素变化的响应常具有一致性[44, 69, 71]。
3.1 温度
温度可以引起微囊藻附着细菌群落的变化。有调查研究表明水体中细菌群落的多样性与水体生产力和水温均呈现正相关关系[86]。Lawrence等[87]认为温度的升高可以提高水体异养细菌对基质的同化和吸收。此外, 微囊藻能够耐受夏季的高温环境[88], 在水体中占据优势地位, 其附着细菌以变形杆菌门占优势, 而放线菌门丰度较低[41]。实验表明放线菌仅在20℃的处理组中存在, 而在较高的温度时则消失[89]。由此可以解释水体中细菌群落和微囊藻群落同时受到温度的影响。
3.2 溶解性有机碳
DOC可以直接为异养细菌提供碳源[90]。水体中DOC浓度和水体生产力与细菌群落结构也有着密切的联系[84, 86, 87]。然而, 又有研究表明浮游植物的现存量, 而不是浮游植物的初级生产力显著地影响着浮游细菌的生长速率。Fuhrman等[91]认为细菌生长利用的DOC来源于腐败分解的浮游植物, 而不是健康的具有光合活性的浮游植物。在夏季高温、强光照的富营养化湖泊中, 微囊藻占据浮游植物的优势地位, 溶解性有机碳浓度与附着细菌群落多样性呈现出显著的负相关关系[92]。
3.3 溶解氧
水体中DO的降低可以引起微囊藻附着细菌群落结构的变化。在富营养化水体中, 蓝藻细胞的大量聚集和分解会导致DO的降低, 甚至导致缺氧环境。Li等[93]研究太湖中微囊藻水华引起的低氧区(DO<0.5 mg/L)细菌群落组成的动态变化时发现,梭菌属在缺氧的起始阶段占据优势地位, 而LD12簇的成员在缺氧后期被检测到, 脱硫弧菌和从毛单胞菌科在整个缺氧过程中均占优势。此外, Xing等[70]通过构建微囊藻厌氧降解的环境, 揭示出新梭菌属在微囊藻厌氧降解过程的重要地位和功能。
3.4 pH
细菌群落组成随着pH的变化而变化[94]。pH作为重要的环境参数, pH的改变可能是由于蓝藻水华期间浮游植物光合作用活性导致CO2分压降低引起的。在水华期间, 高pH和低DO共同影响着水体中的浮游植物和细菌群落结构的动态变化[95—97], 分别以蓝藻和α-变形杆菌纲、拟杆菌门占优势[85]。
3.5 觅食作用
鱼类对浮游动植物的觅食作用和对水体的扰动作用也会间接影响到水体中细菌群落的变化[98]。此外, 在水生微食物网中, 浮游细菌群落结构还会直接受到浮游植物和浮游动物生物量的影响[28, 98]。
4 展望
在微囊藻水华的形成和发展、衰亡和降解的整个过程中, 水体细菌的群落结构可以作为水生态系统直接、敏锐的指示。微囊藻与其附着细菌构成的微囊藻群体在生态环境的自然选择中共同进化, 研究细菌群落结构的特征对于理解微囊藻在水生态系统中的演变具有重要作用。然而, 关于底泥中与微囊藻相关的细菌群落结构的研究还很少, 对底泥中细菌群落结构的特征的研究有助于解释微囊藻在底泥中的越冬和春季复苏等生存对策, 为了解微囊藻水华形成的生活史提供依据。
目前, 有关自然水体中细菌群落组成和功能的研究具有一定的局限性, 大多数建立在高通量测序的基础上, 还有小部分集中在室内可培养微生物与微囊藻的相互作用基础上。基于以上研究方法, 人们很难了解水体中绝大多数细菌的生理生化特征和生态学功能。随着分子生物学的发展, 利用组学的手段, 结合生物信息学的分析方法, 可为进一步了解微生物群落中藻-菌之间的相互作用提供新的思路。
微囊藻微环境中含有丰富的有机质, 是微囊藻与其附着细菌相互作用的热点区域。藻际空间中的胞外物质作为藻菌之间联系的纽带, 是物质运输,能量流动和信息传递的介质。在微囊藻胞外物质中, 具有黏性的胞外多糖一直作为微囊藻群体聚集的指标。然而, 有关胞外多糖的分泌机制、其结构和功能的研究还有待完善。
最后, 有关微囊藻与细菌相互关系的研究在藻类生物技术领域的应用还有待开发。微囊藻附着细菌对于水体中的重金属污染治理、微囊藻毒素的降解和藻类水华控制等方面都具有潜在的应用。
