IL-18水平表达及IL-18基因多态性与哮喘病的相关性研究
2019-03-11钟丹丹马红慧刘加顺
钟丹丹 马红慧 刘加顺
(潍坊护理职业学院,潍坊262500)
哮喘是一种慢性炎症性呼吸道疾病,其发病率有逐年升高趋势[1]。遗传及环境等因素密切影响哮喘的病理过程,但作用机制尚未阐明[2]。细胞因子介导的免疫反应在包括哮喘在内的各种免疫性疾病中起主导作用,寻找新的细胞因子和其他治疗哮喘方法是最近研究的热点。IL-18是IL-1家族成员[3],在细胞免疫微调过程中发挥着重要作用[4],也可作为Th2细胞发育和IgE产生的辅因子,并在Th1细胞的分化中起重要作用[5]。Wild等[6]研究发现IL-18的表达水平与哮喘的发病有关,哮喘患者血清中IL-18水平较健康人显著升高,并报道了哮喘易感性的IL-18的多态性,表明IL-18可能与哮喘治疗有关。Rovina等[7]通过动物实验证实IL-18蛋白水平在肺炎加重期间升高,小鼠通过IL-18激活Th2细胞因子和气道嗜酸粒细胞增多而产生变应性哮喘。此外,李鑫等[8]在严重的哮喘患者痰液上清中也检测到IL-18。
诸多基因与哮喘易感性相关已经被国内外研究者发现,但因人体、地理位置、种族、生活环境等都存在差异,哮喘与IL-18的相关性研究报道在国内比较罕见。本文探究了IL-18-137G/C、-607C/A基因的多态性与哮喘患者的易感性是否相关,从遗传学角度进一步揭示哮喘的发病机制。
1 资料与方法
1.1一般资料 参照《全球哮喘防治指南》纳入自2016年3月到2017年9月我院就诊哮喘患者301例为研究对象(哮喘组),年龄为18~77岁,平均年龄(48.60±7.80)岁[9];选择同期于医院健康体检288例志愿者为对照组(健康组)。健康组年龄为18~79岁,平均年龄(49.30±7.80)岁;其他呼吸系统疾病均排除。本研究均获家属和患者同意并签同意书。
1.2实验方法
1.2.1DNA 提取 抽取所有研究对象空腹静脉血2 ml,于-80℃保存样本。使用DNA试剂盒(上海远见生物科技有限公司,D3392-01),依说明书操作,提取DNA。DNA浓度检测提取采用核酸蛋白仪(MPfastprep-24),DNA样本在-80℃保存备用。
1.2.2PCR扩增 引物按照Primer 5.0以及Oligo 6软件设计,IL-18基因-607位点、-137位点的特异性引物,见表1。
表1引物序列信息
Tab.1Primersequence

GenePrimer sequencLocus -607Forward5′- GTTGCAGAAAGTGTAAAAATTATTAC-35′-GT-TGCAGAAAGTGTAAAAATTATTAA-3′Reverse5′-TAACCTCATTCAGGACT-3 ′Quality control forward5 ′-CTTTGCTATCATTCCAG-3 ′Locus -137Forward5 ′-CCCCAACTTTTACGGAAGAAAAG-3 ′5 ′-CCCCAACTTTTACGGAAGAAAAC-3 ′Reverse5 ′-AGGAGGGCAAAATGCACTGG-3Quality control forward5 ′-CCAATAGGACTGATTATTCCGCA-3 ′
1.2.3测定血清IL-18水平 采集研究对象的空腹静脉血2 ml,血清离心备用,以-80℃保存。参照ELISA试剂盒(北京奥维亚生物技术有限公司)说明书测定血清IL-18水平。

2 结果
2.1测序和分型结果
2.1.1IL-18/-137G/C、-607C/A 基因分型PCR产物测序图 向反应体系中放入的引物为通用反向引物和内参照正向引物,在相同的条件下进行PCR反应,反应后的产物经琼脂糖凝胶电泳验证PCR成功后,进行基因测序。IL-18-607C/A测序结果,IL-18-137G/C基因分型PCR反应产物测序结果见图1和图2。
2.1.2IL-18基因多态性位点(IL-18/-607C/A,IL-18/-137G/C)电泳结果 IL-18基因-607位点、137位点的PCR总体系分别为25 μl,其中包括0.25 mmol/L dNTP,约30 ng的基因组DNA和1U Taq聚合酶,10×PCR缓冲液2.5 μl(含2.0 mmol/L MgCl2)。0.4 μmol/L特异性正向引物,0 .4 μmol/L质控正向引物,0.8 μmol/L共同反向引物。扩增参数:先预变性94℃ 4 min后相同温度变性20 s,然后退火62℃ 40 s,再延伸40 s温度控制在72℃,总计7个循环;再变性20 s温度控制为94℃,55℃退火40 s,然后72℃延伸40 s,总计35个循环。将特异性正向引物分别扩增的PCR产物2条进行电泳(在琼脂糖凝胶上20 g/L),40 min,80 V,采用溴化乙锭染色,观察结果和鉴定基因型采用紫外线凝胶成像系统。我们每份标本的PCR均分别采用两条特异性正向引物做两管,301 bp为质控条带处,196 bp为A/C等位基因特异性扩增片段处。
图3为IL-18 基因-607位点多态性检测结果。标本1、2只观察到长196 bp特异性扩增片段在C等位基因处,其基因型为CC;标本3、4长196 bp特异性扩增片段均可在PCR产物电泳后出现,其为CA基因型;标本5长196 bp特异性扩增片段均可在A 等位基因处再现,其为AA基因型。
图4为标本 IL-18/-137位点多态性检测电泳结果,质控条带在446 bp 处,G/C 等位基因特异性扩增片段为261 bp处。标本2、4、5只在G等位基因处观察到长261 bp特异性扩增片段,为GG基因型;标本3长261 bp特异性扩增片段在PCR产物电泳后可见,其为GC基因型;标本6为261 bp特异性扩增片段只在C等位基因处观察到,为CC基因型。
2.2IL-18基因多态性位点(IL-18/-607C/A,IL-18/-137G/C)的基因型及等位基因频率分布及影响哮喘风险基因 遗传平衡定律经Hardy-Weinberg检验后全部符合该定律(P>0.05),显示两组都具备群体代表性。与对照组相比IL-18基因(-607C/A)、3种基因型、等位基因等差异较大(P<0.05),差异具有显著统计学意义。差异性风险因子OR>1,这种情况的等位基因患病风险加大;哮喘组基因位点-137G/C的CC与GG基因型差异较大,对比差异具有显著统计学意义(P=0.023,P<0.05),其等位基因频率则差异较小,比较差异无显著统计学意义(P=0.054,P>0.05)。见表2。
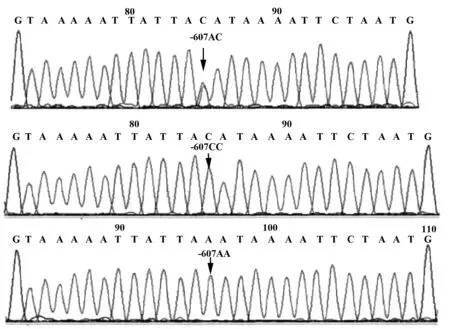
图1 IL-18/-607C/A多态性位点测序图Fig.1 IL-18/-607C/A polymorphism site sequencing diagramNote: The polymorphic loci of IL-18/-607C/A were AC type,CC type and AA type.

图2 IL-18/-137G/C多态性位点测序图Fig.2 Sequence map of IL-18/-137G/C polymorphic lociNote: The polymorphism of IL-18/-137G/C locus is classified into GG type,GC type and CC type.
2.3哮喘组与健康组两组不同IL-18水平对比 对照组IL-18水平(457.00±82.11)pg/ml高于哮喘组患者(48.68±7.03)pg/ml,差异具有显著统计学意义(t=85.34,P<0.001),说明血清中IL-18的水平与哮喘相关(图5)。
2.4不同基因型患者IL-18水平变化比较 哮喘患者血清IL-18的基因多态性位点(-607C/A)基因型AA与CC型差异极大(P<0.01),比较差异具有显著统计学意义,提示AA基因有增加患哮喘的风险。哮喘患者血清IL-18基因多态性位点(-137G/C)3种基因型差异较小(P>0.05),比较差异无显著统计学意义,见表3。

图3 IL-18/-607C/A位点多态性电泳图谱Fig.3 Polymorphism of IL-18/-607C/A locusNote: M.Standard reference material;1,2.CC genotype;3,4.CA genotype;5.AA genotype.
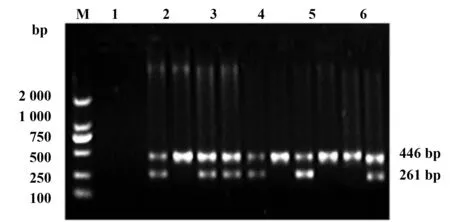
图4 IL-18/-137G/C位点多态性电泳图谱Fig.4 Polymorphism of IL-18/-137G/C locusNote: M.Standard reference materials;1.Negative control;2,4,5.GG genotype;3.GC genotype;6.CC genotype.
表2IL-18基因多态性位点的基因型及等位基因频率分布[n(%)]
Tab.2GenotypeandallelefrequencydistributionofIL-18genepolymorphicloci[n(%)]

SNPAsthma group(%)Healthy group(%)OR (95% CI)PIL-18/-607C/AAlleleC309(51.3)349(60.6)1A293(48.7)227(39.4)1.458(1.157-1.837)0.002GenotypeCC73(24.3)136(47.2)1AC163(54.1)77(26.7)3.944(2.662-5.842)<0.001AA65(21.6)75(26.1)1.615(1.043-2.500)0.031AC+AA228(75.7)152(52.8)2.795(1.968-3.969)<0.001IL-18/-137G/CAlleleC69(11.5)88(15.3)1G533(88.5)488(84.7)1.393(0.993-1.954)0.054GenotypeCC4(1.3)11(3.8)1GC41(13.6)68(23.6)1.507(0.443-5.120)0.508GG256(85.0)209 (72.6)4.063(1.104-14.96)0.029GC+GG297(98.7)278(96.2)2.671(0.828-8.617)0.088

图5 哮喘组和健康组外周血IL-8水平比较Fig.5 Comparison of IL-8 levels in peripheral blood of asthma group and healthy group
表3不同基因型患者IL-18水平变化比较(pg/ml)
Tab.3ComparisonofIL-18levelsindifferentgenotypes(pg/ml)

SNPIL-18FPIL-18/-607C/ACC18.02±3.92AC31.68±7.24213.3<0.001AA41.68±8.08IL-8/-137G/CGG31.51±7.31GC32.58±8.630.2810.755CC28.68±7.24
3 讨论
哮喘作为一种慢性呼吸系统疾病,迁延难愈,治疗困难,不仅对患者的生活质量造成了影响,还给患者造成了沉重的经济负担。目前世界上哮喘患病率在各国不断升高[10],生活环境及基因与哮喘病的发生关系密切[11]。
免疫球蛋白E(IgE)和T辅助细胞2型(TH2)细胞因子(包括IL-4、IL-5和IL-13)的过度产生可导致过敏性疾病。在哮喘发病机制中IL-4发挥着关键的介导作用,它在与对应的受体结合后通过转录激活子6(STAT6)与信号传导子的磷酸化介导产生相应的DNA转录,相应的细胞从而产生。在Th2细胞的分化和IgE的类别转换过程中,IL-4与 STAT6不可缺少[12]。IL-18可促进肥大细胞、T细胞、嗜碱性粒细胞分泌Th2细胞因子,同时可增加CD4+T细胞IL-4和STAT6依赖性方式IgE的产生。IL-18和T细胞受体介导的刺激可以诱导幼稚CD4+T细胞在体外发育成IL-4产生细胞。Th1/Th2 细胞释放的细胞因子不平衡是哮喘发病机制的关键。有学者证实,在哮喘患者血清中Th2类细胞因子IL-13、IL-4 等高表达,而IL-12、IL-2等Th1类细胞因子表达减弱明显。IL-18则能促进 T 细胞、嗜碱性粒细胞等分泌IL-4、IL-13,同时增强Th1免疫应答[13],Ghoreschi等[14]研究表明 IL-18 基因多样性与哮喘的恶化程度密切相关。这与IMBOD等[15]研究的关于过敏性哮喘和IL-18基因启动子1-137等位基因有关相符,且认为IL-18基因变异是过敏性哮喘重要遗传决定因素。
本研究显示对照组IL-18水平(457.00±82.11)pg/ml高于哮喘组患者(48.68±7.03)pg/ml,说明血清中IL-18的水平与哮喘相关;同时对IL-18编码基因-137G/C、-607C/A多态性的分析结果表明,哮喘患者血清IL-18的基因多态性位点(-607C/A)基因型AA与CC型差异极大(P<0.01),比较差异有显著统计学意义。提示AA基因有增加患哮喘的风险;表明携带AA基因型的人群患哮喘风险更大。这与杨慧等[16]提出IL-18在哮喘和过敏性鼻炎发病机制中所起的作用相符。
综上,哮喘患者血清IL-18表达水平降低,提示患者血清IL-18水平低下与哮喘的发病机制关系密切。IL-18多态性位点(IL-18/-607C/A,IL-18/-137G/C)的基因分型中携带(-607C/A)AA基因型的人群患哮喘风险更大。但考虑遗传因素、种族差异、环境因素、地域差异、样本大小之间有着复杂的相关性等原因,还需要进一步大样本、多中心的开展研究揭示哮喘的遗传学发病机制,为临床治疗提供循证学依据。
