1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物的合成及其抗惊厥活性
2019-03-08陈士龙郭东福喻圣旺何世辉赵文豪邓先清
陈士龙,郭东福,喻圣旺,何世辉,赵文豪,邓先清
1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物的合成及其抗惊厥活性
陈士龙,郭东福,喻圣旺,何世辉,赵文豪,*邓先清
(井冈山大学医学部,江西,吉安 343009)
合成一系列1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物,对其体内抗惊厥活性进行研究。以取代酚为起始原料,先后与1-溴-3-氯丙烷及1,2,4-三氮唑进行烷基化反应,得到目标化合物2a-2m。化合物2a-2m通过核磁共振氢谱、碳谱和质谱进行结构确证;采用最大电休克发作模型和皮下戊四唑模型评价目标化合物的抗惊厥活性,旋转棒法评价目标化合物的神经毒性。合成了一系列单烷基取代的三唑类衍生物,这些化合物对MES模型和Sc-PTZ 模型均有效,大部分在100 mg/kg剂量下表现出抗惊厥活性,使得该类化合物具有广谱的抗癫痫潜能。新合成的(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物具有较好的抗惊厥活性,使得该类化合物具有广谱的抗癫痫潜能。本研究进一步丰富了三唑类化合物的抗癫痫构效关系,同时为研究大发作和失神发作类癫痫的治疗药物提供了一定的基础。
三氮唑;抗癫痫;最大电休克发作模型;戊四唑
0 前言
癫痫是一种影响所有年龄人群的非传染性脑部功能紊乱慢性疾患。近年来,癫痫发病率逐年增高,已成为仅次于脑血管疾病的第二大神经系统常见疾患[1]。世界卫生组织调查数据显示,全世界癫痫患者人数已高达5000万,其中近80 %的癫痫患者在发展中国家,我国癫痫患者已超1000万[2]。最新流行病学研究表明,有近30 %的患者无法通过传统抗癫痫药物(AEDs)或其他治疗手段使病情得以控制,有近50%的癫痫患者平均寿命仅为55岁[3]。此外,这些AEDs治疗是对癫痫发作时的抑制,并不能阻断或延缓癫痫疾病的产生,需要患者长期服药(半年以上甚至终身),因此而带来了耐药性和毒副作用的问题。长期服用AEDs易导致肝脏功能损害、血液系统异常、皮肤损害等严重的副作用[4-7]。癫痫患者在生存质量明显下降的同时也给家庭和社会增加了大量的心理和经济负担[8-9]。以美国为例,每年新增的癫痫病患者达15万,每年医疗花费保守估计高达40~70亿美元[10],因此,开发新的AEDs仍然是癫痫治疗的重点。
三氮唑是一个药物设计领域重要的活性片段,它的芳香性和富电子性质使其易于与各种不同的酶和受体结合,从而赋予其广泛的生物活性。自20世纪后期三唑仑和艾普唑仑作为抗癫痫药物上市以来,药物化学家们设计合成了大量的三唑衍生物,用于筛选其抗癫痫活性,发现新的抗癫痫药物[11-13]。在之前的工作中,我们合成了大量三唑类化合物并评价了它们的抗癫痫活性。这些化合物的三唑环大多是与其他芳环稠合,或者直接与芳环单键相连,这样的连接方式可以使得芳环上的电子离域到三氮唑上,从而增强三唑环与受体的结合。但这种结构中的三唑环由于与其他基团紧密相连,在与受体结合时也可能因为空间位阻而降低亲和力,并且烷基单取代的三氮唑抗癫痫活性尚未见报道。基于以上原因,为了进一步阐明三唑类衍生物抗癫痫活性的构效关系,本研究设计了一系列烷基单取代的三氮唑衍生物,并采用最大电惊厥和皮下戊四唑模型初步评价了目标化合物的抗癫痫活性。
1 实验部分
1.1 仪器与试剂
核磁共振分析采用BURKER AV-300 型核磁共振仪,四甲基硅(TMS)为内标,溶剂用DMSO-d(Bruker, Switzerland);高分辨质谱采用UltrafleXtreme MALDI-TOF/TOF 质谱仪 (Bruker Daltonik GmbH, Leipzig, Germany)测定;熔点采用毛细管法测定(温度计未经校正)。实验所用试剂包括1,2,4-三氮唑 (99%,阿拉丁试剂公司)、各种取代酚(99%,麦克林试剂公司)、1-溴-3-氯丙烷(99%,麦克林试剂公司),和其他常规溶剂(分析纯,国药基团化工试剂有限公司)。
1.2 化合物合成
1.2.1化合物1a-1m的合成
以化合物1a(R = H)的合成为例:称取0.82 g(0.005 mol)苯酚、0.56 g(0.01 mol) KOH于装有3.0 mL DMSO的50 mL圆底烧瓶中,在常温下用磁力搅拌器进行机械搅拌反应,5 min后滴加1.57 g (0.01 mol)1-溴-3-氯丙烷,继续常温反应6 h。反应每隔1 h,用薄层色谱法TLC(展开剂为石油醚:乙酸乙酯= 3:1)检测反应是否完全。当确定反应完全后停止反应,向反应液中加入30 mL水,用二氯甲烷(20 mL*3)萃取3次,再用盐水(30 mL*2)洗涤2次,有机相加入无水硫酸镁干燥过夜,柱层析纯化(洗脱系统:石油醚:二氯甲烷 = 10:1)得到化合物1a,化合物1b-1m采用类似方法制备。
1.2.2化合物2a-2m的合成
以化合物2a(R = H)的合成为例:称取1.68 g(0.0099 mol)1a、1.36 g (0.0197 mol) 1,2,4-三氮唑,2.73 g(0.0198 mol)研磨后的碳酸钾于装有10 mL乙腈的100 mL圆底烧瓶中,用加热磁力搅拌器进行机械搅拌并加热至90 ℃,反应48 h。反应每隔2 h,用薄层色谱法TLC(展开剂为石油醚:乙酸乙酯= 3:1)检测反应是否完全。当确定反应完全后停止反应,减压蒸除溶剂后加入30 mL水,用二氯甲烷(20 mL*3)萃取3次,有机相加入无水硫酸镁干燥,柱层析纯化(洗脱系统:二氯甲烷:甲醇 = 100:1)得化合物2a,化合物2b-2m类似方法制备。
1.2.3化合物2a, 2c-2f的成盐
以化合物2a成盐为例:将液态产物2a溶于20 mL二氯甲烷中,通入HCl气体(用氯化钠和浓硫酸反应,产生盐酸气体),控制HCl气体的流速,缓慢通入,维持2 h即可反应完全。将反应液减压旋干得到固体、红外灯下干燥收集得到2a盐酸盐。化合物2a-2m的理化数据如下:
1-(3-苯氧基丙基)-1H-1,2,4-三氮唑盐酸盐 (2a)
熔点142-144 ℃, yield 75%.1H-NMR (CDCl3, 300 MHz):2.51 (s, 2H, CH2), 4.11 (s, 2H, CH2), 4.74 (s, 2H, CH2),6.81-6.94 (m, 3H, Ph-H), 7.22-7.27 (m, 2H, Ph-H), 8.38 (s, 1H, Triazole-H), 10.68 (s, 1H, Triazole-H), 12.24 (s, 1H, HCl).13C-NMR (CDCl3,75MHz):158.03, 143.09, 142.08, 129.43, 121.15, 114.38, 64.20, 49.62, 28.84. ESI-HRMS calcd for C11H14N3O+([M + H]+): 204.1131; found: 204.1127。
1-(3-(4-甲基苯氧基)丙基)-1H-1,2,4-三氮唑盐酸盐(2b)
熔点42-44℃产率62%.1H-NMR (CDCl3, 300 MHz):2.29 (s, 3H, CH3), 2.34 (t, 2H,= 6.0 Hz,CH2), 3.89 (t, 2H,= 5.8 Hz, CH2-N), 4.41 (t, 2H,= 6.7 Hz, CH2O), 6.77 (d, 2H,= 8.6 Hz, Ph-H), 7.10 (d, 2H,= 8.6 Hz, Ph-H), 7.96 (s, 1H, Triazole-H), 8.05 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):156.31, 152.11, 143.33, 130.38, 129.93, 114.31, 63.97, 46.22, 29.38, 20.35. ESI-HRMS calcd for C12H16N3O+([M + H]+): 218.1288; found: 218.1277。
1-(3-(4-丙基苯氧基)丙基)-1H-1,2,4-三氮唑盐酸盐 (2c)
熔点109-110℃产率 63%.1H-NMR (CDCl3, 300 MHz):0.91 (t, 3H,= 6.1 Hz,CH3), 1.54-1.61 (m, 2H, CH2), 2.46-2.51 (t, 4H, CH2),4.07 (s, 2H, CH2), 4.74 (s, 2H, CH2), 6.75 (d, 2H,= 7.3 Hz, Ph-H), 7.05 (d, 2H,= 7.3 Hz, Ph-H), 8.48(s, 1H, Triazole-H), 10.86(s, 1H, Triazole-H), 15.75 (s, 1H, HCl ).13C-NMR (CDCl3,75MHz):156.01, 142.05, 141.88, 135.23, 129.21, 114.05, 64.26, 49.85, 36.92, 28.76, 24.56, 13.60.ESI-HRMS calcd for C14H20N3O+([M + H]+): 246.1601; found: 246.1597。
1-(3-(4-戊基苯氧基)丙基)-1H-1,2,4-三氮唑盐酸盐 (2d)
熔点136-137 ℃, 产率61%.1H-NMR (CDCl3, 300 MHz):0.88 (t, 3H, CH3), 1.26-1.36 (m, 4H, CH2), 1.51-1.58 (m, 2H, CH2), 2.49-2.54 (m, 4H, CH2), 4.07 (t, 2H,= 5.0 Hz, CH2), 4.72 (t, 2H,= 6.3 Hz, CH2), 6.75 (d, 2H,= 8.5 Hz, Ph-H), 7.06(d, 2H,= 8.5 Hz, Ph-H), 8.38 (s, 1H, Triazole-H), 10.62 (s, 1H, Triazole-H), 11.26 (s, 1H, HCl).13C-NMR (CDCl3,75MHz):156.03, 141.99, 141.54, 135.56, 129.20, 114.08, 64.19, 49.71, 34.87, 31.33, 31.27, 28.73, 22.42, 13.94. ESI-HRMS calcd for C16H24N3O+([M + H]+): 274.1914; found: 274.1910。
1-(3-(4-叔戊基苯氧基)丙基)-1H-1,2,4-三氮唑盐酸盐(2e)
熔点138-139℃, 产率 64%.1H-NMR (DMSO-6, 300 MHz):0.66 (t, 3H, CH3), 1.24 (s, 6H, CH3), 1.61 (q, 2H,= 7.4 Hz, CH2), 2.49 (t, 2H,= 4.5 Hz, CH2), 4.07 (t, 2H,= 4.8 Hz, CH2), 4.72 (s, 2H,= 4.5 Hz, CH2), 6.78 (d, 2H,= 8.7 Hz, Ph-H), 7.22 (d, 2H,= 8.7 Hz, Ph-H), 8.43 (s, 1H, Triazole-H), 8.94 (s, 1H, Triazole-H), 10.67 (s, 1H, HCl).13C-NMR (DMSO-6,75MHz):155.70, 142.37, 142.11, 141.57, 126.88, 113.73, 64.08, 49.61, 37.16, 36.77, 28.74, 28.45, 9.02. ESI-HRMS calcd for C16H24N3O+/([M + H]+):274.1914; found: 274.1908。
1-(3-(4-甲氧基苯氧基)丙基)-1H-1,2,4-三氮唑盐酸盐 (2f)
熔点142-143 ℃, 产率 63%.1H-NMR (CDCl3, 300 MHz):2.46 (s, 2H, CH2), 3.74 (s, 3H, OCH3), 4.04 (s, 2H, CH2), 4.71 (s, 2H, CH2), 6.76 (d, 2H,= 8.6 Hz, Ph-H), 6.80 (d, 2H,= 8.6 Hz, Ph-H), 8.37 (s, 1H, Triazole-H), 10.51 (s, 2H, Triazole-H, HCl).13C-NMR(CDCl3,75MHz):154.45, 152.48, 143.10, 142.00, 115.73, 114.93, 65.27, 55.78, 49.53, 29.01. ESI-HRMS calcd for C12H16N3O2+([M + H]+): 234.1237; found: 234.1228。
1-(3-(4-丙氧基苯氧基)丙基)-1H-1,2,4-三氮唑 (2g)
熔点50-51 ℃, 产率 65%.1H-NMR (CDCl3, 300 MHz):1.02 (t, 3H, CH3), 1.75-1.81 (m, 2H, CH2), 2.29-2.37 (m, 2H, CH2), 3.84-3.88 (m, 4H, Ph-H), 4.40 (t, 2H,= 6.7 Hz, CH2), 6.77-6.84 (m, 4H, CH2), 7.96 (s, 1H, Triazole-H), 8.05 (s, 1H, Triazole-H).13C-NMR(CDCl3,75MHz):153.71, 152.47, 152.11, 143.34, 115.55, 115.42, 70.17, 64.59, 46.24, 29.45, 22.61, 10.42. ESI-HRMS calcd for C14H20N3O2+([M + H]+): 262.1550; found: 262.1542。
1-(3-(4-苯氧基苯氧基)丙基)-1H-1,2,4-三氮唑 (2h)
熔点61-63℃, 产率79%.1H-NMR (CDCl3, 300 MHz):2.33-2.41 (m, 2H, CH2), 3.91 (t, 2H,= 5.7 Hz, CH2), 4.43 (t, 2H,= 6.7 Hz, CH2), 6.83-7.07 (m, 7H, Ph-H), 7.26-7.33 (m, 2H, Ph-H), 7.97 (s, 1H, Triazole-H), 8.07 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):158.19, 154.55, 152.10, 150.48, 143.33, 129.53, 122.46, 120.70, 117.61, 115.35, 64.23, 46.12, 29.29. ESI-HRMS calcd for C17H18N3O2+([M + H]+):296.1394; found: 296.1391。
1-(3-(4-(苄氧基苯氧基)丙基)-1H-1,2,4-三氮唑 (2i)
熔点84-85 ℃, 产率69%.1H-NMR (CDCl3, 300 MHz):2.29-2.37(m, 2H, CH2), 3.86 (t, 2H,= 5.7 Hz, CH2), 4.40 (t, 2H,= 6.6 Hz, CH2),5.01 (s, 2H, CH2), 6.80 (d, 4H,= 9.2 Hz, Ph-H), 6.90 (d, 4H,= 9.2 Hz, Ph-H), 7.26-7.44 (m, 4H, Ph-H), 7.96 (s, 1H, Triazole-H), 8.05 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):153.19, 152.67, 152.12, 143.38, 137.09, 128.47, 127.83, 127.38, 115.81, 115.27, 70.55, 64.34, 46.17, 29.35..ESI-HRMS calcd for C18H20N3O2+([M + H]+): 310.1550; found: 310.1543。
1-(3-((苯并[d][1,3]二氧五环-5-基)氧基)丙基)-1H-1,2,4-三氮唑 (2j)
熔点78-79℃产率 65%.1H-NMR (CDCl3, 300 MHz):2.28-2.36 (m, 2H, CH2), 3.84 (t, 2H,= 5.7 Hz, CH2), 4.39 (t, 2H,= 6.7 Hz, CH2), 5.91 (s, 2H, OCH2O), 6.27 (dd, 1H,1= 2.5 Hz,2= 8.5 Hz, Ph-H), 6.46 (d, 1H,= 2.5 Hz, Ph-H), 6.69 (d, 1H,= 8.5 Hz, Ph-H), 7.96 (s, 1H, Triazole-H), 8.05 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):153.78, 152.07, 148.22, 143.31, 141.85, 107.87, 105.44, 101.09, 97.88, 64.65, 46.10, 29.26. ESI-HRMS calcd for C12H14N3O3+([M + H]+):248.1030; found: 248.1022。
1-(3-(4-(乙酰基苯氧基)丙基)-1H-1,2,4-三氮唑 (2k)
熔点69-71℃,产率 74%.1H-NMR (CDCl3, 300 MHz):2.34-2.42 (m, 2H, CH2), 2.53 (s, 3H, COCH3), 3.99 (t, 2H,= 5.5 Hz, CH2), 4.40 (t, 2H,= 6.5 Hz, CH2), 6.88 (d, 2H,= 8.7 Hz, Ph-H), 7.91 (d, 2H,= 8.7 Hz, Ph-H), 7.94 (s, 1H, Triazole-H), 8.05 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):196.52, 162.13, 152.10, 143.26, 130.59, 130.51, 113.95, 64.10, 46.01, 29.11, 26.23. ESI-HRMS calcdfor C13H16N3O2+([M + H]+):246.1237; found: 246.1228。
1-(3-(4-氯苯氧基)丙基)-1H-1,2,4-三氮唑 (2l)
熔点58-59℃, 产率 62%.1H-NMR (CDCl3, 300 MHz):2.31-2.40 (m, 2H, CH2), 3.89 (t, 2H,= 5.8 Hz, CH2), 4.40 (t, 2H,= 6.7 Hz, CH2),6.79 (d, 2H,= 9.0 Hz, Ph-H), 7.24 (d, 2H,= 9.0 Hz, Ph-H), 7.96 (s, 1H, Triazole-H), 8.04 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):156.90, 152.11, 143.26, 129.31, 125.89, 115.56, 64.12, 46.04, 29.18. ESI-HRMS calcd for C11H13ClN3O+([M + H]+): 238.0742; found:238.0736。
1-(3-(2,4-二氯苯氧基)丙基)-1H-1,2,4-三氮唑 (2m)
熔点55-57 ℃, 产率 64%.1H-NMR (CDCl3, 300 MHz):2.38-2.46 (m, 2H, CH2), 3.92 (t, 2H,= 5.7 Hz, CH2), 4.48 (t, 2H,= 6.8 Hz, CH2),6.78 (d, 1H,= 8.4 Hz, Ph-H), 7.17 (dd, 1H,1= 2.5 Hz,2= 8.4 Hz, Ph-H), 7.39 (d, 1H,= 2.5 Hz, Ph-H), 7.96 (s, 1H, Triazole-H), 8.08 (s, 1H, Triazole-H).13C-NMR (CDCl3,75MHz):152.55, 152.22, 143.54, 129.95, 127.61, 126.17, 123.55, 114.00, 64.98, 45.65, 28.88. ESI-HRMS calcd for C11H12Cl2N3O+([M+H]+): 272.0352; found: 272.0344。
1.3 化合物抗惊厥活性及神经毒性评价
按照美国卫生院的抗癫痫药物开发方案,采用最大电惊厥模型和皮下戊四唑模型评价目标化合物的抗惊厥活性,旋转棒法评价目标化合物的神经毒性[14-15]。实验动物采用昆明种小鼠(湖南斯莱克景达实验动物有限公司提供,许可证号:SCXK(湘)2016-0003),体重20~24 g,雌雄各半、实验前3 d饲养于20~25 ℃、相对湿度45%~65% 的实验室中,可以自由采食和饮水。目标化合物溶于DMSO中以0.05 mL/20 g容积腹腔注射。初期实验中,评价化合物在300、100、30 mg/kg三个剂下的抗惊厥活性和神经毒性。
最大电休克发作实验(MES):在最大电惊厥实验中,使用110V,60 Hz的交流电,小鼠耳电极通电0.3 s,出现后肢强直的视为惊厥。正式实验前一天预筛小鼠,出现惊厥的小鼠用于正式实验。给药后0.5 h对小鼠进行电刺激,观察药物的抗电诱导惊厥活性。
皮下戊四唑实验(Sc-PTZ):小鼠给药后0.5 h皮下给予85 mg/kg的戊四唑(该剂量可以使97%以上的小鼠产生连续5 s的阵挛性惊厥),小鼠单独放置在鼠笼中观察30 min,以没有出现连续5 s以上的阵挛性惊厥为有效,认为该药物可以对抗由戊四唑诱导的惊厥。
神经毒性实验:神经毒性实验采用旋转棒法,于给药 0.5 h后将小鼠置于直径1英寸、转速为6 r/min的木棒上, 在连续3次的测试中小鼠均不能在木棒保持1 min而掉下视为有神经毒性,反之则无神经毒性。
2 结果与讨论
2.1 合成部分
本实验以取代酚为起始原料,先后与1-溴-3-氯丙烷及1,2,4-三氮唑进行烷基化反应,得到目标化合物(图1)。化合物1a-1m的制备过程中,取代酚与1-溴-3-氯丙烷1:2的反应当量比较关键。由于丙烷两端均可以进行威廉姆生烷基化反应,1-溴-3-氯丙烷需要过量,通过多次尝试,发现2倍量时几乎没有双取代副产物产生。由于化合物2a, 2c-2f得到的是油状物,为了便于称量,我们将其通入盐酸气体得到了其盐酸盐, 均为白色晶体粉末。化合物2a-2m的结构通过核磁共振氢谱、碳谱和质谱得到了确证。结构解析以化合物2b为例:在1H-NMR 中,2.29处的单峰为苯环上甲基的吸收峰,2.34 , 3.89, 4.41处的三个三重峰为丙基的三个亚甲基的吸收峰,δ 6.77和7.10处的两对双重峰为对位取代苯环的特征质子信号,7.96和8.05位置的两个单峰则为三氮唑上的两个氢的吸收峰。13C NMR谱也准确的给出了该化合物结构的各种信息,恰好是10种不同化学环境的碳。高分辨质谱分析中,化合物4b理论分子量为218.1288,实际测定值为218.1277,结合氢谱和碳谱可以确证其分子结构。

图1 目标化合物2a-2m的合成路线
2.2 药理实验部分
本实验采用了MES和Sc-PTZ 模型来评价目标化合物2a-2m的抗惊厥活性. 这两个模型目前依然是抗癫痫药物筛选的首要选择, 被美国国立卫生研究院(NIH)推荐为主要的抗癫痫药物筛选模型[16]。其中MES 模型用于筛选能对抗全身强直阵挛性发作的候选药[17], 而Sc-PTZ 模型则用来筛选失神发作的候选药物[18]。本实验对目标化合物2a-2m进行了30、100、300 mg/kg 三个剂量的活性和神经毒性评价, 其结果见表1。由表1可见, 除了化合物2f, 2j和2k,其他化合物在100 mg/kg剂量下都显示出抗MES活性,化合物2f, 2j和2k也在300 mg/kg剂量下显示出活性;在Sc-PTZ 模型中, 化合物2a-2h和2j-2m在100mg/kg剂量下表现出了抗惊厥活性, 其中化合物2h在低剂量30 mg/显示出活性。在旋转棒法中,化合物2a-2m在300 mg/kg剂量下均未显示出神经毒性。实验结果说明大部分化合物在MES 和Sc-PTZ 模型中均表现出保护活性, 说明其对强直性发和失神发作均有效,并且它们均表现出较低的神经毒性。该系列化合物在结构上属于单烷基取代的三氮唑类,在之前的报道中,大多是稠合的三唑衍生物表现出抗癫痫活性。本研究的结果进一步证实了三氮唑片段是一个良好的抗癫痫活性基团,并且单烷基取代的三氮唑同样具有良好的抗癫痫活性,这为三氮唑在药物设计尤其是抗癫痫药物的设计中提供了进一步的科学依据。
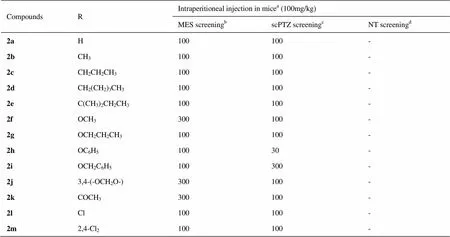
表1 化合物2a-2m的抗惊厥活性及神经毒性(小鼠腹腔给药)
aNumber of animal used = 3-5, Doses of 15, 30, 100, and 300 mg/kg were administered. The figure in the table indicates the minimum dose whereby bioactivity was demonstrated in half or more of the mice. The animals were examined at 0.5 h after injection was administered. A dash indicates the absence of anticonvulsant activity and neurotoxicity at the maximum dose administered (300 mg/kg).bMaximal electroshock test.cSubcutaneous pentylenetetrazole test.dNeurotoxicity screening (rotarod test).
3 小结
本实验合成了一系列未见文献报道的1-(3-苯氧基丙基)-1H-1,2,4-三氮唑衍生物,其结构均经过光谱方法确证。体内抗癫痫活性评价表明,该系列化合物均表现出不同程度的抗惊厥活性,尤其是该系列化合物对MES模型和Sc-PTZ模型均有效,使得该类化合物具有广谱的抗癫痫潜能,这为研究大发作和失神发作类癫痫的治疗药物提供了一定的基础。
[1] Jensen F E. Epilepsy in 2013: Progress across the spectrum of epilepsy research[J]. Nat Rev Neurol, 2014, 10(2): 63-4.
[2] 李金平. 含环丙烷结构的新型抗癫痫药物的合成与活性研究[D]. 武汉:武汉大学, 2015.
[3] Fazel S, Wolf A, Langstrom N, et al. Premature mortality in epilepsy and the role of psychiatric comorbidity: a total population study[J]. Lancet, 2013, 382(9905): 1646-1654.
[4] Sabers A, Gram L. Newer anticonvulsants: Comparative review of drug interactions and adverse effects[J]. Drugs, 2000, 60(1): 23-33.
[5] Longo L P, Johnson B. Addiction. Part I. Benzodiazepines- side effects,abuse risk and alternatives[J]. Am Fam Physician,2000,61(7): 2121-2128.
[6] Schmidt D. adverse effects of valproate[J]. Epilepsia, 1984, 25(1): S44-49.
[7] Lindhout D, Omtzigt J G. Teratogenic effects of antiepileptic drugs: Implications for the management of epilepsy in women of childbearing age[J]. Epilepsia, 1994, 35(4): 19-28.
[8] 孔令军,肖瑞林,朱秋根. 成人癫痫患者生活质量的研究[J]. 井冈山学院学报,2007, 28(3):108-110.
[9] 吴江虹,陈军华,徐建华. 癫痫持续状态致多脏器功能衰竭的临床研究[J]. 井冈山学院学报, 2006, 27(3): 106-107.
[10] Murdoch D. Mechanisms of status epilepticus: an evidence-based review[J]. Curr Opin Neurol, 2007, 20(7): 213-216
[11] Kamboj V K, Verma P K, Dhanda A, et al. 1,2,4-Triazole derivatives as potential scaffold for anticonvulsant activity[J]. Cent Nerv Syst Agents Med Chem, 2015, 15(1): 17-22.
[12] Ayati A, Emami S, Foroumadi A. The importance of triazole scaffold in the development of anticonvulsant agents[J]. Eur J Med Chem, 2016, 109(13): 380-92.
[13] Song M X, Deng X Q. Recent developments on triazole nucleus in anticonvulsant compounds: a review[J]. Journal of Enzyme Inhibition & Medicinal Chemistry, 2018, 33(1):453.
[14] Krall R L, Penry J K, White B G, et al. Antiepileptic drug development: II. Anticonvulsant drug screening[J]. Epilepsia, 1978, 19(4): 409-28.
[15] Porter R J. Antiepileptic drug development program[J]. Prog Clin Biol Res, 1984, 51(2): 53-66.
[16] White H S. Preclinical development of antiepileptic drugs: past, present, and future directions[J]. Epilepsia, 2003, 44(7): 2-8.
[17] Smith M, Wilcox K S, White H S. Discovery of antiepileptic drugs[J].Neurotherapeutics,2007,4(1):12-17.
[18] White H S. Clinical significance of animal seizure models and mechanism of action studies of potential antiepileptic drugs[J], Epilepsia, 1997, 38(1): 9-17.
SYNTHESIS OF 1-(3-PHENOXYPROPYL)-1H-1,2,4-TRIAZOLE DERIVATIVES AND THEIR ANTICONVULSANT ACTIVITIES
CHENG Shi-long, GUO Dong-fu, YU Sheng-wang, HE Shi-hui, ZHAO Wen-hao,*DENG Xian-qing
(Faculty of Medicine, Jinggangshan University, Ji’an, Jiangxi 343009, China)
To synthesize a series of 1-(3-phenoxypropyl)-1H-1,2,4-triazole derivatives and investigate their anticonvulsant effects.Various phenols were used as the starting material, which reacted with 1-bromo-3-chloropropane and 1,2,4-triazole in sequential order to provide the target compounds 2a-2m. The structures of these compounds were confirmed by 1H-NMR, 13C-NMR, and MS spectrum. Their anticonvulsant activities were evaluated using maximal electroshock shock (MES) and subcutaneous pentylenetetrazole (scPTZ) seizure models in mice. The neurotoxicity was evaluated with rotating rod test.A series of alkyl substituted triazoles were synthesized, and their anticonvulsant activities were confirmed by the both models.The alkyl substituted triazoles reported in this work exhibited broad-spectrum anticonvulsant activity. This found enriches the antiepileptic structure-activity relationships of triazole compounds, and provides the reference, to some extent, to the research and development of new drugs of the grand and apathetic seizures.
triazole; anticonvulsant; maximal electroshock shock; sc-PTZ
1674-8085(2019)01-0088-06
R914.3
A
10.3969/j.issn.1674-8085.2019.01.018
2018-10-01;
2018-11-21
国家自然科学基金项目(21562028);井冈山大学第七批校级大学生创新创业训练计划项目
陈士龙(1996-),男,甘肃张掖人,井冈山大学医学部药学专业2016级本科生(E-mail: 2652036221@qq.com);
郭东福(1995-),男,甘肃酒泉人,井冈山大学医学部药学专业2016级本科生(E-mail: 1905104791@qq.com);
喻圣旺(1998-),男,江西南昌人,井冈山大学医学部药学专业2016级本科生(E-mail: 1779326748@qq.com);
何世辉(1994-),男,江西九江人,井冈山大学医学部药学专业2016级本科生(E-mail:924233669@qq.com);
赵文豪(1995-),男,河南鹤壁人,井冈山大学医学部药学专业2016级本科生(E-mail: 1732247757@qq.com);
*邓先清(1962-),男,湖南衡阳人,副教授,博士,主要从事合成药物研究(E-mail: dengxianqing1211@126.com).
