亚硫酸钠-Fe(II)-溶解氧对酸性紫FBL降解脱色的研究
2019-03-08黄晓东陈远玲黄雅丽
黄晓东,陈远玲,黄雅丽
亚硫酸钠-Fe(II)-溶解氧对酸性紫FBL降解脱色的研究
*黄晓东,陈远玲,黄雅丽
(闽江学院海洋学院化工与材料系,福建,福州 350108)
以酸性紫FBL为降解目标,采用亚硫酸钠-Fe(II)-溶解氧体系产生的硫酸根自由基(·SO4-)降解酸性紫FBL脱色,比较了不同体系的降解脱色性能,考察了pH值、Fe2+浓度、SO32-浓度、空气流量、酸性紫FBL的初始浓度对降解脱色的影响。结果表明,在最佳的实验条件为:pH = 7.0,Fe2+浓度为0.75 mmol/L,SO32-浓度为1.25 mmol/L,空气流量为0.70 L/min,污染物浓度为128 mg/L。经过40 min的降解脱色,酸性紫FBL溶液的脱色率可达到94% 以上。
亚硫酸钠;Fe(II);溶解氧;酸性紫FBL
高级氧化技术(AOPs)是废水处理常用的方法,其主要方法有臭氧氧化法[1]、Fenton氧化法[2]、光催化氧化法[3]等。近年来,以硫酸根自由基(·SO-4)的过硫酸盐高级氧化技术在处理难降解有机废水方面有着广泛的应用,其活化过硫酸盐产生·SO-4的方法主要有三种:一是采用紫外光照射过硫酸盐的产生·SO-4的活化方法[4-5];二是采用加热过硫酸盐产生·SO-4的活化方法[6-7];三是采用过渡金属离子活化过硫酸盐产生·SO-4的方法[8-9]。其中紫外光活化、加热活化均需要额外的能源和仪器设备,以过渡金属离子活化过硫酸盐虽然简单,但有的过渡金属离子本身会对水体产生污染,如Mn2+、Co2+和Ag+等。而采用亚铁-溶解氧活化亚硫酸盐产生·SO-4的方法中[10-11],亚铁离子溶液容易获得,对环境污染较小,溶解氧可以通过空气导入,因而使用Fe2+/亚硫酸盐/溶解氧产生·SO-4的方法就显得经济和环保。为此本研究采用 Fe2+/亚硫酸盐/溶解氧体系产生·SO-4对酸性紫FBL染料进行脱色,并探究脱色的条件及性能,以期为Fe2+/亚硫酸盐/溶解氧体系处理染料提供理论依据。
1 实验部分
1.1 主要试剂和仪器
试剂:亚硫酸钠、硫酸亚铁均为分析纯;酸性紫FBL购自浙江温州龙达染料化工有限公司。
仪器:721G可见分光光度计(上海光谱仪器有限公司),RS - 9801 型氧气泵(中山市日胜电器制品有限公司),FA 2004B 型电子分析天平(上海佑科仪器仪表有限公司)。
1.2 实验方法
在室温条件下,于250 mL锥形瓶中加入酸性紫FBL溶液,再分别加入FeSO4溶液和Na2SO3溶液,摇匀后,打开空气泵导入空气进行降解脱色,每隔10 min取样1次,离心分离,以去离子水作为空白参比,在590 nm波长下,测定酸性紫FBL溶液吸光度,按下式计算脱色率。

式中,A0表示酸性紫FBL溶液的初始吸光度,At分别表示经一定时间脱色后的酸性紫FBL溶液的吸光度。
2 结果与讨论
2.1 不同体系的脱色性能
按实验方法,取初始浓度1.6 g·L-1的酸性紫FBL溶液8 mL于250 mL锥形瓶中,加入15 mL 5 mmol·L-1FeSO4溶液、25 mL 5 mmol·L-1Na2SO3溶液,用去离子水稀释至100 mL,使得溶液中的酸性紫FBL的浓度为128mg·L−1,FeSO4为0.75 mmol·L-1,Na2SO3为1.25 mmol·L-1;用浓度为1.0 mol·L-1的HCl将溶液的pH值调节为7.0。调节空气流量为0.70 L·min-1,试验不同体系的脱色性能,结果如图1所示。

图1 不同体系脱色性能
由图1可知,酸性紫FBL分别加入Fe(II)溶液或SO32-溶液,在氧气的作用条件下,基本是不降解脱色的。只有同时加入Fe(II)和SO32-溶液,并通入空气,酸性紫FBL溶液才能被降解脱色。这可能由于Fe(II)活化亚硫酸盐,按下式产生·SO4-[12],并对酸性紫FBL起降解脱色作用。
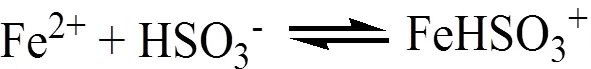
4FeHSO3++ O2→ 4FeSO3++ 2H2O (3)
FeSO3+→ Fe2++ ·SO3-(4)
·SO3-+ O2→ ·SO5-(5)
·SO5-+ HSO3-→ SO42-+ ·SO4-+ H+(6)
·SO5-+ HSO3-→ HSO5-+ ·SO3-(7)
·SO5-+ ·SO5-→ 2·SO4-+ O2(8)
Fe2++ HSO3-→ ·SO4-+ Fe3++ OH-(9)

2.2 pH对降解脱色的影响
调节溶液中的酸性紫FBL的浓度为128mg·L−1,FeSO4为0.75 mmol·L-1,Na2SO3为1.25 mmol·L-1,用1.0 mol·L-1的HCl溶液或1.0 mol·L-1的NaOH溶液分别调节溶液的pH值,调节空气流量为0.70 L·min-1。根据降解操作方法,考察溶液初始pH值对酸性紫FBL溶液的降解脱色的影响。实验结果如图2所示。

图2 pH对脱色的影响
由图2可知,pH值在1~ 7范围内,酸性紫FBL溶液的脱色率随pH值的增加而增加,且脱色率在30 min后都基本趋于稳定。由式(6)可知,酸性提高会抑制·SO4-生成,降解脱色率随酸度增强而降低。当pH值为8时,脱色率急剧降低为负值。这可能由于在碱性条件下生成Fe(OH)3,使得体系生成·SO4-急剧减少,降解脱色率也急剧降低。根据实验结果,最佳的降解pH值选为7.0。
2.3 Fe(II)浓度对降解脱色的影响
调节溶液中的酸性紫FBL的浓度为128mg·L−1,Na2SO3为1.25 mmol·L-1,分别加入不同浓度的FeSO4溶液,用1.0 mol·L-1的HCl溶液调节溶液的pH值为7.0,调节空气流量为0.70 L·min-1。根据降解操作方法,考察Fe(II)对酸性紫FBL溶液的降解脱色的影响。实验结果如图3所示。

图3 Fe(II)浓度对脱色的影响
由图3可知,Fe(II)的浓度在0.25~0.75 mmol·L-1范围,随着Fe(II)的增大,酸性紫FBL的降解脱色率也随着增大,这是因为Fe(II)的增大,促进体系中·SO4-生成,降解脱色率也就随之增大。但当Fe(II)溶液浓度大于0.75 mmol·L-1后,降解脱色反而降低,这是由于过量的Fe2+会与·SO4-发生如下反应:
·SO4-+ Fe2+→ SO42-+ Fe3+(11)
从而使·SO4-的数量减少,活性降低,因而酸性紫FBL的降解脱色率也降低。根据实验结果,最佳的Fe(II)浓度选为0.75 mmol·L-1。
2.4 SO32-浓度对降解脱色的影响
调节溶液中的酸性紫FBL的浓度为128mg·L−1,FeSO4为0.75 mmol·L-1,分别加入不同浓度的Na2SO3溶液,用1 mol·L-1的HCl溶液调节溶液的pH值为7.0,调节空气流量为0.70 L·min-1。根据降解操作方法,考察Na2SO3对酸性紫FBL溶液的降解脱色的影响。实验结果如图4所示。
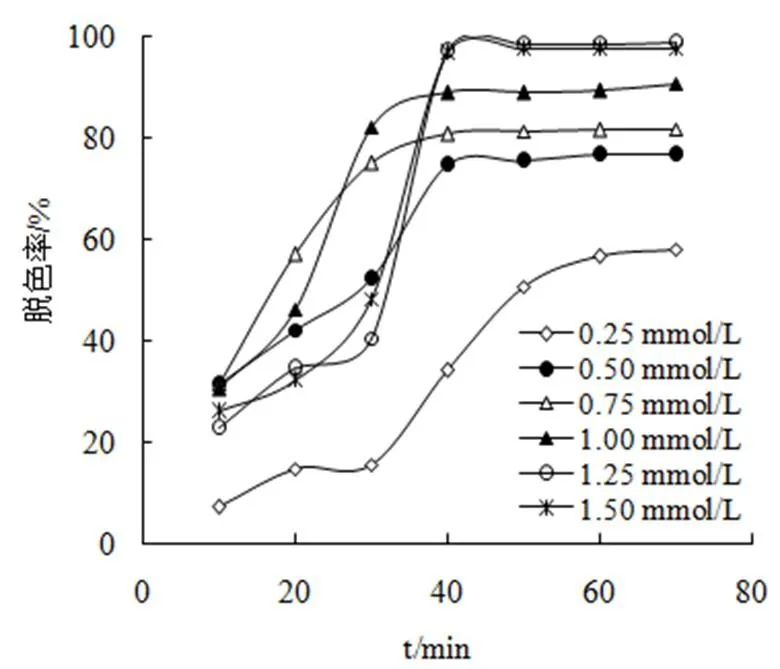
图4 SO32-浓度对脱色的影响
由图4可知,SO32-的浓度在0.25~1.25 mmol·L-1范围,随着SO32-的增大,酸性紫FBL的降解脱色率也随着增大,这是因为SO32-的增大,体系中FeSO3+配合物增加,进一步生成更多的·SO4-,降解脱色率也就随之增大。但当SO32-溶液浓度大于1.25 mmol·L-1后,降解脱色率略降,这是由于过量的HSO3-会猝灭部分的·SO4-,反应如式(11),根据实验结果,最佳的SO32-浓度选为1.25 mmol·L-1。
·SO4-+ HSO3-→ SO42-+ ·SO3-+ H+(12)
2.5 空气对降解脱色的影响
调节溶液中的酸性紫FBL的浓度为128mg·L−1,FeSO4为0.75 mmol·L-1,Na2SO3为1.25 mmol·L-1,调节溶液的pH值为7.0。试验通空气、加橡胶塞不通空气和通氮气对降解脱色的影响。实验结果如图5所示。

图5 不同气体对脱色的影响
由图5可知,当往酸性紫FBL溶液中通空气时,降解脱色效果最好,40 min后脱色率可达97.59 %;当锥形瓶塞上木塞隔绝空气,反应40 min后也会有部分降解脱色,当锥形瓶塞上木塞,往锥形瓶里通氮气,未有明显的降解脱色现象。由此说明溶解氧对Fe2+-SO32-体系降解酸性紫FBL脱色起重要作用,这是因为空气中的充足的溶解氧促进体系中的FeSO3+配合物及·SO5-生成,进一步促进·SO4-,使得降解脱色率提高。
2.6 空气流量对降解脱色的影响
调节溶液中的酸性紫FBL的浓度为128mg·L−1,FeSO4为0.75 mmol·L-1,Na2SO3为1.25 mmol·L-1,调节溶液的pH值为7.0。试验不同空气流量对降解脱色的影响。实验结果如图6所示。

图6 空气流量对脱色的影响
由图6可知,随着空气流量的增加,降解率在逐渐增长。当空气流量增至0.60 L·min-1后,脱色率已变化不大,实验选择最佳的空气流量为0.70 L·min-1。
2.7 酸性紫FBL初始浓度对降解脱色影响
调节溶液中的FeSO4浓度为0.75 mmol·L-1,Na2SO3为1.25 mmol·L-1,调节溶液的pH值为7.0,空气流量为0.70 L·min-1。考察不同浓度的酸性紫FBL对降解脱色的影响,结果如图7所示。

图7 酸性紫FBL初始浓度对脱色影响
由图7可知,酸性紫FBL初始浓度在32~128 mg·L-1范围类,40 min后酸性紫FBL的降解脱色率变化较小,都达到94%以上。当酸性紫FBL的浓度为160mg·L-1时,降解脱色率明显降低,因此,确定体系的酸性紫FBL浓度为128 mg·L-1。
3 小结
1)亚硫酸钠-Fe(II)-溶解氧体系产生的硫酸根自由基(·SO4-)对酸性紫FBL有较好的降解脱色能力。
2)最佳的实验条件为:pH = 7.0,Fe2+浓度为0.75 mmol/L,SO32-浓度为1.25 mmol/L,空气流量为0.70 L/min。
[1] 卢昶雨,叶林静,张鹭,等. 臭氧氧化处理模拟印染废水[J]. 应用化工,2013,42(6):1014-1016.
[2] 刘晓艳,刘莲,吴俊峰,等. Fenton/过硫酸盐降解水中的4-乙酰氨基酚[J].工业水处理,2018,38(10): 25-28.
[3] 谢桂香,林霞晖,张著森. BiOBr/TiO2复合光催化材料的制备及其光催化性能的研究[J].井冈山大学学报:自然科学版,2018,39(4): 28-33.
[4] Gao Y Q, Gao N Y, Deng Y, et al. Ultraviolet (UV) light-activated persulfate oxidation of sulfamethazine in water[J]. Chemical Engineering Journal, 2012, 195–196 (2):248–253
[5] 黄雅丽. ZnO协同过硫酸钠光催化降解孔雀石绿的研究[J].井冈山大学学报:自然科学版,2017,38(4): 32-37.
[6] Tan C Q, Gao N Y, Deng Y, et al.Heat-activated persulfate oxidation of diuron in water[J]. Chemical Engineering Journal, 2012, 203 (2):294–300
[7] Xie X F, Zhang Y Q, Huang W L, et al. Degradation kinetics and mechanism of aniline by heat-assisted persulfate oxidation[J]. Journal of Environmental Sciences, 2012, 24 (5):821–826
[8] Tan C Q, Gao N Y, Chu W H,et al. Degradation of diuron by persulfate activated with ferrous ion[J]. Separation and Purification Technology, 2012, 95 (1):44–48
[9] Xu X R, Li X Z. Degradation of azo dye Orange G in aqueous solutions by persulfate with ferrous ion[J]. Separation and Purification Technology, 2010, 72 (1):105–111
[10] 吉冰冰,肖玫,张琳,等.铁-亚硫酸盐配合物体系氧化处理硫酸厂的含砷废水[J].水处理技术,2014,40(9): 1-4.
[11] Liu Z Z, Yang S Y, Yuan Y N, et al. A novel heterogeneous system for sulfate radical generation through sulfite activation on a CoFe2O4nanocatalyst surface[J]. Journal of Hazardous Materials, 2017, 324:583–592.
[12] 郭一舟.基于亚硫酸根自由基高级氧化技术处理染料废水效能及机理研究[D]. 武汉:华中科技大学,2016.
DECOLORIZATION OF ACID VIOLET FBL BY SODIUM SULFITE-Fe(II)-DISSOLVED OXYGEN
*HUANG Xiao-dong,CHEN Yuan-ling,HUANG Ya-li
(Department of Chemical Engineering and Materials, Ocean College, Minjiang University, Fuzhou, Fujiang 350108, China)
The acid violet FBL was used as the degradation target, and the degradation of acid violet FBL by sulfate radical free radical(·SO4-)produced through sodium sulfite -Fe(II)-dissolved oxygen system was investigated, and the decolorization performance of different systems was compared. The effects of pH, ferrous concentration, sodium sulfite concentration, air flow and initial concentration of acid violet FBL for decolorization were investigated. The results showed that the best experimental conditions were as follows: pH=7.0, ferrous concentration was 0.75 mmol/L, sodium sulfite concentration was 1.25 mmol/L, air flow rate was 0.70 L/min, and pollutant concentration was 128 mg/L. After 40 min degradation,the degradation rate of acid violet FBL solution could reach over 94%.
sodium sulfite;ferrous; dissolved oxygen; acid violet FBL
1674-8085(2019)01-0019-04
X703.1
A
10.3969/j.issn.1674-8085.2019.01.005
2018-09-18;
2018-11-20
*黄晓东(1966-),男,福建福州人,副教授,硕士,主要从事水污染处理技术研究(E-mail: xiaodong701@163.com);
陈远玲(1996-),女,福建龙海人,闽江学院海洋学院应用化学专业2014级本科生(E-mail:1316928168@qq.com);
黄雅丽(1979-),女,福建永春人,副教授,硕士,主要从事光催化剂合成及性能的研究(E-mail: Huang_yali@126.com).
