云南大理白族和汉族弱精子症患者精子mtDNA 4977 bp缺失相关性研究
2019-03-08杨勇琴自加吉李素芬于成和张若鹏
杨勇琴,肖 杨,自加吉,李素芬,于成和,张若鹏,熊 伟
云南大理白族和汉族弱精子症患者精子mtDNA 4977 bp缺失相关性研究
杨勇琴1,2,肖 杨1,自加吉1,李素芬1,于成和3,张若鹏3,*熊 伟1
(1. 大理大学基础医学院,云南,大理 671000;2. 楚雄州中医医院肾内科,云南,楚雄 675000;3. 大理大学第一附属医院生殖医学科,云南,大理 671000)
探讨云南大理白族和汉族弱精子症患者精子线粒体DNA(mtDNA) 4977 bp缺失的相关性。收集云南大理白族弱精子症患者137例,汉族弱精子症患者121例,正常对照组大理白族和白族精子活力正常人各120例,提取精液基因组DNA,采用聚合酶链式反应(PCR)技术进行精子mtDNA 4977 bp缺失的研究。结果显示,120例正常对照的大理白族精子活力正常人中有10例(8.33%)存在 mtDNA 4977 bp缺失;而137例大理白族弱精子症患者中有89例(64.96%)存在mtDNA 4977 bp缺失。两组4977 bp缺失频率比较有极显著性差异(< 0.01)。120例正常对照的汉族精子活力正常人中有7例(5.83%)存在 mtDNA 4977 bp缺失;121例大理白族弱精子症患者中有85例 (70.25%)存在 mtDNA 4977 bp缺失。两组4977 bp缺失频率比较差异有极显著性(< 0.01)。同时发现大理白族弱精子症患者与汉族弱精子症患者 mtDNA 4977 bp缺失频率无显著性差异(> 0.05)。大理白族和汉族人群mtDNA 4977 bp缺失与弱精子症的发病有明显的关联,提示mtDNA 4977 bp缺失在弱精子症的发生中可能起重要作用。
弱精子症;线粒体DNA;4977 bp缺失;大理白族
男性不育症是影响家庭和睦以及社会稳定的全球性健康问题,据世界卫生组织(WHO)调查,有将近15%的育龄夫妇饱受着不育症的困扰,男女双方原因各占50%[1]。精子活力减低、数目减少是造成男性不育症的重要原因之一[2]。近年来,线粒体DNA(mitochondrial DNA, mtDNA)缺失、突变与疾病的相关性研究越来越受到人们的重视,尤其是在那些高需能的组织和器官,mtDNA结构改变而引发的效应更为明显[3]。
正常情况下,精子通过无氧酵解产生ATP,但在精子射出后的泳动过程所需的能量中,线粒体呼吸链起重要作用[4]。线粒体氧化磷酸化过程中产生活性氧自由基(ROS)和大量ATP。由于缺乏内源性过氧化物酶,精子细胞易于受到氧化物的损伤。研究表明,线粒体ATPase6、ATPase8、COX3、COX2、CytB、ND3、ND4、ND5及ND6基因参与精子细胞的功能成熟及射精后的快速“鞭动”[5],线粒体氧化磷酸化对精子的运动功能非常重要。mtDNA质和量的改变都会减弱精子的生理功能及运动能力[6]。据有关报道,有超过100种的mtDNA大片段缺失与人类疾病相关,其中包括mtDNA 4977 bp缺失而引发的不同疾病状态[7]。在一定的环境因子的诱导下,随着年龄的增长,mtDNA缺失具有积累效应,4977 bp缺失是一种常见的缺失类型,被用作mtDNA损伤的一种监测指标[8]。Kao等发现mtDNA 4799 bp缺失发生在mtDNA nt8483与nt13459之间,nt8470-8482及nt13447-13459为核酸序列完全相同的13 bp重复区(TACCTCCCTCACC),该重复区可能是mtDNA 4977 bp缺失发生的结构基础,导致mtDNA在复制过程中出现滑行错配[9]。有大量研究表明,mtDNA缺失发生率在弱精子症患者中高于正常男性,通过遗传学及分子生物学的方法能观察到缺失的mtDNA分子与野生型的mtDNA分子在精子中共存的现象,即“异质性”[10]。我们的研究旨在探究云南大理白族和汉族人群弱精子症患者与mtDNA 4977 bp缺失之间的相关性,为从分子水平揭示弱精子症的发病机制奠定基础,也为男性不育症患者的诊断及寻找简单准确的分子标记物提供实验依据。
1 资料与方法
1.1 一般资料
大理大学第一附属医院生殖遗传科门诊就诊的白族弱精子症患者137例,汉族弱精子症患者121例,正常对照组汉族、白族各120例。年龄24~47岁,平均年龄32.51 ± 8.38岁。研究个体之间无血缘关系,追溯3代均为同一民族个体,且在云南大理地区居住3代以上。
1.2 仪器与试剂
2720 Thermal Cycler 型号PCR扩增仪(美国Applied Biosystems 公司);Nanodrop One UV/Vis微量核酸蛋白定量仪(美国Thermo Scientific公司);凝胶成像仪(美国BIO-RAD公司);DYY-6C型电泳仪(北京六一仪器厂);生物安全柜(苏州安泰空气技术有限公司);全自动灭菌锅(上海博讯实业有限公司医疗设备厂);170-4402型琼脂糖水平电泳槽(美国Bio-Rad公司);HH-4恒温水浴锅(上海国华电器有限公司);微量移液器(德国Eppendorf公司)。
精子基因组DNA提取试剂盒(北京百奥森泰生物技术有限公司);琼脂糖凝胶DNA回收试剂盒(北京索莱宝生物科技有限公司);DNA 聚合酶、dNTP(大连Takara公司);DNA Marker(四川绵阳天恩泽基因工程有限公司);DuRed核酸染料(北京全式金生物技术有限公司);琼脂糖(Biowest Agarose)为西班牙进口分装;乙醇、异丙醇等化学试剂均为国产分析纯。PCR引物合成和DNA测序由昆明硕擎生物技术有限公司完成。
1.3 方法
精液采集及分析和质量控制按照《WHO人类精液检查与处理实验室手册》(第5版)标准化程序进行。禁欲3~5 d,手淫法留取精液样本于洁净容器中,37 ℃液化30 min。研究征得患者本人知情同意及大理大学医学伦理委员会批准。
1.3.2 常规精液分析及分组
根据WHO指南,采用计算机辅助的精液质量分析系统(CASA)行精液质量分析,弱精子症:精液参数中前向运动的精子(a+b)< 50% 或a级< 25%,精液常规分析包括a、b、c、d级精子,以及精子活力、活动率、精子密度、曲线速度、直线速度、平均路径速度、直线性、摆动性、前向性等。精子量≥2 mL、精子密度20×106/mL、精子活率>50%、精子活动力a级≥ 25% 为正常或a级+b级活动力≥50%为正常。
1.3.3 精子DNA的提取
取精液样本50 μL,采用北京百奥森泰生物技术有限公司精子基因组DNA提取试剂盒,按试剂盒说明书提取精液总DNA,NanoDrop核酸蛋白分析仪测定DNA浓度和纯度。
1.3.4 引物设计
引物设计参照人类mtDNA剑桥序列(GenBank:J01415),由昆明硕擎生物技术有限公司合成(PAGE级纯化,纯度99%),L1(3304-3323) 5’-AACATACCCATGGCCAACCT-3’;L2(8150-8166) 5’-CCGGGGGTATACTACGGTCA-3’;H1(3836-3817) 5’-GGCAGGAGTAATCAGAGGTG-3’;H2(13650- 13631)5’-GGGGAAGCGAGGTTGACCTG-3’。扩增片段长度见表1。
电气设备管理需要建立相应的管理体系,对火电厂的管理水平有着一定的要求。在实际中,火电厂电气设备故障经常发生,并且可控性差,大部分企业找不到合理控制故障的有效措施,主要存在的问题如下:

表1 不同配对引物扩增片段长度
1.3.5 PCR反应
PCR反应体系为:DNA模板(50 ng/μL)1.0 μL,10×PCR buffer 2.5 μL,dNTP 1.0 μL,DNA 聚合酶(5 U/μL)0.2 μL,上游引物和下游引物各1.0 μL,加双蒸水补充至总体积25 μL。引物对 L1/H1 的PCR扩增条件为:94 ℃预变性5 min后进入循环,每个循环为94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,共循环35次,最后72 ℃延伸5 min,4 ℃保存。引物对 L2/H2的PCR扩增条件有所改变:94 ℃预变性5 min后进入循环,每个循环为94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸50 s,共循环35次,最后72 ℃延伸5 min。取PCR反应产物10 μL加至2.0 μL的6×loading buffer中混匀,加样于1.5%琼脂糖凝胶,恒压120 V,于1×TAE缓冲液中电泳40 min,凝胶成像系统观察有无PCR产物及产物大小。
1.3.6 DNA测序
在所有检测样本中,选取其中10例4977 bp缺失样本及5例正常对照组样本的PCR产物进行琼脂糖凝胶电泳回收后,送昆明硕擎生物技术有限公司进行DNA纯化和测序。
1.3.7 统计学方法
选用SPSS 22.0统计软件,计量资料以均数±标准差()表示,采用检验,计数资料采用χ检验。检验水准α = 0.05,< 0.05为差异有统计学意义,< 0.01为差异极显著。
2 结果
2.1 精子基因组DNA的检测
每个样本各取3.0 μL 精子基因组DNA经2%琼脂糖凝胶电泳分离(120 V,40 min),凝胶成像系统成像后可见清晰的基因组DNA条带(图1)。在NanoDrop核酸蛋白测定仪上测定各样本的DNA,结果显示,基因组DNA的A260/A280比值都在1.8~2.0之间,浓度50.58~512.3 μg/mL。
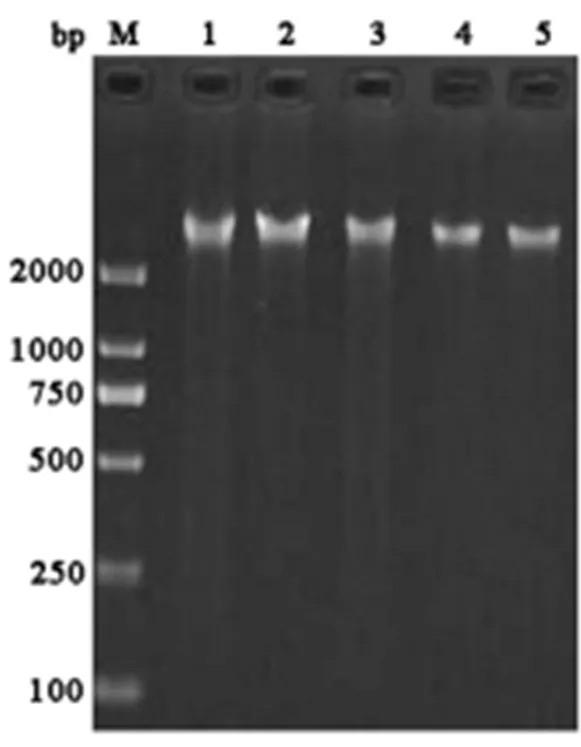
图1 精子基因组DNA的琼脂糖凝胶电泳
2.2 大理白族和汉族精子活力正常者精子mtDNA的PCR扩增
从精子活力正常者的精液中提取的基因组DNA模板,以引物L1/H1引物扩增可以获得正常mtDNA的片段,长度为533 bp,证明mtDNA提取成功。凡是未扩增到代表正常mtDNA产物的基因组DNA模板,不用于后续实验。用L2/H2引物扩增,凡是未扩增出524 bp产物的模板,说明mtDNA无4977 bp缺失;凡是扩增出524 bp产物的模板,说明mtDNA存在4977 bp缺失。取部分大理白族和汉族精子活力正常人的总mtDNA和有4977 bp缺失的mtDNA的PCR扩增产物进行2%琼脂糖凝胶电泳(图2)。
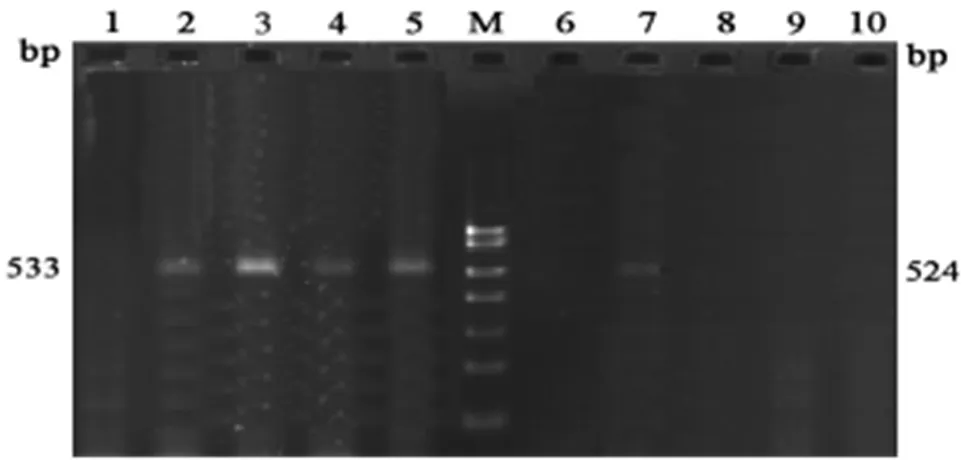
1:阴性对照;2-5:用引物L1/H1扩增代表总mtDNA的533 bp产物;6:阴性对照:7-10:用引物L2/H2扩增代表4977 bp缺失的524 bp产物
2.3 大理白族和汉族弱精子症患者精子mtDNA的PCR扩增
从大理白族和汉族弱精子症患者的精液提取的基因组DNA模板,分别以引物L1/H1引物和L2/H2引物进行PCR。凡是能同时扩增出533 bp产物和524 bp产物的样品,说明mtDNA 4977 bp缺失阳性。取部分大理白族和汉族弱精子症患者的总mtDNA和有4977 bp缺失的mtDNA的PCR扩增产物进行2%琼脂糖凝胶电泳(图3)。

1:阴性对照;2-5:用引物L1/H1扩增代表总mtDNA的533 bp产物;6:阴性对照:7-10:用引物L2/H2扩增代表4977 bp缺失的524 bp产物
2.4 胶回收DNA测序结果
将10例mtDNA 4977 bp缺失标本及5例正常对照组标本的PCR产物进行琼脂糖凝胶DNA回收后,送昆明硕擎生物技术有限公司进行DNA纯化和测序。将测序得到的DNA序列与人类mtDNA剑桥序列(GenBank:J01415)通过DNASTAR软件进行核苷酸序列比对分析,结果显示,mtDNA缺失区域是在8470 bp~13477 bp间存在的DNA片段缺失(图4)。
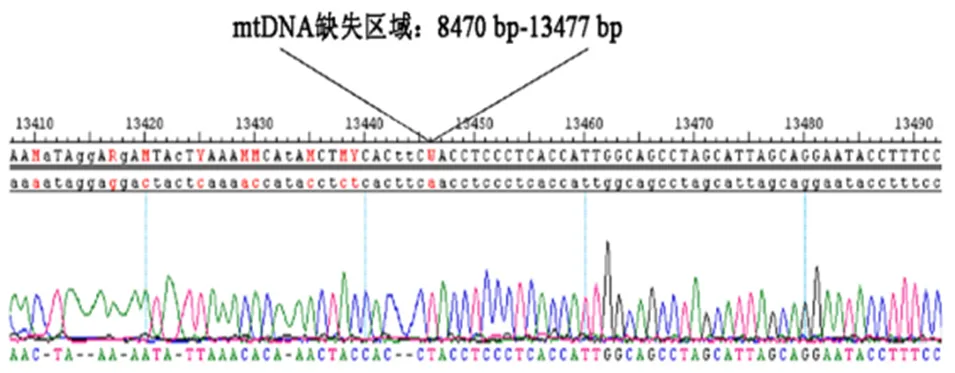
图4 DNA测序与人mtDNA剑桥序列核苷酸比对(mtDNA在8470 bp~13477 bp间存在的DNA缺失)
2.5 mtDNA 4977 bp缺失与弱精子症的关系
将受检查对象按大理白族、汉族分组,在同一个民族中按精子活力再分组,分别比较两组之间mtDNA 4977 bp缺失的发生率与弱精子症的关系,分别在大理白族、汉族两个民族发现,弱精子症组mtDNA 4977 bp缺失的发生率均高于正常对照组(表2),经卡方检验,缺失的发生率在两组之间具有极显著性差异(< 0.01)。通过比较大理白族、汉族间精子活力不同组mtDNA 4977 bp缺失的发生率,结果显示两组之间无显著性差异(> 0.05)(表3)。

表2 白、汉两族不同组精子活力mtDNA 4977 bp缺失发生率
注:白族精子活力正常组与弱精子症组间比较< 0.01;汉族精子活力正常组与弱精子症组间比较< 0.01.

表3 白、汉两族间精子活力不同组mtDNA 4977 bp缺失发生率
注:白、汉两族间精子活力正常组mtDNA 4977 bp缺失发生率比较> 0.05;白、汉两族间弱精症组mtDNA 4977 bp缺失发生率比较> 0.05.
3 讨论
精子线粒体在人类受精过程中扮演着重要角色,精子mtDNA缺陷是男性不育症的原因之一。精卵细胞融合障碍,精子无法与透明带识别、精子的泳动障碍均可导致精子功能障碍[11]。为了解精子运动和受精能力下降发生的原因,有必要从分子层次上研究并开发相关的治疗策略。已有许多资料证明,精子获能前主要依靠无氧酵解供能,精子进入女性生殖道后开始获能[12]。精子获能后代谢活性明显增强,表明能量的供给除无氧酵解外更重要的是有氧氧化。精子中的线粒体聚集在尾的基部,而mtDNA编码了参与细胞氧化磷酸化的13条多肽链。mtDNA 4977 bp的缺失和其它类型突变将减少mtDN A编码的氧化磷酸化相关蛋白的合成,从而影响ATP的合成,引起弱精子症和不育症[13]。
在本研究中,我们采用PCR技术对大理白族和汉族两类人群分别进行了精子mtDNA 4977 bp缺失的研究。结果发现,精子活力正常组与弱精子症患者组mtDNA 4977 bp缺失频率比较差异具有极显著性(< 0.01),由此可见,精子mtDNA 4977 bp缺失在弱精子症的发病中发挥重要作用。大理白族和汉族人群两组间mtDNA 4977 bp缺失无显著差异(> 0.05)。夏米西努尔.依力克等[14]报道新疆维吾尔族和汉族人群mtDNA 4977 bp缺失在弱精症的发病中起到重要作用,但两组人群间mtDNA 4977 bp缺失频率无显著差异,提示mtDNA 4977 bp在弱精子症患者中缺失频率可能与不同民族人群的遗传背景无关。本研究结果也间接支持了他们的观点。
已有研究表明,mtDNA突变或缺失可引起更多的内源性氧化损伤[13]。mtDNA突变或缺失可引起线粒体功能失调,事实上,呼吸链持续产生活性氧(ROS)如内源性及外源性氧自由基、氧化应激将引起线粒体的氧化损伤,造成细胞功能障碍。1995年,Kao等[9]首次在不育症患者活力低下的精子中发现mtDNA存在高频率的4977bp片段缺失。Dhillon等[15]于2007年在印度男性中通过对179例少弱精子症患者和200例正常生育者进行核苷酸多态性分析,发现mtDNA片段缺失与男性不育存在明显的相关性。Tsai等[16]研究发现,mtDNA 4977 bp片段缺失与体外受精的受孕率成负相关,因此在体外受精形成胚胎过程中此片段可能发挥重要作用。Gashti等[17]通过PCR技术检测发现精子mtDNA 4977 bp缺失在患精索静脉曲张男性组发生率为81.66%,而在对照组仅为15.55%,因而推测精索静脉曲张可能是精子mtDNA片段缺失的诱导因素。Kumar等[18]证实,少弱精子症患者中包括线粒体ATPase6、ATPase8、ND2、ND3、ND4、ND5在内的线粒体基因核苷酸突变频率增加,并认为精液中过多的ROS和低抗氧化物水平能引起线粒体的缺失、突变,进而减弱精子的受精能力。Kao等[19]证实细胞内8-羟-2-脱氧鸟苷与精子mtDNA 4977 bp缺失存在正相关,可作为mtDNA氧化损伤的分子标志。氧自由基(ROS)介导的DNA氧化应激可能是精子mtDNA大片段缺失的诱因[19]。
另有研究表明,随着年龄的增长,精、卵细胞mtDNA缺失或突变可由生殖细胞生理环境的持续改变引起[20]。本研究结果并未提示精子mtDNA 4977 bp缺失与年龄有关,这有待进一步深入研究。总之,mtDNA突变或缺失能引起精子发生过程中精子形态及结构的改变,mtDNA缺失可能出现或累积在起始的精子细胞内,最终引起精子呼吸功能的减低及运动能力的减退[21]。此外,在采用人工授精和试管婴儿等辅助性生育技术时也应考虑mtDNA异常等问题来避免遗传病的传播[22]。
[1] Borqes E Jr, Setti A S, Braqa D P, et al. Total motile sperm count has a superior predictive value over the WHO 2010 cut-off values for the outcomes of intracytoplasmic sperm injection cycles[J]. Andrology, 2016., 51(12): 1023-1029.
[2] Ruiz-Pesini E,Lapena A C, Diez-Sanchez C. Human mtDNA haplog-roups association with high or reduced spermatozoa motility[J]. Am J Hum Genet.2000, 67(3): 682-696.
[3] Wallace D C. Mitochondria lgenetics:a paradigm for aging and degenerative diseases?[J]. Scinence, 2002, 12(31): 256-268.
[4] PiomboniP, Focarelli R, Stendardi A, et al. The role of mitochondria in energy production for human sperm motility[J]. Int J Androl, 2012, 35(11): 109-124.
[5] 郑英,沙家豪,周作民,等. 线粒体DNA与生殖[J]. 生殖医学杂志,2008,7(4):242-266.
[6] Ieremiadou F,Rodakis G C.Correlation of the 4977bp mitochondrial DNA deletion with human sperm dysfunction[J]. BMC Res Notes, 2009, 2(7): 18-21.
[7] 梁爽,王成彬. 精子线粒体基因片段缺失及点突变与弱精症相关性研究进展[J]. 临床检验杂志:电子版, 2015,4(1):818-823.
[8] 曹兴午,李翠英,袁长蔚. 线粒体缺失与男性不育症[J]. 中国性科学,2010,19(10):4-7.
[9] Kao S, Chao H T, Wei Y H. Mitochondrial deoxyribonu-cleic acid 4977-bp deletion with diminished fertility and motility of human sperm[J]. Biol Reprod,1995, 52(4): 729-736.
[10] 周万灏,马旭,姜辉,等. 生育男性和白细胞精子症患者精子线粒体基因缺失和含量的研究[J]. 中华男科学杂志,2008,14(5):391-395.
[11] 王巧刚,陈黎亚,盛礼建. 精子线粒体与男性不育的相关性研究进展[J]. 中国现代医生,2017,55(4):160-163.
[12] 李刚琴,何映. 精子线粒体DNA与男性不育研究进展[J]. 中华男科学杂志,2017,23(9):848-851.
[13] Ruiz-Pesini E, Lapena A C, Diez-Sznchez C. Human mtDNA haplog-roups associated with high or reduced spermatozoa motility[J]. Am J Hum Genet, 2000, 67(3): 682-696.
[14] 夏米西努尔.伊力克,阿尔斯.吐尔逊,陈晓,等. 维吾尔族和汉族弱精子症病人mtDNA4977bp缺失相关性研究[J]. 中国男科学杂志,2006,20(4):48-51.
[15] Dhillon V S, Shahid M, Husain S A. Association of MTHFR DNMT3b 4977 bp deletion in mtDNA and GSTM1 deletion, and aberrant CpG island hypermethylation of GSTM1 in non-obstructive infertility in Indian men[J]. Mol Hum Reprod, 2007, 13(4): 213-222.
[16] Tsai H D, Hsieh Y H,Hsieh J N, et al. Mitochondria DNA deletion and copy numbers of cumulus cells associated with in vitro fertilization outcomes[J]. J Repro Med,2010, 55(11-12): 491-497.
[17] Gashti N G, Salehi Z, Madani A H, et al. 4977-bp mitochondrial DNA deletion in infertile patients with varicocele[J]. Andrologia, 2014, 46(3): 258-262.
[18] Kumar R, Bamezai R N, Kumar R, et al. Increased lipid peroxidation, low antioxidant levels and nucleotide changes in mitochondrial DNA in idiopathic asthenozoospermic men of Indian origin[J]. Indian J Clin Biochem, 2007, 22(2): 355-358.
[19] Kao S H, Chao H T, Chen H W, et al. Increase of oxidative stress in human sperm with lower motility[J]. Fertil Steril, 2008, 89(5): 1183-1190.
[20] Krishnan K J, Reeve A K, Samuels D C, et al. What causes mitochondrial DNA deletions in human cells?[J]. Nat Genet..2008,40(3): 275-279.
[21] Abulkar P S, Chuadhari A R, Pal A K. Association of large scale 4977-bp “common” deletion in sperm mitochondrial DNA with asthenozoospermia and oligaas- thenoteratoospermia[J].J Hum Reprod Sci.,2016, 9(1): 35-40.
[22] Rajender S, Rahul P, Mahdi A A. Mitochondria, spermatogenesis and male infertility[J]. Mitochondrion, 2010,10(5): 419-428.
ASSOCIATION OF mtDNA 4977 bp DELETION OF SPERMATOZOA BETWEEN DALI BAI AND HAN NATIONALITY MALES WITH ASTHENOZOOSPERMIA
YANG Yong-qin1,2, XIAO Yang1, ZI Jia-ji1, LI Su-fen1, YU Cheng-he3, ZHANG Ruo-peng3,*XIONG Wei1
(1. College of Basic Medical Sciences, Dali University, Dali, Yunnan 671000, China; 2. Department of Nephrology, Traditional Chinese Medicine Hospital of Chuxiong Prefecture, Chuxiong, Yunnan 675000, China; 3. Department of Reproductive Medicine, The First Affiliated Hospital of Dali University, Dali 671000, Yunnan, China)
The relationship and differences for mtDNA 4977 bp deletion of spermatozoa between the normal Dali Bai and Han males with asthenozoospermia was investigated in this paper.Using polymerase chain reaction (PCR) technique, the frequency of occurrence and properties of mtDNA 4977 bp deletion were determined in human spermatozoa with different motilities. According to the three criteria established by World Health Organization 1999 (WHO 1999), samples were divided into 4 groups. They were Bai nationality male with normal sperm (120 cases), Bai nationality Male with asthenozoospermia (137 cases); Han nationality male with normal sperm (120 cases), Han nationality Male with asthenozoospermia (121 cases), and the samples in hot mutation region -4977 bp of mtDNA were screened. The results showed that the frequency of the presence of the 4977 bp deletion was 8.33% in Bai nationality males with fertility, 64.96% in Bai nationality males with infertility, 5.83% in Han nationality males with fertility, 70.25% in Han nationality males with infertility. The frequency of the deleted mtDNA 4977 bp in the spermatozoa with poor motility was significantly higher than those in the spermatozoa with good motility(< 0.01). In addition, there were no significant differences between Bai and Han male with infertility(> 0.05). It could be concluded thatmtDNA4977 bp deletion have close association of asthenozoospermia, mtDNA4977 bp deletion may play an important role in the pathophysiology of male infertility for both Han and Bai males in Dali district, Yunnan province.
asthenozoospermia; mitochondrial DNA; 4977 bp deletion; Bai nationality
1674-8085(2019)01-0023-06
R698.2
A
10.3969/j.issn.1674-8085.2019.01.006
2018-07-15;
2018-10-19
国家自然科学基金项目(81560458, 31601155);云南省教育厅科学研究基金项目(2016ZDX01, 2016ZDX05);云南省中青年学术和技术带头人后备人才项目(2017HB077);大理大学大学生创新创业计划项目(S-CXCY-2018-16)
杨勇琴(1979-),女,云南安宁人,讲师,硕士,主要从事细胞生物学研究(E-mail: 46097867@qq.com);
肖 杨(1995-),女,云南曲靖人,大理大学基础医学院本科生(E-mail: 614348665@qq.com);
自加吉(1980-),男,云南大理人,讲师,硕士,主要从事分子病理学研究(E-mail: dldxjcyxyzjj@163.com);
李素芬(1993-),女,山东济宁人,硕士生,主要从事细胞分子生物学研究(E-mail: 1446198172@qq.com);
于成和(1988-),男,湖南邵阳人,医师,主要从事男性生殖医学研究(E-mail: 51554514@163.com);
张若鹏(1974-),男,山东菏泽人,副主任医师,博士,主要从事生殖医学研究(E-mail: 791372366@qq.com);
*熊 伟(1982-),男,湖南株洲人,教授,博士,硕士生导师,主要从事肿瘤细胞分子生物学和生物信息学研究(E-mail: xwailp@163.com) .
