深山含笑叶过氧化物酶对双酚A清除效应研究
2019-03-08赵广华
赵广华,肖 强*,洪 健
1湖北民族学院 生物资源保护与利用湖北省重点实验室;2湖北民族学院林学园艺学院,恩施 445000
深山含笑(MicheliamaudiaeDunn),又名光叶白兰、莫夫人玉兰,木兰科含笑属,常绿乔木。中国特有物种,主要分布在浙江、福建、湖南、广东、广西、贵州等地。具有生长快、材质好,叶片冬季不凋,早春花色纯白艳丽、味清香等特性。其树型美观,是较好的园林观赏树种;我们在研究木兰科植物酶谱多样性时,发现深山含笑叶片具有较高过氧化物酶活性。
过氧化物酶(Peroxidase,POD,EC 1.11.1.7)是一种以过氧化氢为电子受体,通过催化底物发生氧化反应改变结构,引起底物理化性质发生变化的生物催剂。它广泛分布于动植物和微生物体内,在细胞中发挥清除过氧化氢作用[1]。POD在植物细胞壁形成、生长激素失活、次生物质代谢以及防卫反应应答等多种生理过程中发挥重要作用[1]。POD催化活性在工业上也用于石化、造纸、纺织等行业废水中酚类和芳香胺类污染物高效降解[2]。国内外许多学者开展了对辣根过氧化物酶(Horseradish peroxidase,HRP)、大豆过氧化物酶(Soybean peroxidase,SBP)和刺桐叶过氧化物酶等用于酚类物质清除的条件优化、动力学特性和反应机理研究[3-5],展现了POD在去除环境水体中微量酚类污染物中的良好前景。
双酚A(Bisphenol A,BPA)是一种重要的有机化工原料,广泛应用于聚碳酸酯、环氧树脂、阻燃剂、增塑剂、橡胶抗老化剂等生产中,用这些材料生产的终端产品,如婴儿奶瓶,微波炉饭盒、食品包装盒、饮料罐等均含有BPA。BPA的广泛应用带来了日渐严重的环境污染:在日本垃圾处理场和堆肥水样中均可检出BPA,其平均浓度达269 μg/L[6]。BPA等酚类化合物是内分泌干扰物(Endocrine disrupting Chemicals,EDCs)的重要成员之一,20世纪80年代以来的系列研究表明,BPA对水生生物和人体细胞具有雌激素作用和生物学毒性[7,8];能干扰人体内正常激素的分泌,从而影响生殖功能,增加肿瘤的发病率;即使是低剂量染毒,也能造成严重的损伤。EDCs具有生物富集、效用持久以及生理学响应浓度极低等特性,使得其在水体中很难通过传统水处理技术去除。目前对环境中BPA的消除主要采用生物降解、光催化的化学降解、物理吸附以及生物酶降解等方法;其中,基于POD的降解方法具有高效、反应条件温和等优点受到广泛关注。
为了探讨深山含笑叶片POD在清除水体中EDCs中应用前景,开发其叶片经济价值,我们对深山含笑叶片POD进行了快速分离纯化;在此基础上进一步考察了其对水体中EDCs类物质BPA的去除效果及反应条件。该研究对于降低使用POD处理废水的运营成本,探索新的具有较强清除能力的POD,通过优化反应条件,有效去除EDCs类污染物具有重要价值。
1 材料与方法
1.1 试验材料
本研究以湖北民族学院植物园内种植的10年龄深山含笑(MicheliamaudiaeDunn)(经湖北民族学院林学园艺学院易咏梅教授鉴定)成熟叶为原料。
1.2 试验方法
1.2.1 粗酶液制备
称取成熟深山含笑树叶500 g,加入10 g PVPP,在液氮中迅速研磨,然后加入2 000 mL含10%聚乙烯吡咯烷酮(PVP-K30)和2 mmol/L乙二胺四乙酸(EDTA)的磷酸缓冲液(50 mmol/L,pH7.8),室温下连续搅拌22~24 h。4层纱布过滤,经测定滤液所得可溶态POD(Soluble Peroxidase,SPOD)的活性较低(见图1),丢弃,留下含水滤渣约180 g;按照ukalovic等[9]的方法,即采用1%(w/v)吐温80,1 mol/L NaCl提取滤渣中的结合态POD(Bound Peroxidase,BPOD)。室温下搅拌提取2~5 h,在4 ℃ 12 000 g条件下,离心20 min,得到大约800 mL粗酶液,置于4 ℃冰箱冷藏待用。

图1 可溶性POD与结合态POD比活力比较Fig.1 Comparison of specific activity between soluble POD and bound POD注:不同字母表示在P<0.05水平上差异显著。Note:Values followed by a different letter are significantly different at the 0.05 probability level.
1.2.2 双水相萃取(Aqueous two-phase extraction,ATPE)
上述约800 mL粗酶提取液在搅动中缓慢加入80 g硫酸铵粉末,充分溶解后,再缓慢加入112 g聚乙二醇4000(PEG 4000),并在振荡器上振荡,使其形成14% PEG 4000(W/V)-10% (NH4)2SO4(W/V)的双水相体系,转移至分液漏斗中静置萃取2 h或者将双水相体系转入离心管中,5 000 g离心5 min左右,其萃取除色效果如图2所示。然后取下相(盐相),转移至透析袋中,蒸馏水透析除盐;每8 h更换一次水,直至透析液用1% BaCl2检测无沉淀产生为止(一般在有磁力搅拌器搅拌的情况下,更换3次水蒸馏水即可达到除盐效果)。
图2 14%(w/v)PEG 4000-10%(w/v)硫酸铵双水相萃取效果图Fig.2 Photograph showing the effect of ATPE with phase composition 14%(w/v)PEG 4000/10% ammonium sulfate (w/v) 注:a:粗酶液,b:双水相萃取体系Note:a:Crude extract,b:System with Aqueous two-phase extraction
1.2.3 蛋白质层析
根据pH梯度预实验可知,目标酶蛋白在离子浓度小于50 mmol/L、pH大于9.5(Tris-HCl缓冲液)的条件下可被DEAE- Sepharose Fast Flow阴离子交换柱(2.6 cm × 20 cm)吸附。调整酶液pH为9.5,离子浓度为20 mmol/L,采用系统泵进样400 mL,用pH 9.5、20 mmol/L Tris-HCl 缓冲液进行吸附,然后用含NaCl线性梯度(0~1 mol/L)的Tris-HCl缓冲液洗脱12个柱体积,流速为1.0 mL/L。每管收集5 mL,在280 nm波长下检测蛋白含量,测定酶活。收集有酶活性部分,经透析脱盐后冷冻干燥保存待用。
1.2.4 蛋白质电泳
根据预试验可知,碱性电泳法无法有效分离深山含笑POD,在高pH条件下,部分POD残留于加样孔和未进入浓缩胶;部分POD未进入分离胶;而酸性聚丙烯酰胺凝胶电泳[10]可以实现良好分离。
1.2.5 POD酶活性、蛋白含量测定
参考Amako等[11]的方法并稍修改,测定体系为4 mL,包括1 mL 40 mmol/L愈创木酚,1 mL 40 mmol/L H2O2,1.9 mL 100 mmol/L Na2HPO4-柠檬酸缓冲液(pH6.0)。加入0.1 mL酶液后启动反应,于波长470 nm,30 ℃下记录OD值变化。1个酶活性单位定义为测定条件下每分钟OD470变化0.1所需的酶量。蛋白质含量测定采用Bradford染色法[12],以牛血清蛋白作标准蛋白。
1.2.6 POD酶学性质研究
取真空冷冻干燥的酶粉以适量缓冲液溶解后,进行酶的温度稳定性、最适温度、酸碱稳定性、最适pH等酶学性质的研究,参照洪健等[13]的方法。
1.2.7 研究不同酶活性、pH、温度、H2O2浓度以及反应时间对BPA清除的影响
采用50 mL棕色瓶中避光反应,配制20 mL反应混合溶液。反应体系配制如下:准确移取一定量BPA标准储备液及pH缓冲溶液于50 mL棕色瓶中,加入一定量的深山含笑叶POD,使反应体系总体积达到20 mL,并在恒温水浴锅中保温一段时间后,再加入一定量H2O2并同时计时,分别在1、3、5、15、45、90、120、180 min取样。取样时加入甲醇终止反应。待取样完成后,加入适量浓度为10 mg/mL的硫酸铝钾母液,过夜沉淀后离心取上清。采用高效液相色谱-飞行时间质谱联用法(UPLC-TOF-MS)测定上清液中BPA浓度。
1.3 分析方法
1.3.1 色谱分析条件
Agilent公司ZORBAX C18(2.1×50 mm,1.8 μm)色谱柱。流动相为乙腈-0.1%甲酸水溶液,35%乙腈等度洗脱,柱温25 ℃,体积流量0.2 mL/min。
1.3.2 质谱分析条件
ESI离子源负模式,干燥气温度350 ℃,流速10 L/min;雾化器压力45 psig,毛细管电压3 500 V,毛细管出口电压150 V,锥孔电压65 V,采集速度1.5 spectra/s,选择离子(EIC)采集方式,选定的分子离子[M-H]-的质荷比为227(BPA)。
1.3.3 酶纯度分析方法
测定酶活性及蛋白质含量后,酶的纯化倍数采用以下公式计算:
S=U/C
公式1
M=C×V
公式2
F=S1/S0
公式3
Y=M1/M0
公式4
注:(1)S指酶的比活力(U/mg),S1指纯化后酶的比活力,S0指粗酶比活力;
(2)U指酶的活性单位(U/mL);
(3)C指酶蛋白的浓度(mg/mL);
(4)M指酶蛋白含量(mg),M1指纯化后总蛋白含量,M0指粗酶总蛋白含量;
(5)V指酶液的体积(mL);
(6)F指酶的纯化倍数;
(7)Y指酶蛋白的回收率(%)。

图3 结合态POD的DEAE-Sepharose FF柱层析分离Fig.3 Chromatographic pattern of the BPOD from DEAE-Sepharose FF
2 结果与分析
2.1 POD分离纯化
深山含笑叶片经匀浆、过滤、离心后经过双水相萃取除色素、透析后的酶液,进行DEAE-Sepharose Fast Flow离子交换层析,得到3个峰,峰1具有酶活性,但峰2和峰3酶活性极低(图3)。收集峰1,得到纯化后的POD,纯化倍数为5.5倍,相对SPOD纯化倍数为55.2倍(表1),RZ值可达1.0左右。对该纯酶进行非变性垂直板聚丙烯酰胺凝胶电泳(Native Polyacrylamide Gel Electrophoresis,N-PAGE)及SDS-PAGE变性电泳,采用联苯胺和考马斯亮蓝分别染色,显示得到单条同工酶带,其分子量大约为44.51 KD(图4)。

图4 深山含笑叶片POD同工酶活性电泳(A)及SDS变性电泳(B)Fig.4 Electrophoretogram of peroxidase isoenzyme extracted from leaves of Michelia maudiae Dunn (A:N-PAGE,B:SDS-PAGE,注:a:可溶性POD b:结合态POD c:ATPE d:透析 e&1:DEAE-Sepharose Fast Flow M:标准蛋白。Note:a:SPOD b:BPOD c:ATPE d:dialysis e&1:DEAE-Sepharose Fast Flow M:Marker.
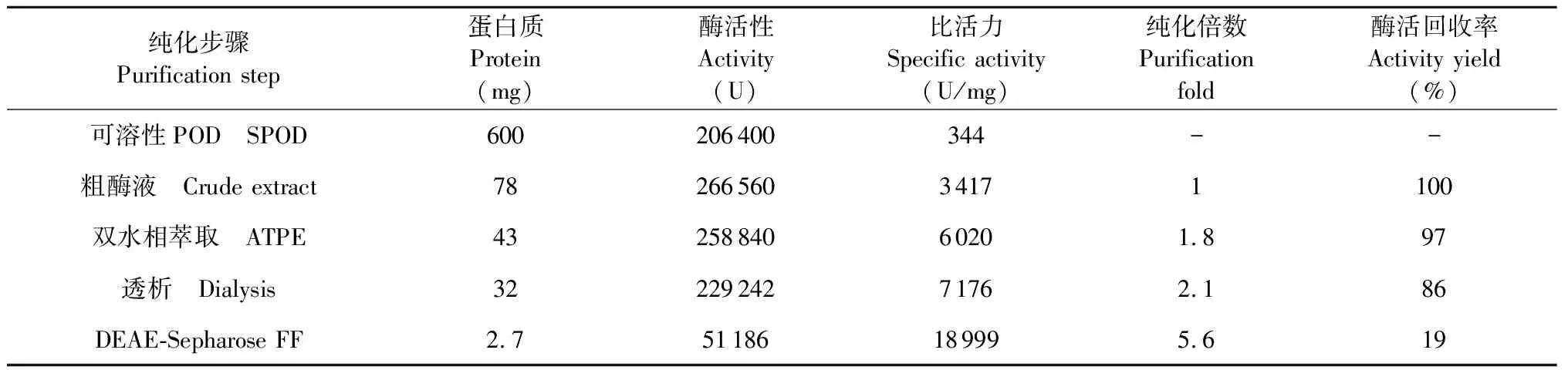
纯化步骤Purification step蛋白质Protein(mg)酶活性Activity(U)比活力Specific activity(U/mg)纯化倍数Purificationfold酶活回收率Activity yield(%)可溶性POD SPOD600206400344--粗酶液 Crude extract7826656034171100双水相萃取 ATPE4325884060201.897透析 Dialysis3222924271762.186DEAE-Sepharose FF2.751186189995.619
2.2 POD性质
2.2.1 POD的温度稳定性
将真空冷冻干燥后的纯酶,用适量pH 5.0的乙酸缓冲液溶解,1.5 mL试管分装在不同温度水浴中保存,并以20 ℃酶活性作为对照,分别测定不同时间的相对酶活。在80 ℃水浴中保存的纯酶,酶活性迅速下降(图5),1 h内酶活性下降至15%以下。在70 ℃和80 ℃水浴加热4 h左右酶活性几乎全部损失。酶活性在50 ℃水浴加热下无明显损失;而在60 ℃水浴1 h,酶活性仍剩余75%。说明深山含笑叶POD热稳定性较好,不易失活。
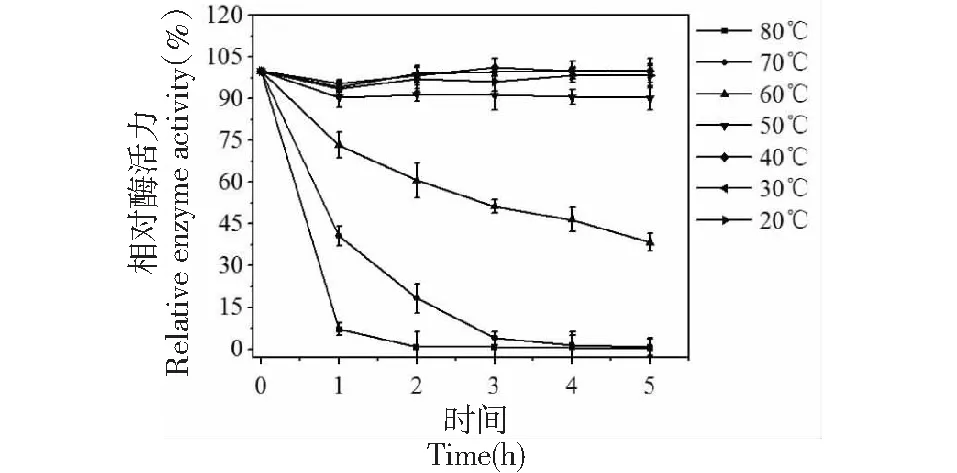
图5 深山含笑叶POD的热稳定性Fig.5 Stability of temperature of POD from Michelia maudiae Dunn leaf
2.2.2 POD的pH稳定性
将真空冷冻干燥后的纯酶,用适量不同pH的缓冲液溶解,在与缓冲液pH值相同的条件下分别测定酶活性(图6),可见pH在5.5~9.5之间,深山含笑叶POD酶活性均保持在较高水平,说明深山含笑叶POD酸碱稳定性较好,具有较宽的pH适应范围。

图6 深山含笑叶POD的pH稳定性Fig.6 Stability of pH of POD from Michelia maudiae Dunn leaf
2.2.3 POD的最适温度
反应体系在Carry 100/300比色皿恒温夹套上保温,达到预定温度后,加入0.1 mL酶液,立即测定OD470时间变化率;结果显示,在50 ℃时POD酶活性较其他温度下酶活性高(图7);表明深山含笑叶POD最适温度为50 ℃。

图7 温度对深山含笑叶POD活性的影响Fig.7 ffect of temperature on activity of POD from Michelia maudiae Dunn leaf
2.2.4 POD的最适pH
以愈创木酚作为底物,由图8可以看出,在pH4.0~5.5条件下,相对酶活性均高于90%,在pH4.5时达到最高值,表明深山含笑叶POD的最适pH为4.5。
2.3 POD对BPA的清除效应
2.3.1 最佳清除酶浓度确定
取纯化酶少量,用适量pH 5.0的乙酸缓冲液溶解,添加溶解后的酶适量使反应体系中的酶活性单位分别达到5 U/mL、10 U/mL、15 U/mL,在pH值为5,H2O2/BPA为2的条件下,将反应混合物置25 ℃的恒温水浴磁力搅拌器中进行反应。分别在1、3、5、15、45、90、120和180 min取样,用甲醇和硫酸铝钾终止反应,测定BPA浓度。结果(如图9)显示酶浓度在15 U/mL时,BPA在反应3 min后,剩余率低于10%,反应90 min后,BPA被完全清除。为了研究POD清除BPA的化学过程,选定15 U/mL为合适的酶浓度实验条件。

图8 pH对深山含笑叶POD活性的影响Fig.8 Effect of pH on activity of POD from Michelia maudiae Dunn leaf

图9 不同酶浓度对深山含笑叶POD清除BPA的影响Fig.9 Effects of different enzyme concentrations on POD from Michelia maudiae Dunn leaf removal of BPA
2.3.2 pH对POD清除BPA的影响
研究不同pH对POD清除BPA的影响,如图10所示,pH在4.0-7.0条件下,经过3 h清除反应,BPA清除率均达到95%以上;表明深山含笑叶POD在清除BPA时具有较广的酸性pH范围;但它们在1 min钟内达到的清除速率不一致,pH 3.0仅清除36.5%,而pH 7.0 清除率可达92.3%,在pH 3.0-7.0范围内,1 min内的清除速率随pH上升而逐渐上升;pH 8.0-11.0条件下,清除率均小于80%;这可能与深山含笑叶POD的最适反应pH及pH稳定性有关,酶的最适pH在4.0~5.5范围内(图8),而酶在pH 5.5~9.5范围内稳定(图6)。
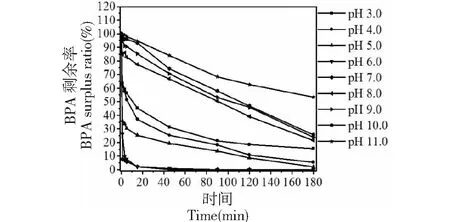
图10 pH对深山含笑叶POD清除BPA的影响Fig.10 Effects of different pH on POD from Michelia maudiae Dunn leaf removal of BPA
2.3.3 温度对POD清除BPA的影响
研究不同温度对POD清除BPA的影响,分别在集热式恒温加热磁力搅拌器上操作,控制pH为7.0、酶浓度为10 U/mL、H2O2/BPA摩尔浓度比值为2,反应时间3 h,在此反应体系中,对清除速度,底物完全清除时间进行比较,从图11可见,在30~40 ℃范围内,反应3 h,BPA清除率达到90%以上,当温度达到60 ℃时,BPA清除率下降至53.3%。
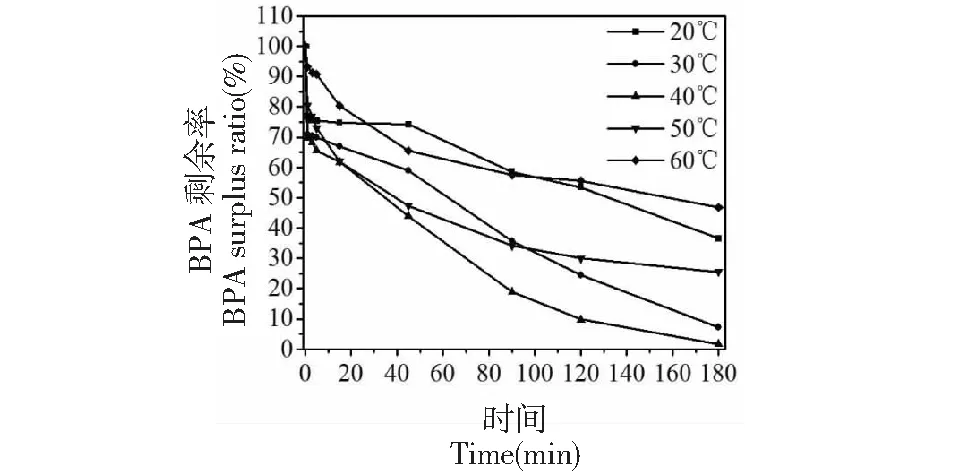
图11 不同温度对深山含笑叶POD清除BPA的影响Fig.11 Effects of different temperature on POD from Michelia maudiae Dunn leaf removal of BPA
2.3.4 最佳清除H2O2/BPA比值确定
研究H2O2/BPA摩尔浓度比值对POD清除BPA的影响时,设定比值分别为0.2、0.5、0.8、1.2、2、5倍,控制温度、酶浓度、pH相同,在此条件下,对清除速度、底物完全清除时间进行比较。如图12所示,当H2O2/BPA摩尔浓度比值为0.2~2的范围时,反应3 h,BPA清除率可达95%,但1 min内达到的清除速率不同;当比值为2时,BPA清除率可达51%,当H2O2/BPA摩尔浓度比值达到5倍时,1 min内BPA清除率达到55.4%,由于高浓度H2O2抑制酶活性(图13),随后BPA清除速率下降,3 h后BPA清除率为76.7%;确定H2O2/BPA摩尔浓度比值为2倍。

图12 不同过氧化氢比例对深山含笑叶POD清除BPA的影响Fig.12 Effects of different mole ratio of H2O2 to BPA on POD from Michelia maudiae Dunn leaf removal of BPA注:不同字母表示在P<0.05水平上差异显著。Note:Values followed by a different letter are significantly different at the 0.05 probability level.
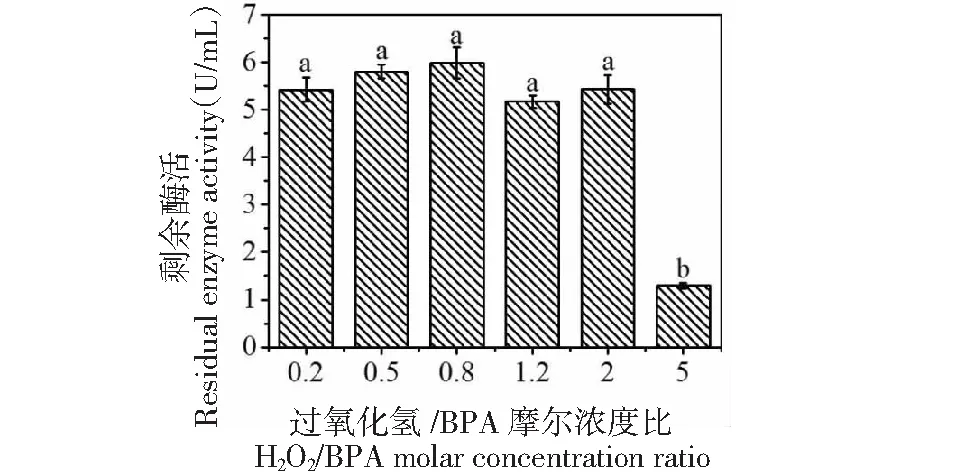
图13 不同过氧化氢比例对深山含笑叶POD清除BPA后剩余酶活的影响Fig.13 Effects of different mole ratio of H2O2 to BPA on residual POD activity from Michelia maudiae Dunn leaf removal of BPA
3 结论
植物POD与逆境胁迫下植物清除细胞内自由基以及植物次生物质合成等生化过程有密切关系[1]。已有学者研究了不同植物来源POD的性质:皱皮木瓜和日本木瓜的POD有2个最适pH值,分别是5和6~6.5、5和5~6[14];而纯化后的银杏叶POD最适pH值为5[15];木兰科植物厚朴叶POD的反应最适pH为6[13];它们的最适反应pH较为相近。本研究显示深山含笑叶POD最适pH为4.5,与木瓜和银杏叶POD最适pH比较接近,均在酸性pH范围内。银杏叶POD经50 ℃热处理30 min后活性剩余50%,而SBP[16]在75 ℃时保温1 h仍可保持较高活力,90 ℃下加热1 h活性仍未完全消失。本研究中,深山含笑叶片 POD在50 ℃以下水浴5 h,酶活性无明显损失,在60 ℃以下水浴加热2 h,剩余酶活力达60%以上;与热稳定性超高的大豆POD比较接近,说明深山含笑叶片POD耐热性较好,有利于实际生产应用。
金银花POD催化愈创木酚氧化的最适反应温度为30 ℃左右[17];银杏叶POD酶促反应最适温度为37 ℃,随着温度升高,酶活力逐渐下降;温度对厚朴叶片POD活力影响较小,随温度升高酶活力下降缓慢,75 ℃保温60 min后仍然保持70%酶活性[13],本研究中同为木兰科植物的深山含笑叶POD最适反应温度为50 ℃,在60 ℃中保温1 h,酶活性仍剩余75%,两者具有相似性,而藕带中POD在80 ℃下酶活性基本丧失[18];显示不同植物来源POD的热稳定性差异较大。
杜红霞[19]探讨了HRP和双氧水对BPA的降解性能。实验结果表明,该酶促反应的最适温度为25 ℃ ;最适pH值为6;H2O2/BPA最佳比例为2:1(摩尔比);经过120 min;0.5 U/mL HRP对BPA的降解效果最好。Duarte-Va'zquez等[20]研究了萝卜过氧化物酶(Turnip Peroxidase,TP)对酚类物质的清除效果,结果显示,在pH4~8,温度25 ℃,H2O2浓度0.8 mmol/L条件下,经过3 h,1.28 U/L TP对0.5 mmol/L酚类物质BPA清除率可达85%;本研究中,在pH4~7,温度30~40 ℃,H2O2/BPA值为2的条件下,经过3 h,10 000 U/L深山含笑叶POD对0.2 mmol/L BPA清除率可达90%以上。与Duarte-Va'zquez的研究结果类似,具有较宽的酸性pH范围及良好的温度适应性,表明深山含笑叶POD具有工业化应用的前景。本研究中,H2O2/BPA浓度之比达0.8以上时,深山含笑叶POD对BPA清除率显著提高,这一结果与来自HRP和SBP的研究结论是一致的[11,21]。同时,当处于高浓度过氧化氢条件下时,酶清除BPA的速率明显降低,与Flock等[5]研究的高浓度H2O2导致SBP对3-氯酚清除率持续下降结果具有一致性,工业应用时应注意高浓度H2O2对酶活性的抑制作用。
综上所述,经过非离子表面活性剂抽提、双水相萃取、DEAE-Sepharose FF层析分离,首次从深山含笑叶片分离提纯得到一种热稳定性较高的BPOD,该酶的比活力可达18999 U/mg蛋白,该酶在pH4~7,温度30~40 ℃,H2O2/BPA摩尔浓度之比达0.8条件下,对BPA清除率达90%以上。相对于HRP、TP以及SBP等POD,在清除BPA上,深山含笑叶POD具有更宽的pH和温度适应范围以及更高的清除率;且在本研究中采用双水相萃取法,具有容易工业放大、生物相容性好等特点,酶活性回收率高(见表1),显示了深山含笑叶POD将来应用于EDCs污染治理的巨大潜力。由于游离酶催化的酚类物质降解反应会导致酶活性逐步丧失,利用酶工程技术进一步探索深山含笑叶POD的固定化途径,可以为其工业应用提供技术支撑,从而为深山含笑叶经济价值的有效实现提供保障,促进深山含笑综合价值的可持续利用。
