花生壳乙醇提取物的脲酶抑制活性研究
2019-03-08刘佳佳李崴一倪伟伟陈慧敏赵奎成肖竹平
刘佳佳,李崴一,倪伟伟,刘 佩,陈慧敏,赵奎成,肖竹平
吉首大学化学化工学院 武陵山地区民族药解析与创制湖南省工程实验室,吉首 416000
我国是花生种植大国,年产量约1 500万吨,超过世界花生总产量的1/3[1],花生壳作为花生行业的一个主要副产物,年产量近500万吨,为花生壳的综合利用提供了丰富的资源。但目前以低附加值的利用为主,如在工业上作为吸附材料,在农业上用作饲料、食用菌的培养基等等[2]。事实上花生壳中含有多种功能物质,如黄酮类化合物、膳食纤维、天然黄色素、甾醇、胡萝卜素等等。其中黄酮类化合物因具有广泛的生物活性而引起了科研工作的持续关注,包括抗氧化、抗菌、抗炎、增强免疫力、降血脂、改善微循环等等[3]。Diaige的研究揭示花生壳中黄酮类化合物有木犀草素(1)、圣草酚(2)、5,7-二羟基色原酮(3)等,其中以木犀草素含量最高[4]。黄酮类物质的共同结构特征是含有由A、B、C环组成的三环骨架,主要区别是取代基的位置、数量以及C环不饱和度的差异,因此黄酮类物质表现出许多相似的生理功能。不仅不同植物来源的材料所含黄酮的种类和含量差异很大,而且同一植物来源的材料,产地、采摘季节、提取方法不同,也会造成黄酮种类和含量的差异。一般来说,提取物中所含的黄酮类化合物彼此间在功能上常存在一定的互补与协同增效的作用。基于这种认识,许多研究者直接用花生壳的提取物进行各种生物活性的研究,探索花生壳潜在的应用价值[5,6]。
花生具有一定的预防和治疗胃病的作用,尤其是在饭前,细嚼慢咽一些花生效果更佳。胃病包括急慢性胃炎、胃溃疡等。1984年马歇尔(Barry J.Marshall)和沃伦(Robin Warren)揭示了感染幽门螺旋杆菌(H.pylori)与胃病的直接关系,从此打破了胃病不能根治的神话[7],他们也因此获得了2005年的诺贝尔生理学或医学奖。幽门螺旋杆菌是一种格兰氏阴性细菌,是目前已知的唯一一种可以在胃内强酸环境中长期存活的致病菌,它依靠自身产生的脲酶,将人体体液中的尿素分解为氨和二氧化碳,产生的氨可以中和细菌表面的胃酸,为细菌形成了一个接近中性的微环境[8]。然而分解尿素产生的氨一方面会改变胃粘膜的通透性,造成胃酸对胃壁细胞的腐蚀,另一方面,氨本身对胃壁细胞也有腐蚀作用,破坏胃粘膜的完整性,胃酸进而加重胃壁细胞的损伤,最终导致胃炎、胃溃疡的发展和恶化[9]。对脲酶的抑制有助于根除幽门螺旋杆菌,已发现多种植物提取物对脲酶有抑制作用,如葡萄提取物、苹果皮提取物、金银花提取物、绿茶提取物、蜂蜜提取物等对脲酶具有较好的抑制作用[10-12]。考虑到花生壳和它们的主要成分一样,也是黄酮等多酚类物质,我们因此对花生壳提取物进行了脲酶抑制活性的研究,结果表明花生壳提取物对脲酶具有良好的抑制作用。
1 实验材料
1.1 仪器
SpectraMax Plus 384酶标仪(美谷分子仪器有限公司,美国)、Nicoya SPR分子作用仪(普瑞麦迪实验室有限公司,加拿大)、Agilent 1220高效液相色谱仪(安捷伦科技有限公司,美国)、Evolution 201紫外可见分光光度计(赛默飞世尔科技公司,美国)、Heidolph Hei-VAP Value旋转蒸发仪(海道夫集团,德国)、鼓风干燥箱(天津市泰斯特仪器有限公司)、磁力搅拌器(郑州紫拓仪器设备有限公司)、万能粉碎机(德清拜杰电器有限公司)。
1.2 材料
花生壳(湖南省永州市产花生,带壳晒干取壳)、脲酶(自提,幽门螺旋杆菌按文献方法[13]培养和提取脲酶)。
1.3 试剂
硝普钠(国药集团化学试剂有限公司,分析纯);芦丁(上海融禾医药科技发展公司,HPLC≥98%);硝酸铝(成都金山化学试剂有限公司,分析纯);乙醇(成都金山化学试剂有限公司,分析纯);乙腈(天津市科密欧化学试剂有限公司,色谱纯)。
2 方法
2.1 花生壳提取物的制备
将花生壳置于干燥箱中,在50 ℃下干燥4 h,用粉碎机粉碎,过20目筛,取60 g花生壳粉于烧瓶中,按料液质量体积比1∶20加入70%乙醇,在搅拌下升温至61 ℃, 在该温度下提取1.6 h,过滤,提取三次,滤液合并,浓缩至60 mL左右,加入乙醇进行醇沉,搅拌1 h,静置过夜,抽滤,滤液蒸至无乙醇味,干燥。
2.2 花生壳提取物中总黄酮含量的测定
精确称取芦丁对照品,用70%乙醇溶液配置成0.2 mg/mL的溶液,分别移取该溶液1.0、2.0、4.0、6.0、8.0、10.0 mL于6个10 mL容量瓶中,用70%乙醇定容,得0.02、0.04、0.08、0.12、0.16、0.20 mg/mL 的芦丁溶液,分别准确移取某一特定溶液1.44 mL,70%乙醇0.64 mL,5%亚硝酸钠溶液0.16 mL,混匀,放置6 min,再加10%硝酸铝溶液0.16 mL,混匀,放置6 min,加5%氢氧化钠溶液1.6 mL,混匀,静置12 min,在510 nm处用酶标仪测定吸光度,以0.00 mg/mL的溶液为空白对照。以吸光值为横坐标(x),为芦丁质量浓度纵坐标(y),绘制标准曲线,得回归方程y=0.144 0x-0.010 9,R2=0.997 6。准确称取花生壳提取物0.005 0 g,用 70%的乙醇溶解,并定容至10 mL,用上述相同的显色方法显色,并测定吸光度值,按下式计算花生壳提取物中总黄酮的含量。
总黄酮含量(%)=

2.3 花生壳提取物中木犀草素含量的测定
准确称取25 mg木犀草素,用70%乙醇溶解并定容至25 mL,得1 mg/mL木犀草素溶液,再分别配置500、250、125、62.5、31.25 μg/mL的溶液,然后用HPLC绘制标准曲线,以含醋酸1%的水和乙腈为洗脱剂进行梯度洗脱,在10 min内乙腈由10%增至90%,再在3 min内由90%降至10%,再恒梯度至结束,进样量20 μL,流速1 mL/min,柱温25 ℃,检测波长345 nm,每个样品平行测定三次取平均值,以质量浓度(y)对峰面积(x×10-7)做标准曲线,得回归方程y=35.1x-4.44,R2=0.999 1,在15.625~250 μg/mL存在良好的线性关系。准确称取0.001 20 g花生壳提取物,用70%的乙醇溶解样品并定容,配成300 μg/mL的溶液,按上述相同的方法用HPLC进行定量, 按下式计算花生提取物中木犀草素的含量。
2.4 花生壳提取物脲酶抑制活性测定
脲酶的活性测试参照文献报道的方法进行[13],具体步骤如下:第一排设为空白组,第二排设为对照组,其余设为实验组,在96孔板中每孔加入25 μL脲酶溶液(0.35 μg/mL),空白组和对照组每孔加入25 μL的磷酸缓冲溶液(50 mM,pH=7.8),实验组每孔加入25 μL花生壳提取物的磷酸缓冲溶液,在37 ℃恒温箱下共培养50 min,空白组每孔加入50 μL的磷酸盐缓冲溶液,对照组和实验组每孔加入50 μL的25 mmol/L的尿素溶液。在37 ℃恒温箱下共培养30 min后,依次加入A试剂50 μL (127 mmol/L苯酚和0.168 mmol/L硝普钠)和B试剂50 μL(125 mmol/L NaOH和11.3 mmol/L NaOCl),37 ℃下显色35 min,在620 nm下测定吸光值A,抑制率按如下公式计算:
2.5 花生壳提取物与脲酶作用的动力学
用Nicoya SPR分子作用仪对花生壳提取物进行配体-酶的动力学分析。将花生壳提取物用PBS溶液溶解,并配成53.0、26.5、13.3 μg/mL的溶液,装载已固定好脲酶的功能纳米金芯片,流动相为PBS溶液,进样量200 μL,流速20 μL/min,仪器记录下分析物-酶的结合-解离动力学曲线,用TraceDrawer软件对曲线进行分析,获得相应动力学参数。
2.6 分子对接
幽门螺旋杆菌脲酶的单晶X-衍射结构从PDB蛋白数据库中下载(PDB 编号:1e9y)[14],通过SYBYL-X(2.1.1,Tripos,Inc.,St.Louis,MO)软件[15]处理脲酶-乙酰氧肟酸复合物分子,移去复合物分子中的共结晶水、配体乙酰氧肟酸和重复结构单元、无活性点的亚基,对处理后的大分子进行加氢处理,将乙酰氧肟酸结合口袋作为活性点用于对接,基于SYBYL-X中的CSCORE模块对配体对接构象进行打分,打分函数包括ChemScore、D-Score、G-Score和PMF-Score等,基于打分函数选取最佳配体构象。
3 结果与讨论
3.1 花生壳提取物的制备
考虑到花生壳提取物在医药和食品领域中应用的可能性,排除氯仿、二氯甲烷、甲醇等作为提取的溶剂,选用安全性高的第三类溶剂乙醇进行提取,通过筛选,用70%的乙醇对花生壳进行提取可以获得比较理想的提取效果。60 g花生壳用该溶剂提取三次,得浅棕色膏状物质3.48 g,提取率为5.8%,与文献报道的提取率接近[16],提取率按如下公式进行计算:
3.2 花生壳提取物的主要组成
用亚硝酸钠-硝酸铝比色法测定提取物中总黄酮含量,以芦丁作为参比物质绘制工作曲线(图1),测得花生壳中总黄酮的含量按芦丁计为29.5%。用同属于第三类溶剂的乙酸乙酯提取,虽所得提取物中总黄酮含量更高,可达33.9%,但提取率较低,为1.6%[17],相比之下,本研究使用70%乙醇可以获得更高的提取效率,对花生壳总黄酮的提取率可达1.71%,高于文献中类似方法的总黄酮提取率(0.25%~1.42%)[18],但低于酶法总黄酮的提取率(3.08%)。相比之下本研究使用的方法操作简单、工艺成熟,易于放大生产。
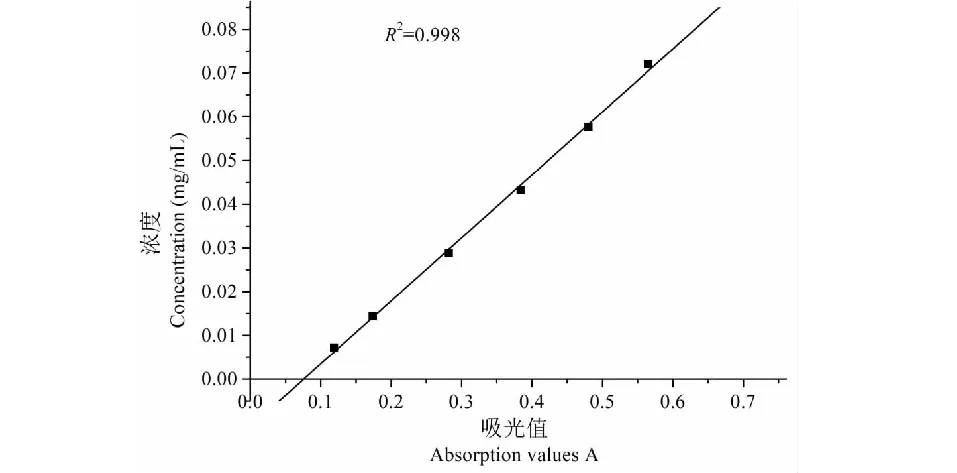
图1 芦丁的标准曲线Fig.1 Standard curve of rutin
采用高效液相色谱外标定量法测定花生壳提取物中的木犀草素,标准曲线如图2所示,据此测定出花生壳提取物中木犀草素的含量为11.7%,虽然提取物中总黄酮含量有29.5%,但那是按芦丁计所得的含量,若转化为按木犀草素计,则应该是13.8%,与按高效液相外标定量测定的含量十分接近,这与文献报道的花生壳提取物中总黄酮以木犀草素为主的研究结果是一致的[18],花生壳中木犀草素的含量占总黄酮的84.8%。对木犀草素标准品和花生壳提取物的液相色谱图(图3)进行比较,进一步证明了上述论断。
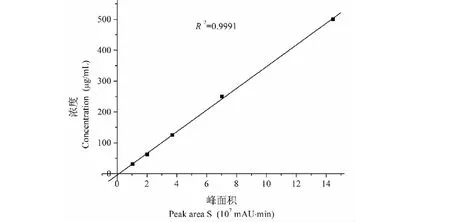
图2 木犀草素含量测定标准曲线Fig.2 Standard curve for determination of luteolin content
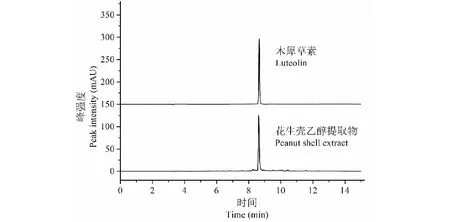
图3 木犀草素标准品和花生壳提取物的液相谱图Fig.3 Liquid phase spectrum of luteolin standard and peanut shell extract
3.3 花生壳提取物脲酶抑制活性
采用课题组使用多年的脲酶活性测定的方法,测定了花生壳提取物的脲酶抑制活性,提取物对脲酶表现了很好的抑制活性,当提取物浓度达到1.25 mg/mL时几乎完全抑制了脲酶的活性,抑制率达到96.6%,将提取物浓度的对数与脲酶抑制率按Logistic函数进行非线性拟合(图4),拟合结果表明花生壳提取物抑制脲酶的IC50为48.1±2.7 μg/mL,若假定这种抑制的贡献全来自于木犀草素,则折合后IC50应为5.63±0.32 μg/mL(19.69±1.12 μM),事实上文献报道的纯木犀草素抑制脲酶的IC50应为35.4±2.0 μM[19],花生壳折合活性接近纯木犀草素活性的2倍,说明花生壳中的其他成分也对脲酶抑制活性有贡献,并且存在协同增效作用。花生壳提取物的显著脲酶抑制活性为花生壳在预防和治疗胃病方面的应用提供了理论依据。
3.4 花生壳提取物与脲酶结合的动力学
用Nicoya SPR分子作用仪测定了花生壳提取物与脲酶结合的动力学过程,获得如图5所示分子相互作用动力学曲线,对动力学曲线进行拟合获得相应动力学参数如下,花生壳提取物与脲酶的结合-解离平衡常数KD为0.11±0.02 μg/mL(0.38±0.07 μM),表明花生壳提取物与脲酶具有很高的亲和力。

图4 花生壳提取物脲酶抑制浓度依赖曲线Fig.4 Urea enzyme inhibition concentration dependence curve of peanut shell extract
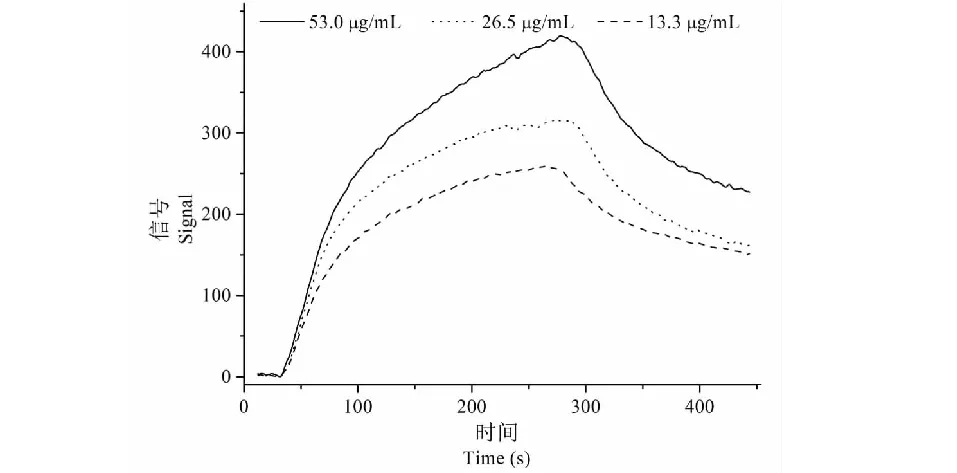
图5 花生壳提取物与脲酶结合动力学曲线Fig.5 Kinetic curve of peanut shell extract and urease binding
3.5 分子对接研究
为了说明花生壳中主要活性成分木犀草素使脲酶失活的机制,利用SYBYL软件将木犀草素与脲酶进行对接,对接结果如图6所示,木犀草素以B环的两个羟基与脲酶活性中心的两个Ni离子形成较强的配位键(1.999-3.781Å),同时这两个羟基又作为氢键供体分别与ASP362和HIS221形成O-H…O(1.990Å)和O-H…N(1.594Å),B环还与ARG338形成N-H…π键,键长为3.823Å,木犀草素的C环一方面与CYS321形成S-H…π键(2.683Å),另一方面与MET366形成C-H…π键(2.595Å),这些作用使木犀草素分子与活性口袋形成了紧密结合,从而使尿素分子无法进入活性腔,从而使脲酶失活。
4 结论
花生壳的乙醇提取物的总黄酮含量以芦丁计为29.5%,主要黄酮种类为木犀草素,占总黄酮的84.6%,花生壳提取物对脲酶有较好的抑制作用,IC50为48.1±2.7 μg/mL,比纯木犀草素具有更低的IC50,揭示了花生壳提取物中的其他成分也有一定的脲酶抑制作用,并与木犀草素存在协同增效作用。良好的脲酶抑制活性为花生壳提取物用于预防和治疗胃病提供了理论依据,分子相互作用和对接研究表明木犀草素分子与脲酶具有较强的亲和能(KD=0.11±0.02 μg/mL),通过羟基与Ni离子的配位和木犀草素分子与活性点周围氨基酸残基的相互作用,木犀草素分子与脲酶分子产生紧密结合。花生壳中的其他脲酶抑制成分和之间的协同增效作用研究正在进行中。

图6 木犀草素与脲酶活性点结合模式Fig.6 Luteolin and urease active point binding mode
